超声引导下准分子激光消蚀术治疗股腘动脉慢性完全闭塞
2021-05-31张克伟李卫校武辉林翟水亭
李 坤,张克伟,李卫校,武辉林,翟水亭
(河南省人民医院 河南大学人民医院 郑州大学人民医院血管外科,河南 郑州 450003)
股腘动脉(femoral popliteal artery, FPA)长段慢性完全闭塞(chronic total occlusions, CTO)疾病在外周血管疾病中占比达50%以上[1]。目前采用腔内技术治疗复杂CTO仍有较高的失败率及并发症发生率,优化治疗策略对提高手术成功率和中长期临床疗效具有重要意义[2-3]。准分子激光消蚀术(excimer-laser atherectomy, ELA)可开通病变段血管真腔,并实现管腔减容。本研究评价血管外超声(extravascular ultrasound, EVUS)引导下ELA治疗FPA复杂 CTO的效果及安全性。
1 资料与方法
1.1 研究对象 纳入2018年1月—2019年6月41例于河南省人民医院血管外科接受EVUS引导下ELA治疗的FPA CTO患者,男28例,女13例,年龄37~76岁,平均(68.2±11.8)岁;其中18例严重间歇性跛行,11例下肢静息痛,12例下肢坏疽或溃疡;29例合并高血压,14例合并冠心病,17例合并糖尿病,10例合并脑卒中。纳入标准:①年龄≥18岁;②FPA至少1处闭塞,长度≥10 cm;③Rutherford分级[4]为3~6级;④6个月内未接受血管介入治疗;⑤至少存在1条相对良好的远端流出道(狭窄<50%)。排除标准:①临床或随访资料不完整;②伴严重心、脑或肺等重要脏器基础病变而不能耐受手术;③髂动脉病变未能处理或治疗失败;④合并急性肢体缺血(acute limb ischemia, ALI);⑤非动脉硬化性血管病变;⑥预计生存期<1年。根据病变部位分为股浅动脉(superficial femoral artery, SFA)组(n=23)及FPA组(n=18)。本研究通过院伦理委员会批准(伦理编号:201708017)。术前患者均签署手术同意书。
1.2 仪器与方法 以Philips Allura Xper FD200 DSA机为介入引导设备。由2~3名具有3年以上工作经验的血管外科医师进行操作。常规麻醉、消毒铺巾后,选择病变对侧股动脉穿刺“翻山”入路,全身肝素化后,根据下肢动脉闭塞起始部位选择不同长度8F抗折鞘(Cook);将直径2.0 mm Turbo-Elite激光导管(Spectranetics)穿过7F MPA指引导管(Cordis),并沿V18导丝(Boston Scientific)送至目标位置;扭转7F指引导管,调整激光导管的头端走向,使激光导管抵住钙化帽正中,另一端连接准分子激光发射仪(Spectranetics),波长308 nm。采用Philips SPARQ超声诊断仪,频率3 MHz L11线阵探头扫查闭塞段血管管腔与股深动脉、股总动脉,观察其相对位置,同时调整指引导管,使激光导管头端正对闭塞段开口纤维帽处;激光导管在无导丝指引条件下被激活,随后缓慢推动导管前进2~3 mm,突破纤维帽后以导丝跟进,并在EVUS引导下探查真腔;期间受阻时激光导管继续跟进并再次被激活,并推进2~3 mm,逐步通过闭塞段直至导丝通过远端纤维帽进入动脉真腔。导丝通过病变建立导丝通路后,以激光导管再次处理闭塞全段以消蚀斑块,每次激活前均应于EVUS引导下确定导管正对管腔正中,以避免导致血管壁穿孔。之后以直径4~6 mm球囊进行扩张,如残余狭窄>30%或出现限流性夹层,则行补救性支架植入术;如顺行通过失败并于内膜下通过,则穿刺病变远端正常血管进行逆向开通,之后以相同方法开通病变段血管(图1)。术中参照文献[5]标准判断病变钙化程度。术后予阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)治疗。
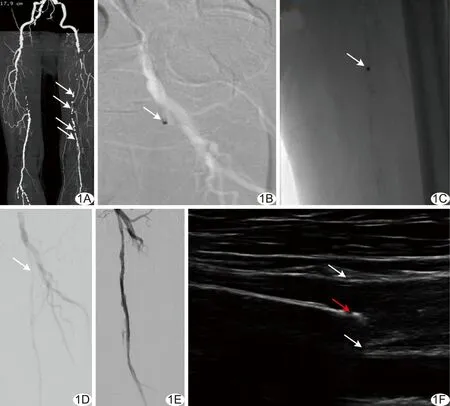
图1 患者男,76岁,下肢动脉硬化闭塞症,TASC Ⅱ分级D级 A.术前CT重建图像示SFA开口至腘动脉P1段闭塞,伴严重钙化(箭); B.术中造影示激光导管在EVUS引导下突破纤维帽(箭); C.以激光导管消蚀闭塞段并逐步引导导丝于真腔内通过病变(箭); D.激光导管在EVUS引导下通过病变,成功建立导丝通道(箭); E.术后复查造影显示原病变段管腔减容,血流通畅; F.超声声像图实时显示激光导管激活状态(红箭)及其与血管壁(白箭)的位置关系
1.3 疗效评价及随访 以术中造影确认或超声测定导丝末端到达远端真腔为通过成功。初期通过成功指按照术前设定方案顺行沿真腔开通病变,导丝末端达到远端真腔;二期通过成功指导丝无法按照预定方案于真腔内通过病变段血管,而于内膜下开通或更改穿刺点逆行开通。手术成功定义为成功开通病变,造影显示残余狭窄<30%,并至少存在1支远端流出道。术前依据泛大西洋协作组(TransAtlantic Inter-Society Consensus, TASC)Ⅱ标准进行分级[4]。记录术前、术后1周及6个月踝肱指数(ankle brachial index, ABI)。于术前、术后1个月及6个月进行Rutherford分级,并判断有无并发症,包括手术相关并发症及术后1个月内严重不良事件(serious adverse event, SAE)。于术后1个月、6个月及12个月行下肢动脉CT血管造影(CT angiography, CTA)检查,计算通畅率(%),即术后随访超声或CTA显示靶病变残余狭窄度<30%。
1.4 统计学分析 采用SPSS 25.0统计分析软件。以±s表示服从正态分布的计量资料,组间行独立样本t检验;以中位数(上下四分位数)表示不服从正态分布的计量资料,行两独立样本Mann-WhitneyU检验;以频数和百分率表示计数资料,以χ2检验或Fisher精确概率法进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 开通前评价 41例FPA CTO,病变段血管中位长度为20.00(14.50,40.00)cm,FPA组病变长度大于SFA组(P=0.002),流出道数目中位数2.0(1.0,3.0)支。27例(27/41,65.85%)病变段血管存在中度钙化,14例(14/41,34.15%)重度钙化。41例中,18例(18/41,43.90%)Rutherford分级为3级,11例(11/41,26.83%)为4级,9例(9/41,21.95%)为5级,3例(3/41,7.32%)为6级,术前FPA组Rutherford分级高于SFA组(P=0.014);10例(10/41,24.39%)TASC Ⅱ分级为B级,8例(8/41,19.51%)为C级,23例(23/41,56.10%)为D级。ABI组间差异无统计学意义(P=0.991),见表1。

表1 41例FPA CTO患者接受EVUS引导下ELA治疗后随访结果
2.2 术中操作及成功率 41例手术均成功,平均手术时间(108.33±27.51)min,平均射线照射时间(37.45±9.90)min,对比剂用量50.0(35.0,65.0)ml;激光发射能量60(55,65)mJ/mm2,激光发射频率为45(45,55)Hz;初期通过成功率80.49%(33/41),8例(19.51%,8/41)接受补救性支架植入术。最终通过成功率为100%,35例(35/41,85.37%)为顺行开通,其中33例真腔通过,2例于内膜下通过;6例(6/41,14.63%)经双向开通,其中5例于内膜下通过、1例为真腔通过。全组真腔通过率82.93%(34/41),初期通过成功率为80.49%(33/41),二期通过成功率为19.51%(8/41);手术成功率为100%。
2.3 安全性 41例中,6例(6/41,14.63%)出现限流性夹层,2例(2/41,4.88%)出现远端栓塞,3例(3/41,7.32%)发生SFA中段穿孔,1例(1/41,2.44%)穿刺点血肿。SAE包括2例(2/41,4.88%)患肢ALI,2例(2/41,4.88%)行临床症状驱使下靶病变血运重建,1例(1/41,2.44%)接受非计划性截肢;1例(1/41,2.44%)合并心肌梗死,2例(2/41,4.88%)合并脑卒中。
2.4 随访及预后 术后2组ABI及Rutherford分级差异均无统计学意义(P均>0.05)。SFA组术后12个月通畅率明显高于FPA组(P=0.005)。术后全部患者ABI较术前均明显提高(P均<0.05)。FPA组Rutherford分级较术前均明显降低(P均<0.05);SFA组术后1个月Rutherford分级较术前明显降低(P<0.05),术后6个月与术前差异无统计学意义(P>0.05)。见表1。术后1个月内无死亡患者,无肝肾损伤发生。
3 讨论
顺行开通FPA 复杂CTO的失败率较高[3]。激光导管具有较强的开通病变和减容能力,但其尖端缺乏指向性和可控性,限制了其开通病变的能力。本研究在EVUS引导的基础上,利用具有指向性的头端呈“J”形的指引导管控制直头激光导管尖端方向,并采用压力泵持续以盐水冲洗导管,实时监测激光导管在闭塞段的位置,并调整导管进行定向开通,优化了操作方法,改善激光导管顺行真腔开通FPA复杂CTO的能力,有利于提高手术成功率和减少并发症。
开通CTO的关键步骤是导丝成功通过病变段血管[2],而FPA复杂 CTO更是带来诸多挑战,超过20%的FPA病变不能成功顺行开通[6]。理想途径为经真腔通过病变段,真腔开通后支持所有治疗选择,并可明显减少夹层和穿孔等并发症;如开通过程中缺乏直观可靠的实时判断依据,常难以监测是否全程真腔通过[7]。超声具有实时及可视性,现已成为腔内介入手术最重要的辅助工具之一,有助于提高真腔通过CTO病变的可能性[8-10],最小化射线暴露时间及对比剂用量。
ELA通过导管尖端光化学、光机械和光热效应消蚀动脉硬化纤维斑块,既能通过病变,又可实现管腔减容,优化了腔内治疗方案,具有较高的安全性和有效性。交替推进导丝和激光导管进行激光消蚀,直至通过病变使导丝进入远端真腔的策略称之为“step-by-step”技术[11],开通率成功可达93%[2];但激光导管直头端缺乏指向性和方向可控性,在闭塞管腔内推送时可能发生方向偏离而导致血管管壁穿孔。本研究引入EVUS技术引导ELA开通FPA 复杂CTO,于抗折鞘内引入MPA导管增加其方向性,以期最大限度发挥激光性能,有效提高真腔开通成功率。本研究所有患者均成功通过病变建立导丝通路,初期通过成功率80.49%,甚属满意;随着导丝于真腔内通过病变,跟进激光导管可有效进行管腔减容,术后患者症状明显改善或消失,ABI明显提高,Rutherford分级改善;本研究术后6个月SFA组原病变段血管管腔通畅率82.61%、FPA组72.22%,术后12个月分别为69.57%和44.44%,考虑与本组CTO病例病变段较长、钙化严重,且开通后未行涂药球囊扩张等治疗有关。
总之,采用EVUS引导ELA开通FPA复杂CTO安全、有效,多可经真腔开通病变并实现管腔减容,成功率较高。但本研究样本量较少,病变较为复杂,随访时间较短,需进一步观察加以验证。
