趋化因子诱导的T细胞对结直肠癌微环境的影响①
2021-05-25唐言华刘继武贵阳市第一人民医院胃肠外科贵阳550002
徐 辉 唐言华 刘继武 王 亮(贵阳市第一人民医院胃肠外科,贵阳550002)
结直肠癌(colorectal cancer,CRC)是胃肠道常见恶性肿瘤,随人口老龄化及生活饮食习惯改变,其发病率与死亡率呈上升趋势[1]。医疗技术进步使化疗及靶向治疗广泛应用于CRC治疗,但患者5年生存率仅为49%左右,研究认为与其侵袭及转移无法被有效抑制相关[2-3]。近期研究报道,控制CRC侵袭与转移需抑癌基因、癌基因及其基因产物等基因调控及免疫细胞、细胞因子等应答细胞亚群参与[4]。CRC大鼠体内研究发现,获得性免疫细胞CD4+T细胞、CD8+T细胞、T辅助细胞1(Thelper cell 1,Th1)、Foxp3+调节性T细胞(regulatory T cells,Tregs)在CRC大鼠癌组织中呈高表达,且与肠道细胞损伤密切相关[5]。临床研究指出,CRC患者肿瘤组织中可检测到各种应答细胞亚群及趋化因子CXCL12、CCL20-CCR6、CX3CLI-CX3CR1和CX3CL1,提示趋化因子与应答细胞亚群进入癌组织相关[6]。进一步探讨CRC形成机制发现,肠道共生细菌可刺激免疫细胞浸润肠道固有层释放促炎细胞因子形成应答细胞亚群,对肿瘤细胞生长起抑制作用,但其与趋化因子的关系尚未阐明。因此,本研究探讨CRC组织中应答细胞亚群、趋化因子与肠道微环境间的关系,构建微环境触发的CRC细胞系以明确肠道微生物群过表达对趋化因子及对CRC细胞免疫应答行为的影响。
1 资料与方法
1.1 资料
1.1.1 研究对象 收集2017年1月至2019年1月我院收治的41例CRC患者的癌组织及癌旁正常组织,男性28例,女性13例,年龄40~79岁,平均年龄(66.14±10.67)岁;高分化6例,中分化27例,低分化8例;Dukes分期A/B期29例,C/D期12例;无淋巴结转移28例,有淋巴结转移13例。入选标准:①符合《结直肠癌诊疗规范(2010年版)》诊断标准[7];②未接受放化疗治疗;③病例资料齐全;④入院前无重大出血病史;⑤肝、肾、心功能正常。排除标准:①合并其他恶性肿瘤;②治疗耐受性差;③术前接受生物学治疗或内分泌治疗;④患者对本研究有异议;⑤近期使用过免疫调节剂或激素类药物。本研究经医学伦理会批准,所有患者及家属知情同意。
1.1.2 实验动物 雄性SPF级NSG小鼠24只,体重15.32~19.67 g,6~8周龄,购自北京医疗器械检验所,许可证号:SCXK(青)2018-0031。动物使用和处理符合《国家卫生研究院实验动物保护法和使用指导》要求,经过医学动物伦理委员会批准,审批号:20180209,于医学院实验动物研究中心[SYXK(青)2018-0411]完成实验,室温18~22℃、湿度45%~50%、12 h明/12 h暗交替,自由摄食摄水。
1.1.3 主要试剂 总RNA提取试剂盒(上海硕嘉生物);DNA提取试剂盒(迈瑞生物);反转录试剂盒(北京中生柏奥生物);miRNA-21引物(苏州吉玛基因);琼脂糖(上海康润生物);PCR反应液(北京索莱宝);DEPC水(四川康百瑞生物);Trizol溶液(北京百奥森泰生物);RT-PCR扩增试剂盒(Sigma);Trizol裂解液(北京百奥森泰生物技术有限公司);氨苄青霉素钠/氨苄西林钠(先泰药业);盐酸万古霉素(浙江海正);BCA试剂盒(上海经科化学科技有限公司);CXCL12、CCL20-CCR6、CX3CLI-CX3CR1、CX3CL1单克隆抗体一抗(北京百奥莱博科技有限公司):GAPDH单克隆抗体一抗(厦门研科);山羊抗兔二抗(武汉赛维尔生物);ECL发光试剂盒(上海古朵)。
1.2 方法
1.2.1 体内实验 NSG小鼠腹膜和肠内注射LS180细胞生成肿瘤异种移植物构建肠内肿瘤模型;从第10天开始,将1 g/L氨苄青霉素钠/氨苄西林钠和0.2 g/L盐酸万古霉素溶于饮用水中给药,第29天,将携带肿瘤小鼠采用CFSE标记的CD4+和CD8+T细胞过继转移,从主要CRC样品中分离并于体外扩增(5×106个/只),2 d后采用流式细胞术在消化肿瘤的细胞悬浮液中评估转移T细胞群频率。
1.2.2 RT-PCR 采用总RNA提取试剂盒提取CRC和癌旁正常组织中总RNA,RNA中基因组DNA消除并除去DNase1后,采用反转录试剂盒逆转录为cDNA,以cDNA为模板进行PCR扩增,扩增体系为:SYBR Green Mix 10µl,上游引物5 mol,下游引物5 mol,cDNA模板1µl,ddH2O ddH2O 8µl,总体积20µl;反应条件:95℃预变性3 min,95℃变性5 s,56℃退火10 s,72℃延伸25 s,39次循环。扩增产物经1.5%琼脂糖凝胶电泳,凝胶成像系统扫描分析,测定各扩增带吸光度,以目的基因与β-actin吸光度比值计算CD4+、CD8+、Th1、Foxp3+表达。
1.2.3 Western blot 取CRC和癌旁正常组织细胞,裂解,匀浆,离心,提取蛋白,BCA试剂盒进行蛋白定量,取总蛋白上样,电泳,切胶,湿转,TBS-T封闭,加入CXCL12、CCL20-CCR6、CX3CLI-CX3CR1、CX3CL1单克隆抗体一抗(1:300)、GAPDH单克隆抗体一抗(1:1 000),4℃孵育过夜,洗膜,加入山羊抗兔二抗,37℃孵育60 min,洗膜,ECL发光试剂盒显色,洗片,显影、定影,以GAPDH为内参,成像扫描分析系统测定内参和目的条带灰度值。
1.2.4 肠道菌群检测 取湿重粪便样品反复离心,去除杂质,洗涤获取菌体,L棒均匀涂抹于不同培养基,采用细菌基因组DNA提取试剂盒提取细菌总DNA,引物根据目标细菌16SrRNA设计;粪便细菌DNA样品与标准品(1:10稀释)同时进行RT-PCR反应,每次反应条件及反应体系相同,反应结束后采用溶解曲线分析PCR产物特异性,每g粪便样品待测细菌基因的拷贝数采用标准曲线及Ct值,通过菌落形态、格兰染色镜检、生化反应等鉴定菌落数作为定量结果。
1.3 统计学分析 采用SPSS22.0软件进行统计学分析,基因表达水平比较采用Wilcoxon符号秩检验;根据公式(Spearmanr值×对应趋化因子受体阳性细胞百分比)计算T细胞标志物显著相关趋化因子得分;USEARCH软件(V.8.1.1861)分析序列;DESeq2软件(V.1.12.4)进行标准化丰度计数的操作分类单位差异分析;Microsynth AG进行基因库、测序和数据分析。P<0.05表示差异有统计学意义。
2 结果
2.1 T细胞群表达比较 本研究在62个CRC和相应无肿瘤结肠组织中分析了编码免疫细胞标志物的基因表达,包括总T细胞(CD3)、T辅助细胞(CD4)、细胞毒性T淋巴细胞(CTL)(CD8)、Th1(Tbet和IRF-1)、Th2(IL-4、IL-5和IL-13)、Th17(IL-17)、Tfh(CXCR5)及Tregs(Foxp3+),结果发现CD8+、Th1、Foxp3+T细胞标志物均有表达,IL-4、IL-5在所有样品中均未检测到表达(数据未显示),其余仅在少数样品中表达,表明CRC中Th1、Th2、Tfh细胞的CRC浸润微弱。CD4+、CD8+、Th1、Foxp3+在CRC组织中均有表达;CRC组织中CD4+表达低于癌旁正常组织(P<0.05),CD8+、Th1、Foxp3+表达高于癌旁正常组织(P<0.05),见表1。
2.2 趋化因子表达比较 CXCL12、CCL20-CCR6、CX3CLI-CX3CR1、CX3CL1在CRC组织中均有表达;CRC组织CXCL12表达低于癌旁正常组织(P<0.05),CCL20-CCR6、CX3CLI-CX3CR1、CX3CL1表达高于与癌旁正常组织(P<0.05),见表2。
2.3 T细胞群与趋化因子过表达相关性分析 CD4+、CD8+、Th1、Foxp3+与CXCL12、CCL20-CCR6、CX3CLICX3CR1、CX3CL1均呈显著正相关(P<0.05),见表3。无监督层次分析中,样本聚集于3个主要组:第1组特征为多数T细胞标志物过度表达(簇高),第2组显示异质表达(簇中),第3组特征为所有T细胞标记基因表达下调(簇低),见图1。
2.4 趋化因子与T细胞亚群CRC浸润的关系 CD4+相关趋化因子特征主要包括CXCL12、CCL20-CCR6、CX3CLI-CX3CR1,CD8+相关趋化因子特征主要包括CXCL12、CX3CLI-CX3CR1、CX3CL,Th1相关趋化因子特征主要包括CX3CLI-CX3CR1、CX3CL,Foxp3+相关趋化因子特征主要包括CXCL12、CCL20-CCR6(图2)。
表1 T细胞群表达比较(±s,n=41,%)Tab.1 Comparison of T cell subgroups expressions(±s,n=41,%)

表1 T细胞群表达比较(±s,n=41,%)Tab.1 Comparison of T cell subgroups expressions(±s,n=41,%)
Groups CRCtissue Adjacent tissue t P CD4+0.22±0.08 2.69±0.63 24.904<0.001 CD8+4.11±1.33 0.48±0.30 17.048<0.001 Th1 6.77±2.03 3.02±0.59 11.358<0.001 Foxp3+4.32±1.26 0.69±0.05 18.433<0.001
表2 趋化因子表达比较(±s,n=41)Tab.2 Comparison of chemokineexpressions(±s,n=41)

表2 趋化因子表达比较(±s,n=41)Tab.2 Comparison of chemokineexpressions(±s,n=41)
Groups CRCtissue Adjacent tissue t P CXCL12 0.16±0.05 3.67±1.10 20.411<0.001 CCL20-CCR6 4.53±1.20 2.02±0.64 11.818<0.001 CX3CLI-CX 3CR1 2.69±0.54 0.23±0.09 28.773<0.001 CX3CL1 4.77±1.32 3.35±1.01 5.471<0.001

表3 T细胞群与趋化因子过表达相关性分析Tab.3 Correlation analysis between T cell subsets and chemokine overexpression

图1 无监督层次聚类图Fig.1 Unsupervised hierarchical clustering image
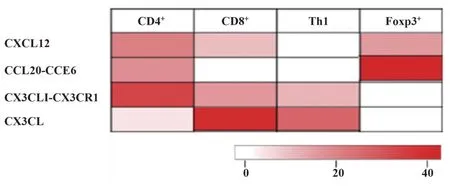
图2 趋化因子与T细胞亚群CRC浸润的关系Fig.2 Relationship between chemokines and infiltration of CRC in T cell subsets
2.5 T细胞汇聚趋化因子图 体内培养CRC细胞中趋化因子均呈高表达,体内CRC组织中CRCCXCL12、CCL20-CCR6、CX3CLI-CX3CR1、CX3CL表达高于体外CRC组织中基因表达水平(P<0.05),见图3。
2.6 肠道微生物群对CRC细胞趋化因子表达的影响 本研究假设肿瘤细胞中趋化因子的产生可能由肠道菌群衍生微生物刺激引发,采用T细胞激动剂刺激正常细胞系和CRC细胞系诱导其趋化因子基因重新表达,结果发现,激动剂刺激CRC细胞系后 趋 化 因 子CXCL12、CCL20-CCR6、CX3CLICX3CR1、CX3CL与肠道微生物群各因子可同时表达,且趋化因子表达水平与肠道微生物群因子相关,见图4。
2.7 肠道微生物群与T细胞浸润的关系 体内肿瘤T细胞群迁移率高于体外肿瘤(P<0.05),见图5。
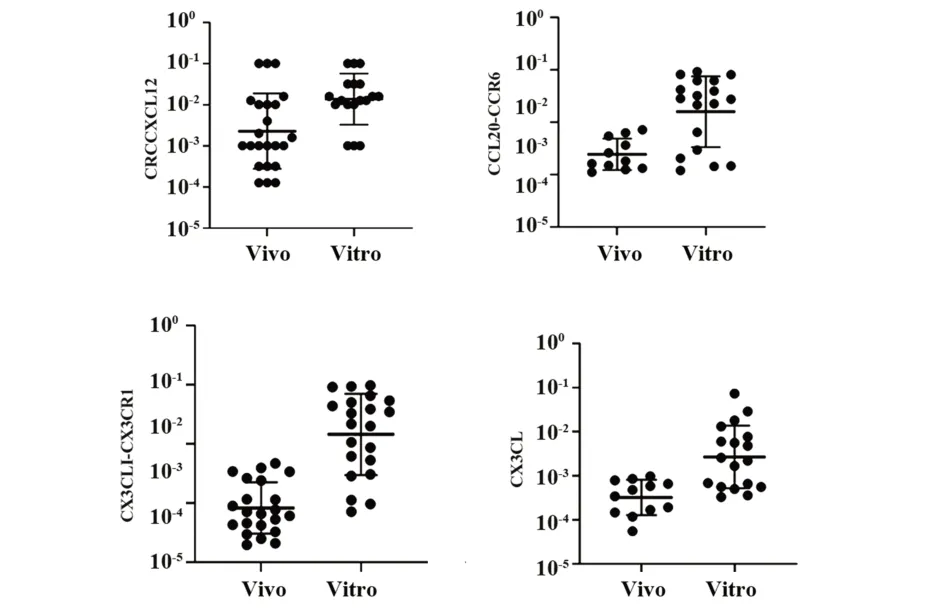
图3 T细胞募集趋化因子图Fig.3 Imagesof chemokines recruited by T cells

图4 肠道微生物群对CRC细胞趋化因子表达的影响Fig.4 Effect of intestinal microflora on expressions of che⁃mokines in CRC cells

图5 肠道微生物群与T细胞浸润的关系Fig.5 Relationship between intestinal microflora and T cell infiltration
3 讨论
作为常见消化道恶性肿瘤,CRC发病率与病死率均显著上升[8]。REX等[9]回顾性分析显示,CRC患者中位无进展生存期为89.0个月,中位总生存期为129.0个月,与欧美国家相比总生存期延长。但肿瘤侵袭与转移为多步骤、多因素、多阶段的复杂过程,CRC细胞脱落后沿组织间隙侵袭蔓延至淋巴管,在淋巴循环中转运、滞留、扩散并增殖,单个或几个CRC细胞发展为微转移灶,导致CRC患者短期生存率逐年下降。TIAN等[10]认为抑制CRC发生、侵袭及转移应关注其内环境及细胞因子水平变化。
研究证实,趋化因子是维持肠道正常菌群的必需因子,与患者生存改善相关[11];多个研究结果显示,C类因子在多种恶性肿瘤发生、进展中发挥重要作用[12-13];趋化因子为肿瘤相关因子,C类因子是由效应细胞分泌的具有生物活性的小分子蛋白,CXCL蛋白为cl-2原癌基因编码产物,是促细胞存活因子,通过组织细胞色素c从线粒体释放至细胞质抑制细胞凋亡[14]。cl-2为细胞凋亡重要通路,研究表明,cl-2抑制剂已成为CRC治疗的新型药物[15]。CCL-CCR是一种能使细胞无限增殖并促进细胞分裂的基因,与多种肿瘤发生发展密切相关。HAN等[16]研究发现,CCL20-CCR6因子在肺癌患者中高表达,并与TNM分期、组织学分级、淋巴结转移及术后复发密切相关,其过度表达的患者术后复发转移风险明显升高。QIAN等[17]研究发现,结直肠腺癌患者体内CX3类蛋白呈低表达,参与癌症发生发展过程,主要机制为降解细胞内蛋白导致其死亡。SHIBUTANI等[18]采用免疫组化方法分析CRC细胞体内外细胞因子发现,体内细胞因子水平更高,考虑细胞因子参与癌细胞免疫机制、可抑制细胞生长诱导细胞凋亡。CRC细胞在生长过程中快速增殖,代谢异常,机体供血不足导致CRC细胞耗氧量增加发生病理性缺氧,而病理性缺氧可刺激CD4+T细胞、CD8+T细胞、Th1细胞表达上调,从而调节微环境生成以缓解病理性缺氧[19]。提示趋化因子通过募集特定T细胞群共同作用于癌组织发挥作用。
本研究选取CRC组织和癌旁正常组织进行检测,通过分析趋化因子、T细胞亚群表达水平及其与肠道微生物群关系阐明其可促进T细胞亚群激活CRC细胞浸润。关于CRC微环境触发因素的报道较少,但对粪便样本进行肠道微生物群分析可将CRC或癌前息肉检出率提高5倍,说明肠道微生物群是CRC的作用机制[20]。肠道微生物群可控制人体对癌症治疗药物的反应[21]。肿瘤可破坏肠道黏液层,肠道细菌进入循环系统,部分可募集至淋巴结的细菌可促进趋化因子生成,促进免疫细胞形成并攻击癌细胞[22]。本研究显示,CRC组织T细胞标志物和趋化因子表达水平高于癌旁正常组织,提示T细胞亚群和趋化因子在CRC检测中的特异性,与既往研究结果相似。本研究通过受体谱间相关性分析确定CRC组织中显著趋化因子特征及与免疫细胞群水平,在2个蛋白相对表达的队列中可见,CCL、CXCR配体与CD4+T细胞、CD8+T细胞、Th1、Foxp3+、Tregs可同时表达,说明趋化因子与T细胞亚群浸润相平行。CCL、CXCR配体表达与CD4+T细胞、CD8+T细胞、Th1、Foxp3+、Tregs显著相关,提示趋化因子与T细胞亚群受某种因素影响募集,对CRC发生发展具有重要意义。细胞亚群因子间表达特征相似,且T细胞因子与Tregs、Th1显示趋化因子受体谱相似,提示CRC组织中T细胞与趋化因子具有相同募集,进一步验证其相关性。而趋化因子吸引有益T细胞群,共同抑制癌细胞增殖和分化,有助于CRC预后改善。本研究证实了T细胞群和趋化因子表达的相关性及其对疗效改善具有重要价值;但受前瞻性分析的限制,未对预后进行评估。为研讨T细胞募集趋化因子的细胞来源,肿瘤细胞对趋化因子的表达研究发现,从体内和体外分离的CRC细胞并对其沉默RNA进行分析,发现体内培养的CRC原代细胞显示出更高的趋化因子基因表达水平。体内细胞因子表达主要受内环境影响;汤钰琪等[23]在小样本实验中证实,肠道肿瘤细胞中,微环境刺激对调节趋化因子表达作用更强。肠道微环境与趋化因子有一定相关性,可能促进其表达上调。既往研究表明,肿瘤上皮细胞中转移的肠道共生细菌可能与肿瘤细胞相互作用并诱导肿瘤生成,也可释放促肿瘤生成细胞因子[24]。T细胞群在促肿瘤生成中起重要作用,本研究也证明肠道细菌可使更多T细胞募集至肿瘤异种移植物中,可能与肠道共生细菌可控制有益免疫细胞肿瘤浸润有关。体外实验结果显示,不同种类CRC相关细菌均可在不同程度促进T细胞募集趋化因子基因表达,进一步说明肠道微环境与T细胞群、趋化因子的相关性。于鑫等[25]研究显示,趋化因子诱导的T细胞主要通过影响肠癌微环境相关因子分泌而导致肠道失衡,本研究体外实验可证实该观点。本研究假设肿瘤细胞中趋化因子产生可能由肠道菌群衍生微生物刺激引发,T细胞激动剂刺激正常细胞系和CRC细胞系,诱导其趋化因子基因重新表达,发现激动剂刺激CRC细胞系后趋化因子CXCL12、CCL20-CCR6、CX3CLICX3CR1、CX3CL与肠道微生物群各因子可同时表达,且趋化因子表达水平与肠道微生物群因子具有一定相关性,证实趋化因子诱导的T细胞对肠癌微环境的影响机制为T细胞诱导的结果。综合本研究结果,考虑可重点关注CRC患者肠道微环境,根据既往研究可采用相关生物制剂或益生菌改善肠道微生态紊乱。另CRC组织中趋化因子表达水平可辅助判断CRC患者肠道微生态变化。
综上,微生物群可触发CRC趋化因子产生,募集T细胞而改善预后,为临床研究提供依据。但本研究受时间限制,收集病例数有限,有待扩大样本数进一步研究。
