lncRNA HOXC-AS3吸附miR-216a-5p促进非小细胞肺癌细胞增殖和迁移的机制研究①
2021-05-25陈吉柏范长玲海南省儋州市人民医院胸心肿瘤外科儋州571799
陈吉柏 范长玲 张 浩(海南省儋州市人民医院胸心肿瘤外科,儋州571799)
肺癌是世界第一大癌症,在恶性肿瘤中致死率最高,且患者数呈逐年上升趋势,非小细胞肺癌(non-small cell lung cancer,NSCLC)患者占患者总数的85%左右,5年生存率低于15%[1-2]。手术和靶向治疗是肺癌个性化治疗的主要手段,研究肺癌细胞增殖和转移的分子机制是肺癌基础研究的热点。长链非编码RNA(long non-coding RNA,lncRNA)在肿瘤中通常表达失调,参与肺癌、乳腺癌、肝癌、结直肠癌及血液系统恶性肿瘤、神经母细胞瘤等肿瘤发生、发展及耐药等过程[3]。多种lncRNA在肺癌中差异表达,参与癌细胞增殖、迁移、凋亡等多种生理过程[4]。HOXC-AS3是一种位于染色体7p13区域的lncRNA,在胃癌、胶质母细胞瘤和乳腺癌等肿瘤组织中高表达,与肿瘤细胞增殖、转移、侵袭有关[5-7]。lncRNA HOXC-AS3在肺癌中表达和作用尚未明确。本研究通过starBase预测发现miR-216a-5p可能是lncRNA HOXC-AS3的靶点,miR-216a-5p在小细胞肺癌(small cell lung cancer,SCLC)中表达下调,与SCLC恶性进展和化学耐药相关[8-9]。lncRNA HOXC-AS3和miR-216a-5p在肺癌中的关系尚未明确。本研究检测两者在肺癌组织和细胞系中的含量,假设lncRNA HOXC-AS3可靶向miR-216a-5p调控肺癌细胞增殖、侵袭和迁移,并对此进行验证,以期为肺癌治疗提供新靶点。
1 资料与方法
1.1 资料
1.1.1 研究对象 选取2017年1月至2018年6月于本院病理检查确诊为NSCLC的患者手术切除的肺癌组织及癌旁组织(距离肺癌组织边缘>1.5 cm)各45例,男性30例,女性15例,年龄23~76岁,平均年龄(51.20±16.22)岁,鳞癌28例,腺癌15例,其他2例。NSCLC分级:Ⅰ级5例,Ⅱ级12例,Ⅲ级19例,Ⅳ级20例。NSCLC诊断标准参照《非小细胞肺癌临床指南》,所有患者术前未接受放化疗治疗。本研究经医院医学伦理委员会批准,所有患者知情同意。
1.1.2 细胞、主要试剂与仪器 人肺癌细胞系H1299、A549、GLC-12和人正常肺上皮细胞株BEAS-2B(ATCC);胎牛血清、DMEM培养基(Gibco公司);胰蛋白酶(Sigma-Aldrich公司);Transwell板(美国Corning公司);细胞增殖抗原Ki-67、细胞周期蛋白D1(Cyclin D1)、基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)、神经型钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)和上皮型钙黏蛋白(E-cadherin)抗体(美国Santa cruz公司);引物、lncRNA HOXCAS3小干扰RNA(si-HOXC-AS3)及其阴性对照、ln⁃cRNA HOXC-AS3过表达载体(pcDNA-HOXC-AS3)及对照空载体(overexpression control)、miR-216a-5p模拟物(mimics)及阴性对照序列(miR-con)、miR-216a-5p抑制剂(anti-miR-216a-5p)及抑制剂阴性对照序列(anti-miR-con)、lncRNA HOXC-AS3野生型(WT-HOXC-AS3)和突变型(MUT-HOXC-AS3)报告载体(上海吉玛制药有限公司);双荧光载体双荧光素酶报告系统试剂盒(美国Promega公司);Lipo⁃fectamine 2000、RNA提取试剂Trizol、Real-time PCR试剂盒、反转录试剂盒(RT-PCR)(美国Invitrogen公司);CCK-8试剂盒、BCA蛋白检测试剂盒(上海碧云天);Real-time PCR仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养 H1299、A549、GLC-12和BEAS-2B细胞培养于含10%FBS、1%青-链霉素的DMEM培养基,培养条件:37℃、5%CO2、湿度97%,每2~3 d更换1次培养基。当细胞生长至80%融合时,0.25%胰蛋白酶消化,收集细胞进行后续实验。
1.2.2 qRT-PCR检测lncRNA HOXC-AS3和miR-216a-5p表达 Trizol试剂提取总RNA,微量核算仪检测RNA纯度和浓度,按照反转录试剂盒说明书合成cDNA,以cDNA为模板进行qRT-PCR反应。反应程序为:94℃预变性4 min,94℃变性30 s,58℃退火30 s,72℃延伸40 s,共35个循环。引 物 序列:lncRNA HOXC-AS3 F:5′-CACCTCTCTCATCGAAAAACCG-3',R:5'-GCACCAGGAAAGAGGACAATTC-3';β-actin F:5'-CTCCATCCTGGCCTCGCTGT-3',R:5'-GCTGCTACCTTCACCGTTCC-3';miR-216a-5p F:5'-TAATCTCAGCTGGCAACT-3',R:5'-GGTGTC⁃GTGGAGTCG-3';U6 F:5'-TGCGGGTGCTCGCTTCG⁃GCAGCA-3',R:5'-CCACTGCAGGGTCCGAGGT-3'。lncRNA HOXC-AS3以β-actin为内参,miR-216a-5p以U6为内参,2-ΔΔCt法计算。
1.2.3 细胞转染 将对数生长期A549细胞调整为1×104个/ml,2.5 ml/孔接种于6孔板,当生长至60%融合时,更换不含FBS的DMEM培养基。根据转染说明书将Silence control、si-HOXC-AS3、overex⁃pression control、pcDNA-HOXC-AS3、si-HOXC-AS3与anti-miR-con、si-HOXC-AS3与anti-miR-216a-5p分别转染至A549细胞中,依次记为si-con组、si-HOXC-AS3组、pcDNA组、pcDNA-HOXC-AS3组、si-HOXC-AS3+anti-miR-con组、si-HOXC-AS3+anti-miR-216a-5p组。转染6 h后更换新鲜培养基,继续培养至48 h,收集细胞用于后续实验。
1.2.4 CCK-8法测定细胞存活率 转染后的各组细胞调整为1×104个/ml,200µl/孔接种于96孔板,培养48 h后,20µl/孔 加入CCK-8溶液,继续培养2 h,酶标仪测定450 nm处吸光度(A),细胞存活率(%)=A实验组/A对照组×100%。
1.2.5 Western blot检测增殖、凋亡、迁移和侵袭相关蛋白表达 转染后的各组细胞调整为1×104个/ml,1.0 ml/孔接种于24孔板,培养48 h后,胰蛋白酶消化,收集细胞,加入RIPA细胞裂解液冰上孵育20 min,充分裂解后,4℃、12 000 r/min离心10 min,-80℃保存备用。BCA法测定上清中蛋白含量,取适量蛋白溶液,加入1×上样缓冲液,混合均匀,100℃煮沸5 min,蛋白变性后,进行SDS-PAGE凝胶电泳,电转至PVDF膜,5%脱脂奶粉室温封闭2 h,分别加入Ki-67(1:1 000)、Cyclin D1(1:1 000)、MMP-2(1:2 000)、MMP-9(1:2 000)、N-cadherin(1:1 000)、Vi⁃mentin(1:1 000)、E-cadherin(1:1 000)和β-actin(1:5 000)一抗,4℃孵育过夜,TBST洗膜3次,5 min/次。加入辣根过氧化酶标记二抗(1:1 000),室温孵育2 h,加入ELC化学发光试剂,避光显影后凝胶成像系统曝光拍照。以β-actin为内参,Image J软件分析蛋白条带灰度值。目的蛋白的相对表达水平以其蛋白条带灰度值与β-actin蛋白条带灰度值的比值表示。
1.2.6 Transwell实验检测细胞迁移和侵袭 迁移实验:转染后的各组细胞用不含血清的DMEM培养基调整浓度为2×105个/ml,Transwell小室置于24孔板,下室加入500µl含10%FBS培养基,上室加入100µl细胞悬液,培养48 h后弃培养基,取出小室,棉签擦去基质胶和上层小室细胞,4%甲醛固定30 min,0.4%结晶紫染色15 min,显微镜观察。随机选取5个视野计数。侵袭实验:将-20℃取出的Matrigel液化后用4℃无血清培养基以1:8比例稀释,取50µl加入Transwell小室上室,自然晾干,加入100µl细胞悬液,下室加入500µl含10%FBS的培养基,后续操作同迁移实验。
1.2.7 划痕实验检测细胞迁移能力 用marker笔在6孔板背后均匀划5条直线,横穿过孔,调整细胞浓度为1×104个/ml,2.5 ml/孔接种于6孔板,当细胞生长至80%融合时,弃培养基,200µl无菌枪头尖端在各孔相同位置划线,PBS冲洗3次,去除划下的细胞,每孔加入无血清培养基培养24 h,拍照,计算细胞划痕愈合率。
1.2.8 双荧光素酶报告实验 生物信息学软件预测显示lncRNA HOXC-AS3与miR-216a-5p的核苷酸序列存在连续结合位点,PCR扩增含miR-216a-5p结合位点的lncRNA HOXC-AS3序列,构建lncRNA HOXC-AS3的野生型(WT-HOXC-AS3)载体。采用基因突变技术将结合位点突变后,构建lncRNA HOXC-AS3突变型(MUT-HOXC-AS3)载体。分别将WT-HOXC-AS3、MUT-HOXC-AS3与miR-con或miR-216a-5p共转染至A549细胞,转染6 h后更换新鲜培养基,继续培养48 h,收集细胞,裂解,离心收集上清,-20℃保存或直接检测荧光素酶活性。以海肾荧光素酶活性为内参,计算相对萤火虫荧光素酶活性。
1.3 统计学处理 采用SPSS19.0软件进行数据处理和分析,所有数据以±s表示,两组间比较采用t检验,多组间比较进行单因素方差分析,总体差异采用LSD-t检验进行两两比较。以P<0.05表示差异有统计学意义。
2 结果
2.1 lncRNAHOXC-AS3和miR-216a-5p在肺癌组织和A549、A549、GLC-12细胞系中的表达 与癌旁组织(45例)相比,肺癌组织组中lncRNA HOXC-AS3水平显著上升,miR-216a-5p水平显著下降(P<0.05);与人正常肺上皮细胞BEAS-2B组相比,肺癌细胞H1299、A549和GLC-12组中miR-216a-5p水平下降,lncRNA HOXC-AS3水平显著上升(P<0.05,表1、2)。体外细胞实验选择水平差异较大的A549细胞进行。
2.2 沉默或过表达lncRNA HOXC-AS3对肺癌A549细胞增殖的影响 与si-con组相比,si-HOXCAS3组A549细胞lncRNA HOXC-AS3表达和细胞活性显著降低,增殖蛋白Ki-67和Cyclin D1表达显著降低(P<0.05);过表达lncRNA HOXC-AS3的pcD⁃NA-HOXC-AS3组则结果相反,见图1、表3。
表1 lncRNA HOXC-AS3和miR-216a-5p在肺癌组织和癌旁组织中的表达(±s,n=45)Tab.1 Expressions of lncRNA HOXC-AS3 and miR-216a-5p in lung cancer tissues and adjacent tissues(±s,n=45)

表1 lncRNA HOXC-AS3和miR-216a-5p在肺癌组织和癌旁组织中的表达(±s,n=45)Tab.1 Expressions of lncRNA HOXC-AS3 and miR-216a-5p in lung cancer tissues and adjacent tissues(±s,n=45)
Note:Compared with adjacent tissuesgroup,1)P<0.05.
Groups Adjacent tissues Lung cancer tissue t P lncRNA HOXCAS3/β-actin 0.94±0.27 3.28±0.671)21.383 0.000 miR-216a-5p/U6 1.03±0.19 0.66±0.131)10.781 0.000
2.3 沉默或过表达lncRNA HOXC-AS3对肺癌A549细胞迁移的影响 与si-con组相比,si-lncRNA HOXC-AS3组MMP-2和MMP-9含量、迁移细胞数和侵袭细胞数显著下降,细胞划痕愈合率降低(P<0.05);过表达lncRNA HOXC-AS3的pcDNA-HOXCAS3组则结果相反(图2、表4)。
表2 lncRNA HOXC-AS3和miR-216a-5p在正常肺上皮细胞株和肺癌细胞株中的表达(±s,n=9)Tab.2 Expressions of lncRNA HOXC-AS3 and miR-216a-5p in normal lung epithelial cell lines and lung can⁃cer cell lines(±s,n=9)

表2 lncRNA HOXC-AS3和miR-216a-5p在正常肺上皮细胞株和肺癌细胞株中的表达(±s,n=9)Tab.2 Expressions of lncRNA HOXC-AS3 and miR-216a-5p in normal lung epithelial cell lines and lung can⁃cer cell lines(±s,n=9)
Note:Compared with the BEAS-2Bgroup,1)P<0.05.
Groups BEAS-2B H1299 A549 GLC-12 F P lncRNA HOXCAS3/β-actin 1.02±0.23 4.15±0.591)5.25±0.421)3.81±0.641)118.155 0.000 miR-216a-5p/U6 1.04±0.12 0.42±0.081)0.36±0.111)0.55±0.091)83.671 0.000

图1 Western blot检测沉默或过表达lncRNA HOXC-AS3对肺癌A549细胞增殖蛋白Cyclin D1和Ki-67表达的影响Fig.1 Effects of silenced or overexpressed lncRNA HOXC-AS3 on expressions of proliferation proteins Cyclin D1 and Ki-67 in lung cancer A549 cells de⁃tected by Western blot
表3 沉默或过表达lncRNA HOXC-AS3对肺癌A549细胞增殖的影响(±s,n=9)Tab.3 Effectsof silenced or overexpressed lncRNAHOXCAS3 on proliferation of lung cancer A549 cells(±s,n=9)
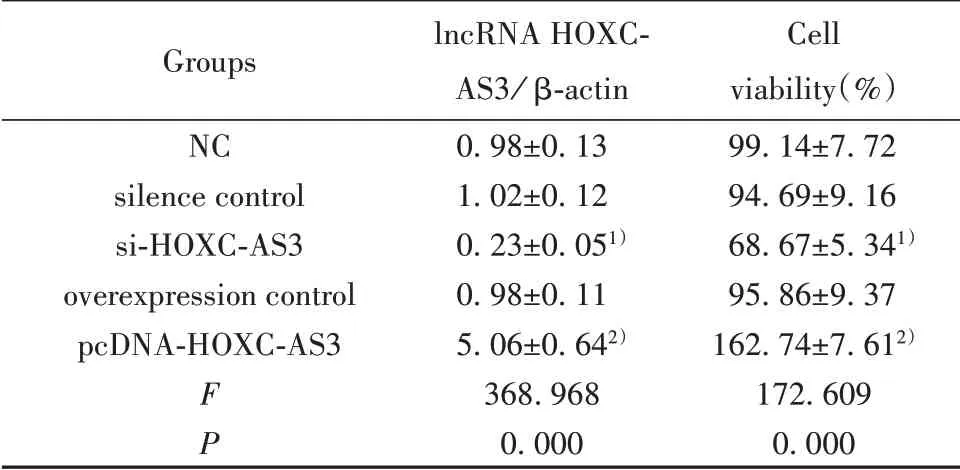
表3 沉默或过表达lncRNA HOXC-AS3对肺癌A549细胞增殖的影响(±s,n=9)Tab.3 Effectsof silenced or overexpressed lncRNAHOXCAS3 on proliferation of lung cancer A549 cells(±s,n=9)
Note:Compared with silence control group,1)P<0.05;compared with overexpression control group,2)P<0.05.
Groups NC silence control si-HOXC-AS3 overexpression control pcDNA-HOXC-AS3 F P lncRNA HOXCAS3/β-actin 0.98±0.13 1.02±0.12 0.23±0.051)0.98±0.11 5.06±0.642)368.968 0.000 Cell viability(%)99.14±7.72 94.69±9.16 68.67±5.341)95.86±9.37 162.74±7.612)172.609 0.000

图2 Western blot检测沉默或过表达lncRNA HOXC-AS3对肺癌A549细胞MMP-2和MMP-9表达的影响Fig.2 Effects of silenced or overexpressed lncRNA HOXC-AS3 on expressions of proliferation pro⁃teins MMP-2 and MMP-9 in lung cancer A549 cells detected by Western blot
表4 沉默或过表达lncRNA HOXC-AS3对肺癌细胞A549迁移和侵袭的影响(±s,n=9)Tab.4 Effects of silenced or overexpressed lncRNA HOXC-AS3 on migration and invasion of lung can⁃cer A549 cells(±s,n=9)
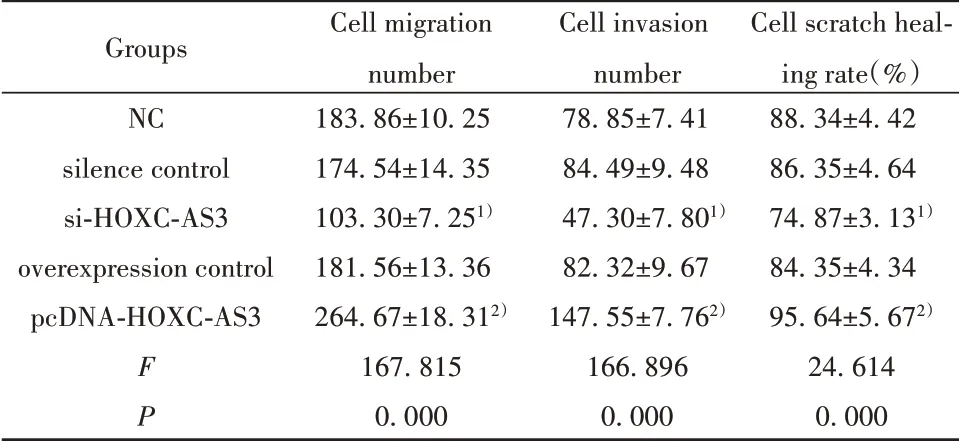
表4 沉默或过表达lncRNA HOXC-AS3对肺癌细胞A549迁移和侵袭的影响(±s,n=9)Tab.4 Effects of silenced or overexpressed lncRNA HOXC-AS3 on migration and invasion of lung can⁃cer A549 cells(±s,n=9)
Note:Compared with silence control group,1)P<0.05;compared with overexpression control group,2)P<0.05.
Groups NC silence control si-HOXC-AS3 overexpression control pcDNA-HOXC-AS3 F P Cell migration number 183.86±10.25 174.54±14.35 103.30±7.251)181.56±13.36 264.67±18.312)167.815 0.000 Cell invasion number 78.85±7.41 84.49±9.48 47.30±7.801)82.32±9.67 147.55±7.762)166.896 0.000 Cell scratch heal⁃ing rate(%)88.34±4.42 86.35±4.64 74.87±3.131)84.35±4.34 95.64±5.672)24.614 0.000

图3 Western blot检测肺癌细胞E-cadherin、N-cadherin和Vimentin蛋白表达Fig.3 Expressions of E-cadherin,N-cadherin and Vimen⁃tin proteins in lung cancer A549 cells detected by Western blot
2.4 沉默或过表达lncRNA HOXC-AS3对肺癌A549细胞EMT的影响 如图3所示,与si-con组相比,si-lncRNA HOXC-AS3组A549细胞N-cadherin和Vimentin蛋白含量降低,E-cadherin蛋白含量升高(P<0.05);过表达lncRNA HOXC-AS3的pcDNAHOXC-AS3组则结果相反。
2.5 lncRNA HOXC-AS3靶向作用于miR-216a-5p 如图4所示,starBase预测结果显示,lncRNA HOXC-AS3序列中存在与miR-216a-5p互补的核苷酸序列。双荧光素酶报告系统结果显示,与miRcon组相比,miR-216a-5p组野生型WT-HOXC-AS3的荧光素酶相对活性显著下降(P<0.05);而突变型MUT-HOXC-AS3的荧光素酶相对活性变化无统计学意义(表5)。qRT-PCR结果显示,沉默HOXC-AS3可上调miR-216a-5p含量,过表达HOXC-AS3可下调miR-216a-5p含量(P<0.05,表6)。
2.6 干扰miR-216a-5p部分逆转沉默HOXC-AS3对肺癌细胞增殖、迁移和侵袭的抑制作用 如图5、表7所示,与si-HOXC-AS3+anti-miR-con组相比,si-HOXC-AS3+anti-miR-216a-5p组miR-216a-5p水平显著下降,A549细胞活性和细胞划痕愈合率升高,迁移和侵袭细胞数增多,Ki-67、Cyclin D1、MMP-2、MMP-9、N-cadherin和Vimentin水平升高,E-cadherin水平降低(P<0.05)。

图4 lncRNA HOXC-AS3与miR-216a-5p的靶向结合位点Fig.4 Binding sites of lncRNA HOXC-AS3 targeting with miR-216a-5p
表5 双荧光素酶报告实验(±s,n=9)Tab.5 Dual luciferase reporter assay(±s,n=9)

表5 双荧光素酶报告实验(±s,n=9)Tab.5 Dual luciferase reporter assay(±s,n=9)
Note:Compared with miR-con group,1)P<0.05.
Groups miR-con miR-216a-5p t P WT-HOXC-AS3 0.99±0.10 0.59±0.071)9.831 0.000 MUT-HOXC-AS3 1.14±0.16 1.22±0.15 1.094 0.290
表6 沉默和过表达HOXC-AS3对miR-216a-5p表达的影响(±s,n=9)Tab.6 Effects of silence and overexpression of lncRNA HOXC-AS3 on expression levels of miR-216a-5p(±s,n=9)

表6 沉默和过表达HOXC-AS3对miR-216a-5p表达的影响(±s,n=9)Tab.6 Effects of silence and overexpression of lncRNA HOXC-AS3 on expression levels of miR-216a-5p(±s,n=9)
Note:Compared with silence control group,1)P<0.05;compared with overexpression control group,2)P<0.05.
Groups silence control si-HOXC-AS3 overexpression control pcDNA-HOXC-AS3 F P miR-216a-5p/U6 0.98±0.13 4.27±0.351)1.03±0.09 0.35±0.052)750.998 0.000
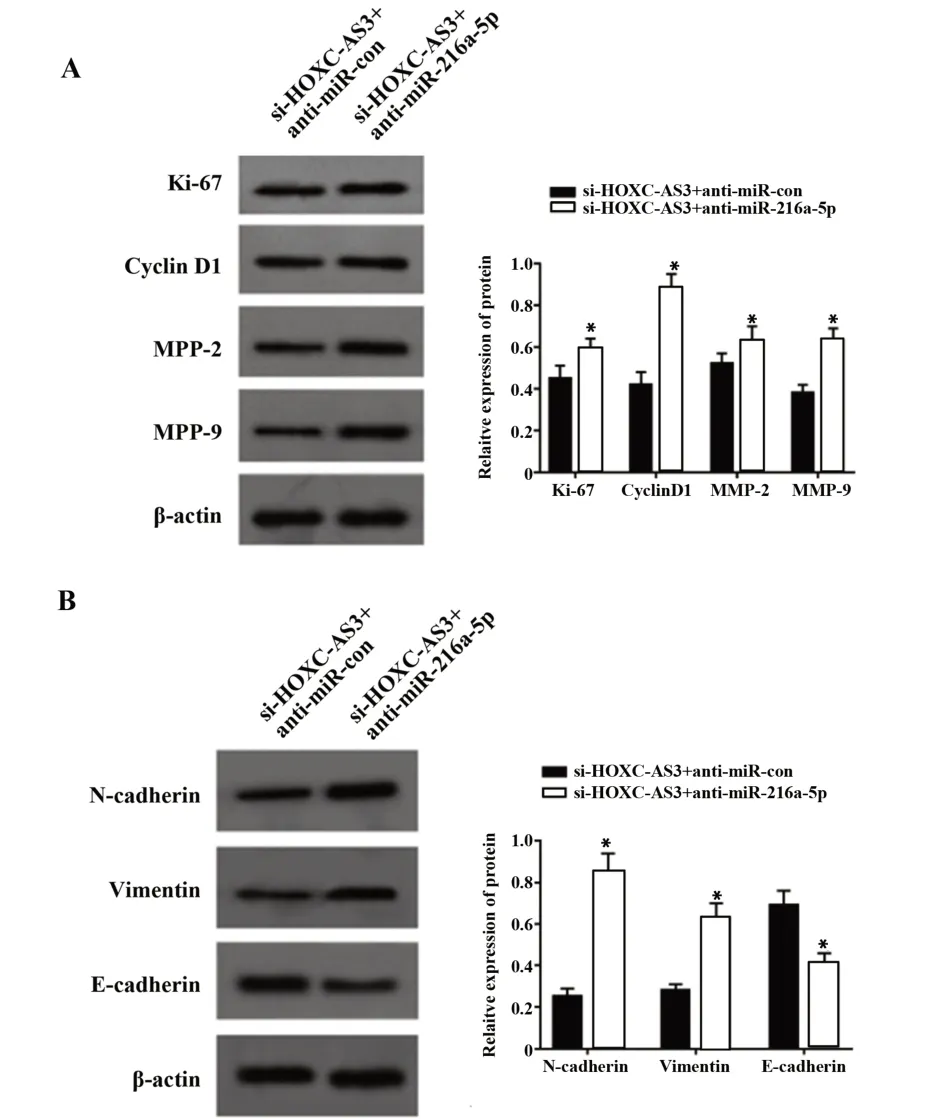
图5 Western blot检测肺癌细胞Ki-67、Cyclin D1、MPP-2、MPP-9、E-cadherin、N-cadherin和Vimentin蛋白表达Fig.5 Expression of Ki-67,Cyclin D1,MPP-2,MPP-9,E-cadherin,N-cadherin and Vimentin proteins in lung cancer A549 cells detected by Western blot
表7 沉默HOXC-AS3和过表达miR-216a-5p对肺癌A549细胞增殖、迁移和侵袭的影响(±s,n=9)Tab.7 Effects of silencing HOXC-AS3 and overexpressing miR-216a-5p on proliferation,migration and invasion of lung cancer A549 cells(±s,n=9)

表7 沉默HOXC-AS3和过表达miR-216a-5p对肺癌A549细胞增殖、迁移和侵袭的影响(±s,n=9)Tab.7 Effects of silencing HOXC-AS3 and overexpressing miR-216a-5p on proliferation,migration and invasion of lung cancer A549 cells(±s,n=9)
Note:Compared with si-HOXC-AS3+anti-miR-con group,1)P<0.05.
Groups si-HOXC-AS3+anti-miR-con si-HOXC-AS3+anti-miR-216a-5p F P miR-216a-5p/U6 1.03±0.14 0.69±0.081)6.326 0.000 Cell viability(%)101.45±8.67 153.28±12.371)10.293 0.000 Cell migration number 128.68±11.26 163.63±13.341)6.006 0.000 Cell invasion number 46.47±5.39 71.66±6.821)8.693 0.000 Cell scratch healingrate(%)73.73±4.96 82.87±5.641)3.651 0.002
3 讨论
研究表明,lncRNA通过调节转录、翻译和翻译后水平基因表达和功能发挥多种生物学功能,广泛参与癌症、代谢紊乱和心血管疾病等疾病发病过程。lncRNA HOXC-AS3是一种最近新发现的ln⁃cRNA,位于染色体12q13.13区域,是HOXC10的反义转录本,HOX基因对形态发生和发育至关重要[10-11]。BHATLEKAR等[12]研究发现,HOXC家族基因表达在多数实体肿瘤中上调,HOXA9和HOXB13最常发生失调,HOXA常在乳腺癌和卵巢癌中异常表达,HOXB在结肠癌中异常表达,HOXC基因在前列腺癌和肺癌中表达失调,HOXD基因在结肠癌和乳腺癌中表达失调。HOX基因lncRNA的产生可能在肿瘤发生中起重要作用。胃癌中ln⁃cRNA HOXC-AS3通过与YBX1结合介导胃癌发生[5]。lncRNA HOXC-AS3可促进胶质母细胞瘤增殖、迁移和侵袭,靶向结合miR-3922-5p促进乳腺癌转移[6-7]。lncRNA HOXC-AS3在肺癌中的表达尚未明确。本研究发现,lncRNA HOXC-AS3在肺癌组织和肺癌H1299、A549和GLC-12细胞中表达上升,而沉默lncRNA HOXC-AS3表达可抑制A549细胞增殖、迁移和侵袭,过表达lncRNA HOXC-AS3则结果相反,提示lncRNA HOXC-AS3在肺癌发展中具有重要作用。
本研究通过starBase预测发现,lncRNA HOXCAS3与miR-216a-5p存在结合位点。miR-216a-5p在食管鳞状细胞癌(ESCC)中表达下调,靶向TCTN1可抑制ESCC细胞增殖并诱导其凋亡[13]。miR-216a-5p在乳腺癌组织和细胞中表达下降,上调其表达可靶向p21激活蛋白激酶2(PAK2)抑制癌细胞增殖、克隆形成、侵袭和迁移[14]。研究表明,miR-216a-5p在SCLC中表达下调,miR-216a-5p通过Bcl-2家族蛋白调控SCLC细胞增殖、迁移和细胞周期[8]。本研究发现,miR-216a-5p在肺癌组织和肺癌H1299、A549和GLC-12细胞中表达下调,与上述研究既往研究结论一致。双荧光素酶报告系统结果表明,lncRNA HOXC-AS3可靶向负调控miR-216a-5p表达,干扰miR-216a-5p可部分逆转沉默lncRNA HOXC-AS3对A549细胞恶性行为的抑制作用,证实肺癌A549细胞中lncRNA HOXC-AS3和miR-216a-5p存在调控关系。
上皮间质转化(epithelial-mesenchymal transi⁃tion,EMT)可促进肿瘤细胞癌变,针对肺癌表皮生长因子受体(EGFR)的靶向治疗即是通过抑制EMT实现对肺癌的抑制作用[15]。本研究发现,沉默ln⁃cRNA HOXC-AS3可抑制A549细胞EMT,而过表达lncRNA HOXC-AS3和干扰miR-216a-5p则逆转这一作用。
综上,本研究发现,肺癌组织和肺癌H1299、A549和GLC-12细胞中lncRNA HOXC-AS3表达上调,miR-216a-5p表达下调,肺癌A549细胞中ln⁃cRNA HOXC-AS3可靶向miR-216a-5p调控细胞增殖、迁移、侵袭和EMT,lncRNA HOXC-AS3可能是NSCLC的分子靶点。
