麦长管蚜miRNA实时荧光定量PCR内参基因的筛选
2021-05-25杨超霞张方梅张云慧李祥瑞
杨超霞, 闫 艺, 张方梅, 朱 勋, 张云慧,*, 李祥瑞,*
(1. 中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193; 2. 信阳农林学院, 河南信阳 464000)
微小RNA(microRNA, miRNA)是真核细胞中的一类长度约18~24 nt的非编码单链小RNA分子,在转录后水平上通过抑制靶基因的翻译或降解靶基因发挥重要的调控作用(Florisetal., 2016; Kraussetal., 2018)。研究表明,miRNA在昆虫中广泛存在,且高度保守,参与昆虫生长发育、变态、生殖以及细胞增殖、细胞凋亡等几乎所有的生物学过程(Rahimpouretal., 2019; Yeetal., 2019; Song and Zhou, 2020)。随着miRNA的深入研究,对特定条件下miRNA表达量的分析已成为阐述miRNA功能的一个重要手段(Wangetal., 2017)。
实时定量PCR(qRT-PCR)是目前研究miRNA基因表达的一种标准技术(Lüetal., 2018; Youetal., 2018; Shuklaetal., 2019; Yanetal., 2019)。但是在实际应用中,RNA质量、cDNA的浓度、转录、聚合酶扩增效率等的变异会产生系统性的误差,导致得出错误甚至相反的结论(Bustin, 2010)。为了减少样品间的误差,通常需要适宜的内参基因对miRNA的定量表达结果进行校正,以便获得可靠的实验结果(Zhangetal., 2015; Wangetal., 2017)。
在qRT-PCR中稳定表达的内参基因在不同物种或同一物种的不同组织、不同发育阶段和不同环境胁迫条件下也可能存在表达水平的变化(Shakeeletal., 2017; Tanetal., 2017; Lüetal., 2018),即同一个内参基因可以适用于多个实验条件,但没有一个内参基因可以适用于所有的实验条件。核内小RNA U6 [snRNA(U6)]和核糖体RNA 5S rRNA常被选作昆虫miRNA表达分析内参基因,这两个基因在昆虫各组织和细胞中广泛表达,且在多种昆虫miRNA的表达水平研究中已有诸多报道,如麦长管蚜Sitobionavenae(Lietal., 2016)、小菜蛾Plutellaxylostella(Shakeeletal., 2018)、斜纹夜蛾Prodenialitura(岑永杰等, 2019)和白背飞虱Sogatellafurcifera(Changetal., 2018)等。但是大量实验结果表明,U6或5S rRNA在用作内参基因时,由于实验条件不同,在一些特定的条件下的表达并不稳定(Wangetal., 2017; Yangetal., 2017; Zhangetal., 2019)。因此,许多特定条件下稳定表达的miRNA被筛选出来作为内参基因,但相关研究多集中在植物、线虫和人类疾病中(Luoetal., 2018; Ragnietal., 2019; Verstraetenetal., 2019)。迄今为止,只有几种关于昆虫miRNA表达分析内参基因筛选的报道,如梨小食心虫Grapholitamolesta(Wangetal., 2017)、棉铃虫Helicoverpaarmigera(Yangetal., 2017)、小菜蛾(封冰等, 2014; Zhangetal., 2019)、大黄蜂Bombuslantschouensis(Dongetal., 2019)等。因此,筛选和评价不同实验材料及不同实验条件下稳定表达的miRNA表达分析内参基因,对获得准确的实验结果尤为重要。
麦长管蚜隶属同翅目(Homoptera)蚜总科(Aphidoidea),是小麦生产上重要的世界性害虫(Daietal., 2014; Huangetal., 2015)。随着研究的不断深入,在基因水平上研究麦长管蚜的寄主选择(Huangetal., 2015)、抗药性(Weietal., 2019)和翅型分化(Lietal., 2016)等重要生物学特征时,首先需要对相关基因的表达进行分析,但目前尚无关于麦长管蚜miRNA表达分析内参基因稳定性表达筛选的报道,因此亟需筛选稳定表达的内参基因或miRNA作为参照。本研究基于Illumina转录组测序鉴定出的麦长管蚜的9个miRNA (miR-10-3p, miR-993, miR-276, miR-275, miR-252a, miR-1, miR-375, pc-15和pc-73)和1个常用内参基因U6作为候选内参基因,以麦长管蚜有翅蚜和无翅蚜不同发育阶段、不同组织以及不同药剂处理无翅蚜的样本为材料,利用qRT-PCR技术对这些候选内参基因进行表达量分析,结合GeNorm, BestKeeper, ΔCt法, NormFinder和RefFinder 5种方法对各候选内参基因表达的稳定性进行了评估,为不同实验条件下选择合适的麦长管蚜miRNA表达分析内参基因提供参考依据,也为其他昆虫筛选miRNA表达分析内参基因提供方法借鉴。
1 材料与方法
1.1 试虫饲养及样本收集
麦长管蚜成虫于2012年4月采自农业部廊坊作物有害生物科学观测实验站的小麦田中(39°30′42″N, 116°36′7″E),带回实验室在养虫笼中连续扩繁多代。从养虫笼内挑出无翅成蚜(实验中的有翅蚜和无翅蚜都来自于最初的无翅蚜母本),单头饲养,连续饲养3代,将第3代成蚜的初产若蚜作为实验用虫(在室内以中麦175饲喂麦长管蚜)。饲养条件:温度20±1℃、相对湿度50%~70%、光周期16L∶8D。
发育阶段样本:根据蜕皮次数分别收集麦长管蚜有翅蚜和无翅蚜1-4龄若蚜和成虫样本,每龄期3个重复,每个重复根据龄期虫体大小收集样本约30 mg。
组织样本:利用微解剖剪分别切下麦长管蚜有翅蚜和无翅蚜的头(45个/重复)、胸(30个/重复)和腹(20个/重复)3种组织部位,每组织3个重复。
药剂处理样本:根据实验室前期实验结果,获得了95.1%吡虫啉原药、97.8%噻虫啉原药、95%阿维菌素原药和40%氧乐果乳油4种药剂对麦长管蚜无翅成蚜的LC50值(Gongetal., 2020),将上述各药剂用吐温水稀释至LC50,采用浸叶法处理麦长管蚜无翅蚜,24 h后收集存活的无翅蚜。每处理重复3次,每重复收集10头试虫。
将以上所有收集的样品均置于液氮浮浴的1.5 mL离心管中速冻,-80℃下保存提取RNA备用。
1.2 供试药剂及试剂
供试药剂:吡虫啉原药(95.1%)、噻虫啉原药(97.8%)、阿维菌素原药(95%),由中国农业科学院植物保护研究所农药实验室提供;氧乐果乳油(40%)由河北新兴化工有限公司生产。
供试试剂:总RNA提取试剂TRIzol Reagent(Ambion, 美国)、RNA反转录试剂盒miScriptII RT Kit(Qiagen, 德国)、miRNA荧光定量试剂盒TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)(TaKaRa, 日本)。
1.3 总RNA提取及cDNA合成
按照TRIzol法提取1.1节中各个样本总RNA,结合ND-2000分光光度计(Thermo Scientific, 美国)和1%琼脂糖凝胶电泳检测总RNA的质量和浓度。按照miRNA反转录试剂盒miScript II RT Kit说明书构建反转录体系,合成cDNA第1链。
1.4 候选内参基因的筛选和引物设计
根据本实验前期麦长管蚜miRNA Illumina测序结果,筛选出在麦长管蚜两翅型不同发育阶段表达量较高且表达稳定的9个miRNA(miR-10-3p, miR-993, miR-276, miR-275, miR-252a, miR-1, miR-375, pc-15和pc-73)和1个常用的内参基因U6作为候选内参基因(表1),并利用Primer Premier 5设计qRT-PCR引物(表1),引物由生工生物工程(上海)股份有限公司合成。
1.5 候选内参基因相对表达量检测
利用qRT-PCR测定10个候选内参基因在1.1节中收集的麦长管蚜有翅蚜不同发育时期、无翅蚜不同发育时期、有翅蚜和无翅蚜不同组织和4种化学药剂处理无翅蚜样本中的相对表达量。参考miRNA荧光定量试剂盒说明书,构建荧光定量反应体系(25 μL): 2×TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)12.5 μL, 正反向引物(10 μmol/L)各1 μL, cDNA模板2 μL, 双蒸水8.5 μL。反应条件: 95℃预变性30 s; 95℃变性5 s, 60℃退火30 s, 70℃延伸34 s,共40个循环。最后在60~95℃之间探测产物的溶解曲线以检测引物的质量。每样本重复测定3次。利用BIO-RAD CFX-connectTMReal-Time System软件(Bio-Rad, 美国)对设置反应条件和结果输出。
1.6 候选内参基因稳定性分析
利用GeNorm(Vandesompeleetal., 2002), ΔCt法(Silveretal., 2006), NormFinder(Andersenetal., 2004)和BestKeeper(Pfaffietal., 2004)对10个候选内参基因在1.1节中收集的麦长管蚜有翅蚜不同发育时期、无翅蚜不同发育时期、有翅蚜和无翅蚜不同组织和4种化学药剂处理无翅蚜样本中的表达稳定性进行评估,具体方式参照其使用说明。最后,通过RefFinder在线网站(https:∥www.heartcure.com.au/reffinder/)对所有候选内参基因进行综合比较与稳定性评估(Xieetal., 2012)。
GeNorm计算不同处理中各内参基因表达稳定性(M值),M值越小代表选择的内参基因稳定性越好。同时,可利用GeNorm计算得到配对变异值V,当Vn/(n+1)<0.15时,则表示该条件下最佳内参基因的数目为n个;NormFinder计算不同样本组内和组间的变化来评估内参基因表达稳定值(SV),该值越小表示内参基因越稳定;ΔCt法是对各内参基因的ΔCt值的标准偏差进行两两比较,对基因表达的稳定性进行排序;BestKeeper是以每个基因之间产生配对的标准差(SD)、变异系数(CV)及相关系数(R)等来评估内参基因的稳定性。
2 结果
2.1 引物扩增效率和特异性评价
qRT-PCR结果显示,各候选内参基因的溶解曲线均为单峰,表明引物具有特异性,且各内参基因的扩增效率均在90%~102%之间,相关系数R2值均高于0.986,表明各候选内参基因引物设计合理,具有良好的扩增效率和特异性,符合荧光定量分析的要求,适用于相应的定量测定(表1)。
2.2 候选内参基因表达水平
基因的表达丰度是内参基因的首要筛选条件。在麦长管蚜两翅型不同发育阶段、不同组织及不同药剂处理的样品中,10个候选内参基因的Ct值均在15~30个循环之间(图1),表明10个内参基因在不同实验条件下均具有较高的表达量,符合内参基因筛选的条件。
基于Ct值的变化,表明各候选内参基因表达量在不同的条件下都有一定的变化。在有翅蚜不同发育阶段和无翅蚜不同发育阶段miR-276和miR-1的表达水平均相对较高,其次是miR-10-3p和U6。Ct值变化大小也是内参基因重要筛选条件,变化越小,表明内参基因越稳定(李晓等, 2018)。pc-15和pc-73表达量变化较大,其他基因变化相对较小(图1: A, B)。在有翅蚜和无翅蚜不同组织中,miR-10-3p, miR-276和miR-1的表达水平相对较高,其次是U6和pc-15,Ct值变异均不大(图1: C)。在不同药剂处理无翅蚜中,miR-10-3p和miR-276的表达水平相对较高,其次是miR-1和U6,Ct值变异均不大(图1: D)。
2.3 候选内参基因在不同发育阶段有翅蚜中的表达稳定性
GeNorm分析结果(表2)表明,miR-993, miR-252a, miR-375和miR-276表达较稳定;NormFinder和ΔCt分析表明,miR-276, miR-993和miR-252a表达较稳定;BestKeeper分析结果表明,U6, miR-276和miR-1表达较稳定。RefFinder综合分析表达稳定性排序为miR-252a, miR-276, miR-993,U6, miR-375, miR-1, miR-10-3p, miR-275, pc-15和pc-73。5种分析方法均表明pc-15和pc-73为最不稳定的内参基因。
GeNorm分析显示在不同发育阶段有翅蚜中,V2/3的配对变异值为0.06,低于0.15(图2),表明需要2个内参基因。综合分析,在不同发育阶段有翅蚜中,2个稳定表达的内参基因优化组合是miR-252a和miR-276。
2.4 候选内参基因在不同发育阶段无翅蚜中的表达稳定性
GeNorm和ΔCt分析结果(表3)表明,miR-993, miR-276和miR-252a为较稳定的内参基因;NormFinder分析结果表明,miR-252a, miR-375和miR-993为较稳定的内参基因;BestKeeper分析结果表明,U6, miR-276和miR-252a为较稳定的内参基因。RefFinder分析结果表明,表达稳定性排序为miR-993, miR-276, miR-252a, miR-10-3p,U6, miR-375, miR-1, miR-275, pc-15和pc-73。5种分析方法均表明pc-15和pc-73为最不稳定的内参基因。
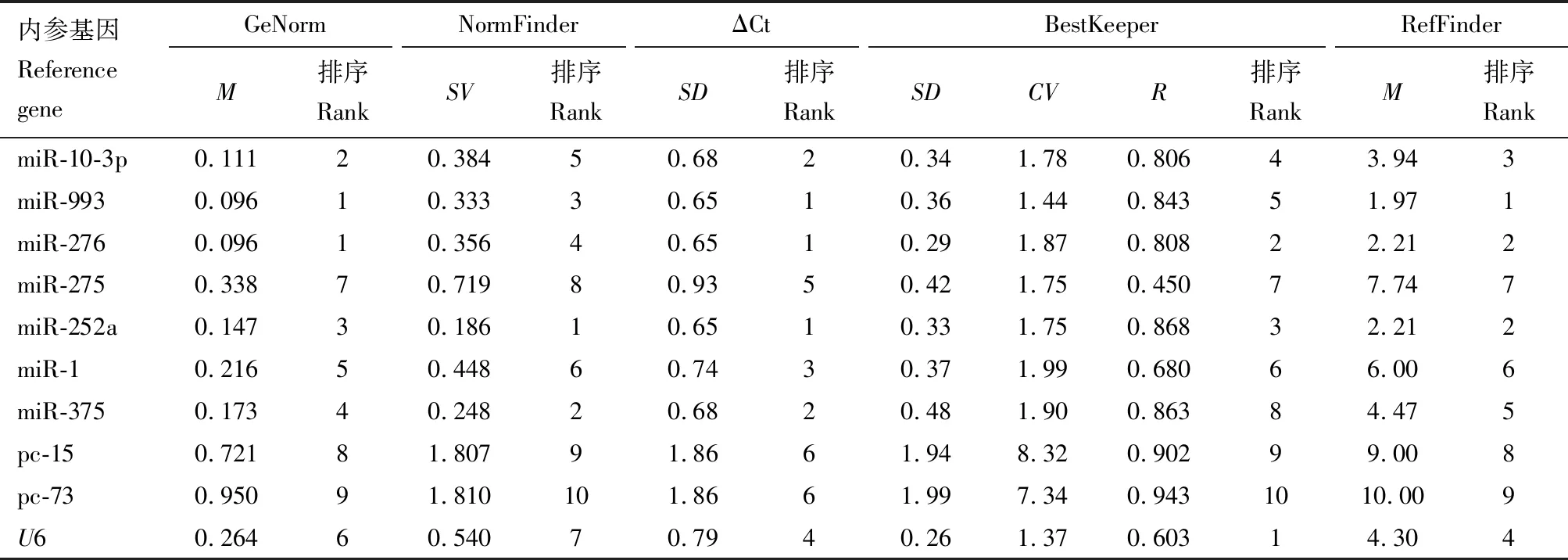
表3 麦长管蚜不同发育阶段无翅蚜中miRNA表达分析内参基因表达稳定性分析Table 3 Analysis of expression stability of candidate reference genes for expression analysisof miRNAs in wingless aphids of Sitobion avenae at different developmental stages
GeNorm分析结果显示在不同发育阶段无翅蚜中,V2/3的配对变异值为0.04,低于0.15(图2),表明需要2个内参基因。综合分析,在不同发育阶段无翅蚜中,2个稳定表达的内参基因优化组合是miR-993和miR-276。
2.5 候选内参基因在有翅蚜和无翅蚜不同组织中的表达稳定性
GeNorm分析结果表明,miR-993和miR-252a为较稳定的内参基因;NormFinder和ΔCt分析结果表明,miR-275和miR-10-3p为较稳定的内参基因;BestKeeper分析结果表明,U6和pc-15为较稳定的内参基因。RefFinder分析结果表明,表达稳定性排序为miR-275, miR-10-3p, miR-252a, miR-375, miR-993, pc-73, miR-276, pc-15, miR-1和U6。除了BestKeeper以外,其他表达稳定性分析均表明U6为最不稳定的内参基因(表4)。
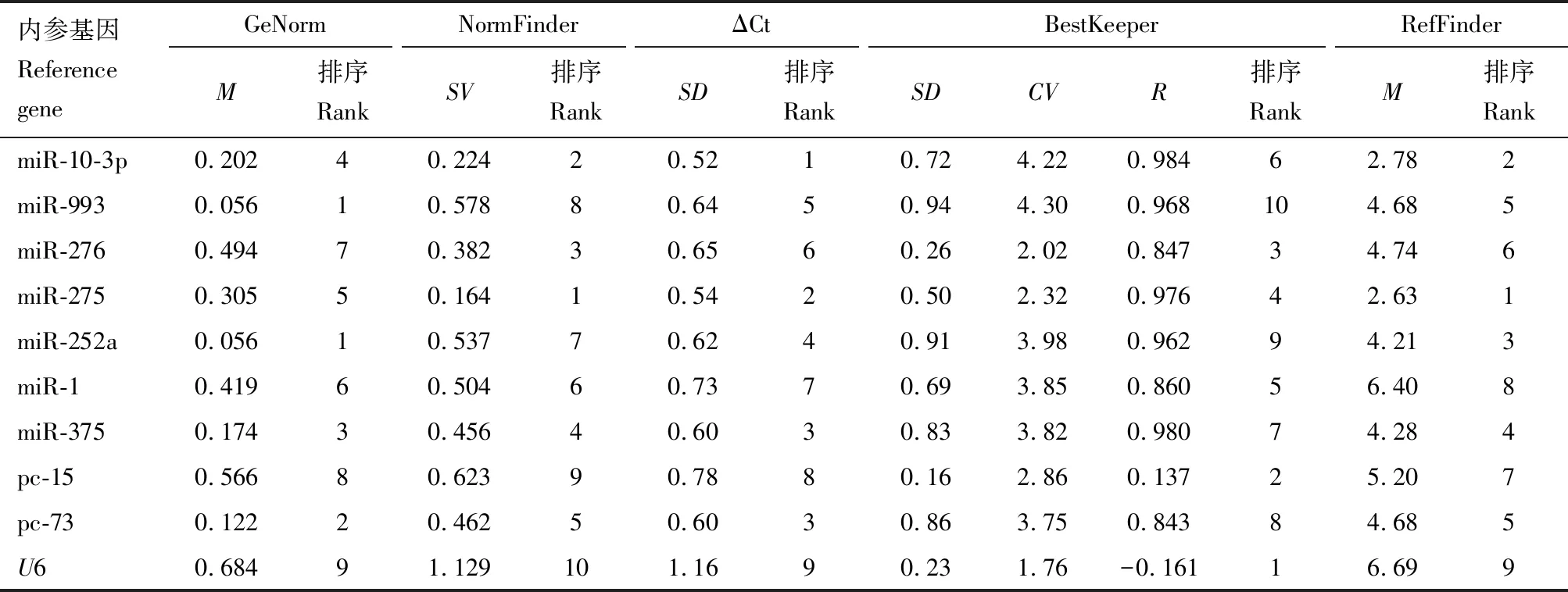
表4 麦长管蚜有翅蚜和无翅蚜不同组织中miRNA表达分析内参基因表达稳定性分析Table 4 Analysis of expression stability of candidate reference genes for expression analysisof miRNAs in different tissues of winged and wingless aphids of Sitobion avenae
GeNorm分析结果表明,V2/3的配对变异值为0.06,低于0.15(图2),表明需要2个内参基因。综合分析,在不同组织中2个稳定表达的内参基因优化组合是miR-275和miR-10-3p。
2.6 候选内参基因在4种药剂处理无翅蚜中的表达稳定性
GeNorm, NormFinder和ΔCt分析结果表明,miR-10-3p和miR-993为较稳定的内参基因,且最不稳定的为pc-15;BestKeeper分析结果表明,miR-1和pc-73为较稳定的内参基因,最不稳定的为U6。RefFinder分析结果表明,表达稳定性排序为miR-993, miR-10-3p, miR-1, miR-275, miR-375, pc-73, miR-276, miR-252a, pc-15和U6(表5)。
GeNorm分析显示,V2/3的配对变异值为0.06,低于0.15(图2),表明需要2个内参基因。综合分析,在不同药剂处理无翅蚜中,2个稳定表达的内参基因优化组合是miR-993和miR-10-3p。

图2 麦长管蚜不同条件下最适miRNA表达分析内参基因数目Fig. 2 Optimal number of reference genes for expression analysis of miRNAs in Sitobion avenaeanalyzed under different conditions
3 讨论
候选内参基因的稳定性评价常采用多个方法依据相关参数进行综合分析,并根据候选内参基因的稳定性高低进行排序。本研究首先使用4个方法(GeNorm, NormFinder, ΔCt和BestKeeper)进行独立排序,在不同的实验条件下最稳定的内参基因是miR-252a, miR-275和miR-993,但这3个基因的稳定性排序并不完全一致,在其他昆虫内参基因筛选中也存在类似情况(Wangetal., 2017; Yangetal., 2017; Dongetal., 2019; Zhangetal., 2019),这可能与4种方法的计算方法及评价指标不同有关(Vandesompeleetal., 2002; Andersenetal., 2004; Pfaffietal., 2004; Silveretal., 2006)。BestKeeper是根据每个基因之间产生配对的相关系数、标准差和变异系数共同判断,从而对候选内参基因稳定性进行排名,而其他方法计算原理类似,是对每一个独立的内参基因进行分析,所以BestKeeper的分析结果与其他方法的研究结果排序差异较大(Pfaffletal., 2004; Tengetal., 2012),与本研究结果也相符。如在麦长管蚜不同药剂处理下,GeNorm, NormFinder, ΔCt和RefFinder分析均显示miR-10-3p和miR-993为最稳定的基因,而BestKeeper分析显示miR-1和pc-73为最稳定的内参基因(表5)。在棉铃虫miRNA表达分析内参基因筛选中也发现BestKeeper与其他方法分析的内参基因的稳定性排序差异较大(Yangetal., 2017)。
一直以来,U6和5S rRNA作为miRNA表达分析传统的内参基因,常被用来评估miRNA目的基因的表达(Lin and Lai, 2013; Hanetal., 2014; Gharbietal., 2015),但已有越来越多的研究证实筛选出的新的miRNA表达分析内参基因比传统的内参基因更稳定(Turneretal., 2013; 封冰等, 2014; Dongetal., 2019; Zhangetal., 2019)。本研究也发现,麦长管蚜不同实验条件下,除BestKeeper以外,其他几种分析方法均显示传统U6的稳定性比较差。以上结果表明,传统的内参基因并不适合作为miRNA定量表达的通用内参基因,不同实验材料在不同条件下选用的内参基因均不相同。我们应根据具体实验材料和处理条件筛选合适的内参基因,才能获得更准确的定量结果。
很多研究证实,使用2个或2个以上的内参基因利用其几何平均值校正目的基因的表达结果,有利于降低实验数据的误差(Shakeeletal., 2017; 杨苓等, 2017; 贾冰等, 2019)。利用GeNorm软件计算配对变异值V,确定最优内参基因数目。 当Vn/n+1值小于0.15时,说明内参基因的最佳数目为n。通过GeNorm分析显示,麦长管蚜在4种不同条件下V2/3的值均小于0.15,说明在4种不同条件下最佳内参基因的数目均为2(图2)。因此,在做麦长管蚜miRNA基因定量表达的研究中,最好使用2个内参基因进行校正。再进一步通过在线程序RefFinder对候选内参基因的表达稳定性进行综合排名,最终确定内参基因的最优选择,从而避免单个软件分析的片面性(Xieetal., 2012)。通过综合分析显示,麦长管蚜在不同条件下使用的内参基因组合不同,如不同发育阶段有翅蚜中最优内参基因组合是miR-252a和miR-276(表2; 图2),不同发育阶段无翅蚜中最优内参基因组合是miR-993和miR-276(表3; 图2),有翅蚜和无翅蚜不同组织中最优内参基因组合是miR-275和miR-10-3p(表4; 图2),不同药剂处理下的最优内参组合是miR-993和miR-10-3p(表5; 图2)。此外,不同昆虫在不同条件下选用的内参基因组合及数目均不尽相同,即使在相同实验条件下需要的内参基因也存在较大差异(Wangetal., 2017; Yangetal., 2017; Dongetal., 2019)。因此,在做miRNA定量表达分析中,需要在不同昆虫特定条件下筛选特有的内参基因,才能保证实验结果的准确性。
总之,绝对稳定的miRNA表达分析内参基因并不存在。miRNA的表达稳定性随物种而异,同时也会受实验处理方法和条件的影响。本研究筛选出了适合麦长管蚜不同发育阶段、不同组织和不同药剂处理下稳定表达的miRNA表达分析内参基因及最优组合,为后期应用qRT-PCR技术开展其miRNA基因的表达及功能分析中内参基因的选择提供了依据,也可为其他昆虫内参基因筛选提供一定参考。
