无脑回-巨脑回畸形患儿的临床特征及分子遗传学研究
2021-05-24周昀箐王翠锦王英燕禹永春王纪文
周昀箐 王翠锦 王英燕 陈 丽 禹永春 王纪文
1.上海交通大学医学院附属上海儿童医学中心(上海 200127);2.复旦大学脑科学研究院(上海 200032)
无脑回-巨脑回畸形是一种罕见的脑畸形,由胚胎发育过程中的神经元迁移缺陷引起。患儿通常表现为严重的精神运动发育迟缓和难治性癫痫。目前已发现病因与孕期感染、放射性接触及多种基因变异等相关。无脑回-巨脑回畸形的病因学及合并难治性癫痫的治疗选择是临床待解决的问题,既往国内报道较少。本研究分析无脑回-巨脑回畸形患儿的临床表现及遗传学特征,总结治疗及效果,探索基因型-表型关联及遗传学病因。
1 临床资料
2014 年1 月至2020 年3 月在上海交通大学医学院附属上海市儿童医学中心就诊,经头颅磁共振成像(MRI)确诊的无脑回-巨脑回畸形患儿共60例,男30 例、女30 例,起病年龄2 天至14 岁,中位年龄4 个月。56 例(93.3%)1 岁内起病;合并惊厥发作50 例(83.3%),其中婴儿痉挛症30例、大田原综合征1例、非综合征类癫痫性脑病16 例、局灶性癫痫1 例、热性惊厥2例,无惊厥发作、仅以运动或语言发育落后就诊10例(16.7%)。癫痫发作类型为单一发作形式34例,其中单一痉挛发作18 例、单一强直阵挛发作7 例、单一局灶性发作9例;合并2种以上发作形式16例,6例痉挛发作合并局灶性发作、3 例痉挛发作合并强直发作及局灶性发作、2例局灶性发作合并强直阵挛发作、2例痉挛发作合并局灶性发作及肌阵挛发作、1例强直发作合并局灶性发作、1例痉挛发作合并肌阵挛发作、1例痉挛发作合并强直发作及强直-痉挛发作。最常见的发作类型是痉挛发作,共 31例(62.0%)。
患儿影像学检查显示单纯巨脑回45例(75.0%),单纯无脑回4 例(6.7%),巨脑回合并无脑回11 例(18.3%);45例单纯巨脑回畸形中,广泛性巨脑回24例、局灶性巨脑回21例(半球8例、额部2例、额顶部1例、额颞部3例、额颞顶部5例、颞部1例、颞顶枕部1例)。见图1。
50 例合并惊厥发作的无脑回-巨脑回患儿,2 例热性惊厥未用抗癫痫药物;余48 例均使用了抗癫痫药物治疗,其中11 例使用1种抗癫痫药物,12 例使用2种抗癫痫药物,25例使用3种及以上抗癫痫药物。托吡酯是使用最多的药物,共30例患儿使用,无发作及发作减少50%以上的6 例。31 例发作类型为痉挛发作的患儿,其中10例曾使用促皮质素(Corticotropin,ACTH)治疗,2例治疗后无发作,2例发作减少;12例使用氨己烯酸治疗,其中1 例无发作,4 例发作减少。丙戊酸和左乙拉西坦也是使用较多的药物,均为23例,各有2例治疗后无发作。5例使用奥卡西平治疗的患者中2 例无发作。10 例使用氯硝西泮的患者中仅1例无发作。1例患儿使用了拉莫三嗪治疗后无发作。苯巴比妥和硝西泮治疗效果较差,使用后患儿发作均无明显改善。
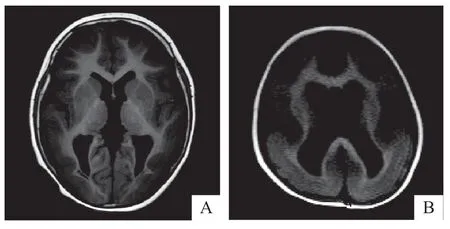
图1 患儿头颅MRI
除药物治疗外,5 例患儿行癫痫手术治疗,术前均存在药物难治性癫痫。2 例患儿头颅MRI示右额局灶性巨脑回,表现为局灶性发作;其中1 例生后45 天起病,丙戊酸、左乙拉西坦治疗无效,2岁时行右额切除术后随访1年无发作;另1例2岁起病,多种抗癫痫药物治疗无效,4岁行右额切除术后随访4年无发作。1例左侧半球巨脑回患儿生后10天起癫痫发作,表现为强直发作及局灶性发作,予多种抗癫痫药物治疗无效,8 月龄行半球切除术后随访5 月无发作。1 例患儿头颅MRI示右侧半球巨脑回,生后40天起痉挛发作,丙戊酸、奥卡西平治疗无效,13 月龄行迷走神经刺激术后随访22 个月无发作。1 例广泛性巨脑回患儿4 月龄起痉挛发作,使用ACTH 等多种药物治疗无效,1岁行迷走神经刺激术、1 岁半行胼胝体切开术后发作 好转。
50例合并惊厥发作的患儿随访时间1.5个月至5年,1例广泛性巨脑回患儿4.5月龄起痉挛发作,丙戊酸、托吡酯治疗无效,6 月龄时因重症肺炎死亡,2 例热性惊厥及16例癫痫患儿(18/50,36.0%)发作控制,31 例(31/50,62.0%)发作未得到有效控制。60 例患儿中仅1例14岁起病的患儿智力运动发育无异常,表现为局灶性癫痫,头颅MRI示右侧额颞顶巨脑回,奥卡西平治疗有效,随访3年无发作,成绩中等,无运动障碍;其余59 例患儿存在不同程度的认知、运动、语言发育落后或倒退。
经监护人签署知情同意,医院伦理委员会批准,对45 例患儿及其父母进行全基因组测序。采集患儿及其父母外周血2 mL,置于含乙二胺四乙酸(EDTA)抗凝试管,充分混匀;取200 μL全血,使用QIAampDNA Blood Mini Kit 试剂盒(Qiagen,德国)提取基因组DNA,用NanoDrop 2000 分光光度计对所提DNA定量。采用高通量测序进行致病基因鉴定。取3 μg患儿的基因组DNA经M220型核酸打断仪(美国Covaris公司)处理后得到150~200 bp 的DNA 片段,采用SureSelect 试剂盒(美国Agilent 公司)制备测序文库。使用HiSeq 2500 System(Illumina,美国)行高通量测序。将得到的DNA 序列变异包括单核苷酸变异(single nucleotide variation,SNP)和插入缺失(insertion deletion,InDel)位点与人类参考基因组比对。应用Ingenuity 软件对变异进行筛选。结果发现1 例TUBA1A基因存在c.1204C>T变异,4例PAFAH1B1基因存在变异,分别为c.569-10 T>C、c.337 C>T、c.1002+1G>A、c.265C>T。所有变异均为新发变异,患儿父母未见变异;变异位点均引起蛋白质功能的改变,美国医学遗传学与基因组学学会(The American College of Medical Genetics and Genomics,ACMG)分类均为致病性突变。
TUBA 1 A基因c.1204 C>T 错义变异位点所在的密码子是TUBA 1 A基因变异的热点区域。存在c.1204C>T错义变异的患儿,2月龄时以惊厥发作起病,存在多种发作形式(痉挛发作、强直发作、强直-痉挛发作),伴精神运动发育迟缓;头颅MRI 提示巨脑回-无脑回畸形及胼胝体发育不良;曾使用丙戊酸、托吡酯、氨己烯酸、维生素B6治疗,仍有反复惊厥发作。
存在PAFAH 1 B 1基因变异的4 例患儿,1 例位于第5 号外显子的c.265 C>T 错义变异的患儿,因发育落后就诊,13 月龄时无法独坐、翻身,头颅MRI 示广泛性巨脑回,康复治疗中;1例位于第6号内含子与第7号外显子的交界区域的c.569-10T>C剪接位点变异的患儿5月龄时发现痉挛发作、局灶性发作,伴发育落后,头颅MRI 示两侧广泛性巨脑回,后头部显著,使用托吡酯、丙戊酸、氨己烯酸、硝西泮抗癫痫治疗,现发作稀少;1例位于第5号外显子的c.337C>T无义变异的患儿表现为痉挛发作,伴发育落后,头颅MRI示广泛性无脑回-巨脑回畸形,使用丙戊酸、托吡酯抗癫痫治疗后仍每日有痉挛发作;1 例位于第9 号外显子与内含子的交界区域的c.1002+1G>A剪接位点变异的患儿8月龄时发现运动落后,4岁出现痉挛发作,头颅MRI 示两侧广泛性巨脑回畸形、后头部显著,伴智力、运动发育落后,丙戊酸、托吡酯治疗后仍有发作。
2 讨论
脑回畸形包括无脑回、巨脑回和皮质下带状异位等,是由于在妊娠12 周至24 周的胚胎发育过程中神经细胞迁移的缺陷导致的,病因与孕期感染、中毒及基因变异等有关。无脑回-巨脑回畸形的发病率尚不确定,估计在每百万新生儿11.7至40例之间[1]。无脑回-巨脑回畸形患儿常表现出明显的发育迟缓及难治性癫痫。
无脑回-巨脑回畸形患儿常合并难治性癫痫。本组病例中约94.0%患儿的癫痫是在出生后第一年内发生的,60.7%的癫痫为药物难治性癫痫,这与既往发表的研究数据相似[2]。然而,关于无脑回-巨脑回畸形患者抗癫痫药物疗效的数据很少[3]。有报道22例与PAFAH1B1/LIS1基因相关的无脑回-巨脑回畸形及癫痫发作患儿,首次发作主要表现为痉挛发作,后期部分可转变为Lennox-Gastaut综合征,强直阵挛发作多见,拉莫三嗪联合丙戊酸治疗的应答率超过85.0%,这种抗癫痫治疗方法可能会减少癫痫发作的次数,从而提高这些患者的整体生活质量[4]。本组患儿中仅 1 例存在多种发作类型的患儿联合使用了拉莫三嗪,加用拉莫三嗪后癫痫发作得到了有效控制,提示拉莫三嗪可以作为无脑回-巨脑回畸形合并难治性癫痫的药物选择,但因样本过少,需要更多的研究证实。痉挛发作是本组患儿最常见的癫痫发作形式,与其他先前发表的无脑回-巨脑回畸形患者队列数据一致[2]。按婴儿痉挛的标准一线治疗方案,即ACTH 和氨己烯酸,在本组无脑回-巨脑回畸形患儿中也有一定疗效,这与其他研究结果一致[4-5]。此外,托吡酯是本组患儿中使用最多的药物,无发作率和部分有效率均到达10%,高于丙戊酸、左乙拉西坦等其他常用的抗癫痫药物,提示托吡酯也可作为此类难治性癫痫的药物 选择。
除药物治疗外,本组患儿中5 例还接受了根治性或姑息性癫痫手术治疗,其中4例达到无发作,1例发作好转。癫痫外科近年来发展迅速,但尚没有广泛开展,有研究建议药物难治性癫痫患者都应在综合性癫痫中心进行咨询,使更多合适的患者能从癫痫手术中受益[6]。最近一项系统性综述和荟萃分析的结果表明,癫痫手术应该是符合手术条件的局灶性药物难治性癫痫儿童的首选治疗方法[7]。本组患儿也表明了癫痫手术对无脑回-巨脑回患者的益处,药物难治性癫痫患儿有条件均可接受癫痫术前评估,存在局灶性病灶可考虑根治性病灶切除术,广泛性病灶可选择姑息性手术如胼胝体切开术或者迷走神经刺激等。虽然癫痫手术在脑回畸形中的应用仍需要更大样本量的研究,但可作为药物难治性癫痫的治疗选择。
本组患儿中10 例仅有发育迟缓表型,提示对于发育迟缓的患儿,头颅MRI 是寻找病因不可或缺的方法。本组患儿中未发现肌张力不全、震颤等运动障碍的表型,可能存在家属未识别或发生率较低的 情况。
目前为止已经发现19 个无脑回-巨脑回相关基因,其中许多与微管结构蛋白或微管相关蛋白相关,这些基因包括PAFAH 1 B 1/LIS 1、DCX、ACTB、ACTG1、ARX、CDK5、CRADD、DYNC1H1、KIF2A、KIF 5 C、NDE 1/NDEL 1、TUBA 1 A、TUBA 8、TUBB、TUBB2B、TUBB3、TUBG1、RELN和VLDLR[8]。其中,PAFAH 1 B 1/LIS1和DCX是最常见的无脑回-巨脑回相关基因变异。
PAFAH1B1基因也被称为LIS1基因,位于染色体17 p 13.3,参与细胞质动力蛋白介导的核分裂、胞体移位和细胞运动。PAFAH1B1基因变异相关的临床表型有无脑回-巨脑回畸形、皮质下带状异位及Miller-Dieker综合征,呈常染色体显性遗传[8-9]。PAFAH1B1基因变异相关的无脑回-巨脑回畸形大多伴难治性癫痫,癫痫发作常在1岁内起病,多表现为婴儿痉挛症,部分后期转变为Lennox-Gastaut综合征或不典型的癫痫综合征,所有的PAFAH1B1/LIS1相关无脑回-巨脑回畸形患者都有严重的精神运动发育迟缓[4]。本组患儿中4例PAFAH1B1基因变异,临床表型为广泛或后头部显著的无脑回-巨脑回畸形、精神运动发育迟缓、难治性癫痫,其中2 例表现为婴儿痉挛症,与既往的报道基本一致[4]。基因型-表型研究发现PAFAH1B1/LIS1基因变异常表现为后头部更显著的无脑回-巨脑回畸形[8]。本组4例PAFAH1B1基因变异患儿的头颅MRI也表现这个特征。本组4例PAFAH1B1基因变异患儿的变异类型包括,2例剪接位点变异、1例无义变异及1例错义变异,均为新发变异,已有文献报道[10]。c.569-10 T>C 变异位于第6 号内含子与第7 号外显子的交界区域,目前已在多个无脑回畸形或皮质下带状异位患者中被检出[11];体内功能实验证明该变异会影响mRNA 的正常剪切,导致7 号外显子跳跃,定量分析显示该变异产生的mRNA 丰度只有野生型的一半[12]。c.1002+1 G>A 变异位于第9 号外显子与内含子的交界区域,即剪接供体点,可能导致基因转录mRNA发生剪接异常。c.337C>T变异为无义变异,可能导致该基因蛋白编码的提前终止,其下游仍有多个无义变异致病的报道[10],提示上述变异导致蛋白缺失部分对功能有重要影响。c.265C>T错义突变位于第5号外显子,可能引起编码蛋白的功能改变,但尚无相关功能学研究。
TUBA1A是主要的微管蛋白病变基因[13]。TUBA1A相关的微管病变是常染色体显性遗传病,主要由TUBA 1 A的新发变异引起,占所有无脑回-巨脑回畸形病例的5%[11]。TUBA 1 A相关的微管病变临床表现多样,主要神经影像学特征包括皮质旋转异常、无脑回-巨脑回畸形和多小脑回,基底节、胼胝体、内囊和小脑也有异常,临床特征包括全面性发育迟缓、小头畸形、癫痫等。本组患儿中发现1 例TUBA 1 A基因c.1204C>T错义变异,引起R402C氨基酸改变,该位点是变异热点,已有多项研究报道,并进行基因型-表型分析及功能研究[14-16]。研究发现,TUBA1A基因错义突变最常受影响的氨基酸位于R402附近的C-末端区域,这些变异可导致R 402 的精氨酸替换为半胱氨酸(R402C)、组氨酸(R402H)、亮氨酸(R402L)或丝氨酸(R 402 S),R 402 残基位于各种微管相关蛋白或马达蛋白的相互作用位点,预测其会影响微管相关蛋白或马达蛋白的结合[15]。R 402 位点变异占所有报告的TUBA1A变异的30.0%,体内、体外功能实验均证明,该变异使微管蛋白异二聚体的产量降低,稳定性下 降[16]。进一步研究证明,影响α-微管蛋白402位(R402)精氨酸的错义变异,可选择性损害动力蛋白的运动活性,并严重破坏皮质神经元的迁移[17]。基因型-表型分析显示,特定的基因型与某些临床特征高度相关,其中R402C错义变异患者大多表现为无脑回-巨脑回畸形、胼胝体发育不良、小脑发育不良[13,18]。本组患儿中的TUBA1A基因R402C变异患儿的头颅MRI表现为无脑回-巨脑回及胼胝体发育不良,与既往报道相同,进一步证实TUBA 1 A基因R 402 C 变异具有高度相似的临床表型。
综上,无脑回-巨脑回畸形通常会导致严重的精神运动发育障碍和难治性癫痫,通常在出生一年内起病。痉挛发作患者可能从ACTH 或氨己烯酸中获益,托吡酯对部分患者有效,癫痫手术也能改善发作及精神运动发育。对TUBA1A基因及PAFAH1B1/LIS1基因变异所致的巨脑回-无脑回患者的基因型-表型分析同既往的研究结果一致。但本组患儿的基因检测阳性率低,提示病因可能为妊娠期环境因素或存在仍需探索的新致病基因。
