miR-33b靶向HMGA2 基因表达抑制食管癌细胞迁移的实验研究
2021-05-19薛萌刁云辉樊宏伟
薛萌,刁云辉,樊宏伟
(南阳市中心医院消化内科一病区,河南 南阳 473009)
食管癌是常见的消化道恶性肿瘤之一,病灶内癌细胞的迁移能力极强,容易在早期出现肿瘤病灶的浸润,单纯手术切除后的生存率较低[1,2]。食管癌的发生涉及多基因、多环节、多因素且未完全阐明。小 RNA (microRNA,miR) 是一类长度 18-22nt 并在转录后水平调控基因表达的一类非编码RNA,与靶基因 mRNA 的 3’非编码区(3’-untranslated region,3’UTR)结合后阻碍 mRNA 的翻译,最终实现对靶基因表达的抑制。在恶性肿瘤组织中,多种miRs 的表达存在异常,靶向原癌基因的miRs下调或靶向抑癌基因的miRs 上调均起到促癌作用[3-5]。miR-33b 是一类具有抑癌作用的miR,已经在胃癌、 黑色素瘤等恶性肿瘤细胞中被证实能够靶向高迁移率族蛋白A2 (high mobility group A2,HMGA2)基因并抑制细胞迁移[6,7]。但miR-33b 在食管癌发生发展中的具体作用机制及HMGA2 是否受到miR-33b 的靶向调控尚不完全清楚。为此,本研究具体分析了miR-33b 靶向HMGA2 基因表达抑制食管癌细胞迁移的作用。
1 材料与方法
1.1 实验材料 食管癌Eca9706 细胞系购自中科院上海生命科学院细胞资源中心,DMEM 培养基、胎牛血清(FBS)购自 Gibco 公司,阴性对照(NC)模拟物(序列:5’-GUUAUCAGUGACUAGCGUA-3’)、miR-33b 模拟物(序列:5’-GCUAGCAUGCUGAUGUCA-3’)、NC-siRNA(序列:5’-UGCAUGUACGC UAGCUAU-3’)、HMGA2-siRNA (序列:5’-UAGC UAGGCUAGCUAGUG-3’)、pcDNA3.0 空白质粒、pcDNA3.0-HMGA2 质粒均购自上海吉玛公司,双荧光素酶报告基因(Psi-check2 质粒)及检测系统均购自Promega 公司,Lipofectamine2000 试剂购自Invitrogen 公司,Transwell 小室购自 Corning 公司,DIO 细胞膜绿色荧光染液购自上海碧云天公司,miRNA 提取试剂盒、miRNA cDNA 第一链合成试剂盒、miRNA 荧光定量PCR 检测试剂盒、 培养细胞/细菌总RNA 提取试剂盒、石蜡包埋组织切片总RNA 提取试剂盒、FastKing 一步法除基因组cDNA第一链合成预混试剂购自北京天能公司,HMGA2单克隆抗体购自Abcam 公司。显微镜购自Nikon公司,荧光定量 PCR 仪购自 ABI 公司,GloMax 2020 单管型发光检测仪为北京原平皓生物技术有限公司
1.2 细胞培养和分组 Eca9706 细胞用含有10%FBS 的DMEM 贴壁培养,隔天进行胰蛋白酶消化并按1:3 传代。得到足够数量的细胞后接种在培养板内并进行分组、处理。NC 模拟物组转染NC 模拟物,miR-33b 模拟物组转染miR-33b 模拟物,NC-siRNA 组转染 NC-siRNA,HMGA2-siRNA 组转染HMGA2-siRNA,pcDNA3.0 组转染 pcDNA3.0 空白质粒,pcDNA3.0+miR-33 模拟物组转染pcDNA3.0空白质粒及miR-33b 模拟物,pcDNA3.0-HMGA2+miR-33b 模拟物组转染 pcDNA3.0-HMGA2 质粒及miR-33b 模拟物。转染时,采用 Lipofectamine 2000 试剂进行转染、 按照试剂说明书进行转染的操作,模拟物、siRNA 的终浓度均为50nmol/L,质粒的终浓度为 1.2μg/ml。
1.3 细胞迁移的Transwell 检测 Eca9706 细胞用无血清DMEM 重悬后接种在无基质胶的transwell上层小室内,下层小室内加入600μl 含有10%FBS的DMEM,不同条件处理24h 后用磷酸盐缓冲液漂洗小室3 遍,用棉签擦去上层未侵袭的细胞后用4%多聚甲醛固定过夜,第二天用DIO 细胞膜绿色荧光染液对细胞膜进行染色并在显微镜下观察,激发波长484nm、发射波从501nm,在5 个随机高倍视野下对绿色荧光细胞的数目进行计数、平均值即为侵袭细胞数目。
1.4 细胞迁移的划痕检测 Eca9706 细胞接种在6孔板中,用200μl 的移液头在培养孔底部中央做一纵行划痕并在显微镜下拍照记录, 划痕面积记为A0;不同条件处理24h 后,再次在显微镜下拍照记录,划痕面积记为 A24。按照公式(A0-A24)/A0 计算相对愈合面积。
1.5 荧光定量PCR Eca9706 细胞接种在12 孔板内,不同条件处理24h 后用miRNA 提取试剂盒分离细胞中的miRNA 后用miRNA cDNA 第一链合成试剂盒将miRNA 反转录为cDNA,用miRNA 荧光定量PCR 检测试剂盒配置20μl 的PCR 反应体系,miR-33b 的 上游引 物 为 5’-CGAUCGU ACGACUACAGU-3’、 下游引物为试剂盒内的通用引物, 按照程序 95℃ 15s、60℃ 1min 反应 40 个循环,根据循环曲线计算miR-33b 的表达量; 另取E-ca9706 细胞,不同条件处理24h 后用培养细胞/细菌总RNA 提取试剂盒分离RNA、用FastKing 一步法除基因组cDNA 第一链合成预混试剂盒将RNA反转录为cDNA,用Talent 荧光定量检测试剂盒配置 20μl 的 PCR 反应体系,HMGA2 的上游引物为5’-TAAGCTAGTAGCTAGCTA-3’、下游引物为 5’-ATTCGATGCTAGCTACGA-3’,按照程序 95 ℃15s、60℃ 1min 反应40 个循环,根据循环曲线计算HMGA2 的 mRNA 表达量。
1.6 Western blot Eca9706 细胞接种在12 孔板内,不同条件处理24 小时后用蛋白裂解液提取总蛋白,用BCA 试剂盒测定蛋白浓度后取30μg 蛋白与上样缓冲液混合,加入预先配置好的聚丙烯酰胺分离胶和浓缩胶,80V 电压电泳至分离胶和浓缩胶交界处,调整至110V 电压、电泳至指示条带接近分离胶下缘,停止电泳后300mA 转膜80min,将NC膜放入5%脱脂牛奶封闭2h,加入HMGA2 第一抗体、4℃孵育过夜。第二天,TBST 洗膜3 遍后加入第二抗体、 室温孵育2h,TBST 洗膜3 遍后加入显影液、在化学显影仪中曝光得到蛋白条带,分析灰度值并根据HMGA2 灰度值与β-actin 灰度值的比值计算表达量。
1.7 双荧光素酶报告基因检测 构建包含HMGA2 mRNA 3’UTR 序列的双荧光素酶报告基因,将双荧光素酶报告基因与NC 模拟物或miR-33b 模拟物共同转染进入Eca9706 细胞,48 小时后用胰蛋白酶消化收集细胞,采用双荧光素酶报告基因检测试剂盒在GloMax 2020 单管型发光检测仪上测定萤火虫荧光值和海肾荧光值, 以萤火虫荧光值/海肾荧光值计算荧光素酶报告基因的荧光活性。
1.8 统计学分析 采用SPSS23.0 软件录入数据,两组间计量资料的比较采用t 检验、三组间计量资料的比较采用方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 miR-33b 模拟物对Eca9706 细胞迁移的影响与NC 模拟物组比较,miR-33b 模拟物组细胞中miR-33b 的表达量明显增多 (P<0.05), 见图1A;transwell 实验显示,与NC 模拟物组比较,miR-33b模拟物组细胞的迁移数目明显减少(P<0.05),见图1B;划痕实验显示,与NC 模拟物组比较,miR-33b模拟物组细胞的相对愈合面积明显减少 (P<0.05),见图1C。

图1 miR-33b模拟物对Eca9706 细胞迁移的影响
2.2 miR-33b 模拟物对 Eca9706 细胞中 HMGA2的靶向调控作用 经TargetScan 网站进行生物信息学预测,miR-33b 能够靶向结合HMGA2 mRNA的 3’UTR,见图2A;经 western blot 检测,与 NC 模拟物组比较,miR-33b 模拟物组细胞中HMGA2 的蛋白表达量明显减少(P<0.05),见图2B;经双荧光素酶报告基因检测,与NC 模拟物组比较,miR-33b模拟物组细胞的荧光活力明显降低(P<0.05),见图2C。
2.3 沉默HMGA2 对Eca9706 细胞迁移的影响 与NC-siRNA 组比较,HMGA2-siRNA 组细胞中 HMGA2 的表达明显减少(P<0.05),见图3A-B;transwell实验显示,与 NC-siRNA 组比较,HMGA2-siRNA 组细胞的迁移数目明显减少(P<0.05),见图3C;划痕实验显示,与 NC-siRNA 组比较,HMGA2-siRNA 组细胞的相对愈合面积明显减少(P<0.05),见图3D。
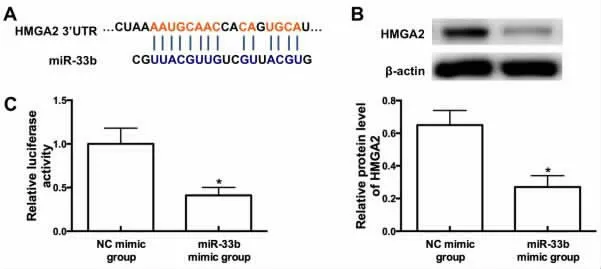
图2 miR-33b模拟物对Eca9706 细胞中HMGA2 的靶向调控作用

图3 沉默HMGA2 对Eca9706 细胞迁移的影响
2.4 过表达 HMGA2 对 miR-33b 调控 Eca9706 细胞迁移的影响 与pcDNA3.0 组比较、pcDNA3.0+miR-33 模拟物组Eca9706 细胞中HMGA2 的表达量明显减少(P<0.05),与 pcDNA3.0+miR-33 模拟物组比较、pcDNA3.0-HMGA2+miR-33 模拟物组细胞中 HMGA2 的表达量明显增加(P<0.05),见图4A。
划痕实验显示,与 pcDNA3.0 组比较、pcDNA3.0+miR-33b 模拟物组Eca9706 细胞的相对愈合面积明显减少(P<0.05),与 pcDNA3.0+miR-33b模拟物组比较、pcDNA3.0-HMGA2+miR-33b 模拟物组细胞的相对愈合面积明显增加(P<0.05),见图4B。
Transwell 实验显示,与 pcDNA3.0 组比较、pcDNA3.0+miR-33b 模拟物组Eca9706 细胞的迁移数目明显减少(P<0.05),与 pcDNA3.0+miR-33b模拟物组比较、pcDNA3.0-HMGA2+miR-33b 模拟物组细胞的迁移数目明显增加(P<0.05),见图4C。

图4 过表达HMGA2 对miR-33b调控Eca9706 细胞迁移的影响
3 讨论
食管癌的发病机制至今仍未明确,临床上也缺乏治疗食管癌的靶向药物。近年来,miR 被证实在多种恶性肿瘤的发生发展中起到重要作用,其中miR-33b 是一种具有抑癌特性的miR,已经被证实在食管癌、肺癌、多发性骨髓瘤等恶性肿瘤组织中呈低表达趋势[8-10]。相关的细胞实验发现,miR-33b对多种恶性肿瘤细胞的增殖、迁移、侵袭均具有抑制作用且其抑制迁移的作用与靶向抑制HMGA2的表达有关。本实验以食管癌Eca9706 细胞为实验对象,通过转染miR-33b 的方式来增加细胞中miR-33b 的表达,在转染miR-33b 模拟物后观察到细胞中miR-33b 的表达明显增多且细胞在Transwell 及划痕实验中的迁移明显受到抑制,说明miR-33b 对食管癌细胞的迁移具有抑制作用。
在胃癌和黑色素瘤中,miR-33b 被证实能够靶向抑制HMGA2 基因的表达,该基因的编码产物是一种非组蛋白的染色体构架蛋白,通过“AT-钩”的结构来与DNA 中富含AT 的结构域结合,进而调节基因表达并产生相应的生物学作用。HMGA2 在食管癌、肺癌、胰腺癌等恶性肿瘤中均呈高表达趋势[11-14]且多项离体细胞实验表明,沉默HMGA2 能够抑制胃肠道恶性肿瘤细胞、宫颈癌细胞、肺癌细胞的迁移[15-17]。在本实验中,转染HMGA2-siRNA使食管癌Eca9706 细胞中HMGA2 的表达发生下调后,细胞在Transwell 及划痕实验中的迁移也明显受到抑制,说明HMGA2 参与食管癌细胞迁移的调控、HMGA2 表达的下调能够使食管癌细胞的迁移受到抑制,结合miR-33b 在其他细胞中对HMGA2 的靶向抑制作用及HMGA2 在食管癌迁移中的作用推测:miR-33b 对食管癌细胞迁移的抑制作用可能与其靶向调节HMGA2 表达有关。
为了验证这一推测,本实验首先分析了miR-33b 对食管癌细胞中HMGA2 的靶向作用。MiRs 发挥生物学作用的方式是与靶基因mRNA 的3’UTR以碱基互补配对的方式结合并阻碍mRNA 的翻译、抑制基因的表达。在Targetscan 中进行生物信息 学 分 析 可 知 ,HMGA2 mRNA 的 3’UTR 上 有miR-33b 的结合位点;将 HMGA2 mRNA 的 3’UTR装载进入双荧光素酶报告基因后,miR-33b 能够使相应双荧光素酶报告基因的荧光值降低, 说明miR-33b 能够在食管癌细胞中靶向结合HMGA2 mRNA 的 3’UTR、对 HMGA2 基因表达具有靶向调控作用。在此基础上,本研究设计了HMGA2 的过表达质粒,通过过表达HMGA2 的方式来进一步验证miR-33b 通过靶向HMGA2 调控食管癌的迁移,结果显示:在转染pcDNA3.0 空白质粒时,miR-33b 模拟物能够显著抑制食管癌细胞的迁移;而在转染pcDNA3.0-HMGA2 治疗使HMGA2 表达增加时,miR-33b 模拟物抑制食管癌迁移的作用发生了明显逆转,由此证实miR-33b 通过靶向抑制HMGA2 的表达来抑制食管癌细胞的迁移。
综上所述,miR-33b 能够直接靶向HMGA2 基因的表达并抑制食管癌Eca9706 细胞的迁移,未来miR-33b 可能成为食管癌治疗的新靶点,需进一步实验来验证。
