定点突变提高β-木糖苷酶Xln-DT 的酶活
2021-05-18童欣怡姜云鹏蒋玉洁李冬冬赵林果
李 琦, 童欣怡, 姜云鹏, 蒋玉洁, 李冬冬, 赵林果
(1. 南方现代林业协同创新中心,江苏 南京210037;2. 南京林业大学 化学工程学院,江苏 南京210037)
β-木糖苷酶(1,4-β-D-xylan xylohydrolase,EC 3.2.1.37)常与内切木聚糖酶联用,降解富含木聚糖的农林植物纤维原料,继而将木糖开发成可用于燃料、食品等行业中的系列化学品[1-2]。 此外,β-木糖苷酶也被越来越多地应用于植物资源中带有木糖基的天然活性物质(如萜类、黄酮类、甾体类化合物)的生物转化,进而获得更强药理活性的天然产物衍生物[3-5]。 无论是木聚糖的降解还是天然活性物质的生物转化,获得活性高、专一性强、酶学性质优异的β-木糖苷酶是关键的技术。
近年来,学者们已就β-木糖苷酶的来源、优良菌种的筛选、基因克隆和表达等方面进行了大量的深入研究[6-7]。 然而,现有的β-木糖苷酶仍存在着含量少、酶活低、稳定性差、底物特异性不佳等缺点,远不能满足工业应用的需求。 随着现代生物技术的不断革新,酶分子的体外定向进化技术已成为蛋白酶分子改造的有力工具[8]。 周海岩等[9]利用定点饱和突变技术将L-脯氨酸-4-羟化酶(P4H)的酶活提高了58%。 秦海彬等[10]在α-酮戊二酸半醛脱氢酶E120 位点处引入了天冬氨酸后, 酶活提高了322%。 蔡刘滕子等[11]利用定点突变技术对黑曲霉来源的木聚糖酶进行热稳定性改造,突变酶的最适温度提高了5 ℃,45 ℃下的半衰期由7 min 提高到15 min。李琦等[12]通过定点突变技术在木聚糖酶MxynB的相应位置引入二硫键, 并通过基因融合技术在N端融合了来源于嗜热菌的纤维素结合域CBD,使原酶的温度稳定性显著提高。
由于嗜热菌D. thermophilum 来源的β-木糖苷酶Xln-DT[13]在大肠杆菌中的表达量较低,笔者通过蛋白质结构模拟和分子对接等手段确定了β-木糖苷酶Xln-DT 可突变的位点。 利用反向PCR 技术扩增突变基因、 构建重组表达载体并获得突变酶,并对比分析了突变前后的酶学性质, 旨在获得酶活高、耐热性能强的优势突变酶,为后续的实际应用奠定了基础。
1 材料与方法
1.1 菌种和质粒
大 肠 杆 菌Escherichia coli Top10F′ 、 E.coli BL21(DE3)和重组质粒pET28a-xln-DT:均由南京林业大学化学工程学院微生物技术研究室保藏;表达质粒pET28a(卡那霉素(kana)抗性):购自美国Novagen 公司。
1.2 培养基
Lysogeny broth( LB)培养基:蛋白胨1 g、酵母提取物0.5 g、NaCl 1 g,溶于100 mL 蒸馏水中,121℃灭菌20 min 后备用,主要用于大肠杆菌菌种的活化及重组基因工程菌株的诱导表达。LB 固体培养基则在液体培养基中加入质量分数2%的琼脂。
1.3 酶和化学试剂
Prime STAR HS DNA 聚 合 酶、T4 DNA 磷 酸 化激酶、T4 DNA 连接酶、dNTP、DL 5 000 DNA Marker等:购自日本TaKaRa 公司;蛋白质相对分子质量标准Marker: 购自美国Promega 公司; 质粒小提试剂盒、凝胶回收试剂盒、卡那霉素等:购自美国Axygen公司;胰蛋白胨、酵母提取物:购自英国Oxoid 公司;对硝基苯基-β-L-木糖苷(p NPX):购自美国Sigma公司;其它常规试剂均为国产分析纯。 引物合成及测序由生工生物工程(上海)股份有限公司完成。
1.4 主要仪器
PCR 仪:德国Eppendorf 公司产品;5415R 台式高速冷冻离心机、SX-500 全自动高温高压蒸汽灭菌锅:日本Tomy 产品;凝胶成像仪:美国Bio-rad 公司产品;ZHWY-2102C 摇床: 上海智诚产品;SpectraMax190 全波长酶标仪: 美国Molecular Devices 公司产品。
1.5 蛋白质三维结构的预测和相关软件
利用分子生物学软件DNAMAN 6.0 进行氨基酸序列分析并进行Blast 比对。 利用PyMOL、Swiss Model 和I-TASSER Server 软件进行Xln-DT 蛋白结构模拟和活性催化中心预测。
基于I-TASSER Server 对Xln-DT 蛋白结构进行 预测[14],在I-TASSER Server 在线网站(https://zhanglab.ccmb.med.umich.edu/I-TASSER/)上输入β-木糖苷酶Xln-DT 的氨基酸序列, 得到蛋白质的三维预测结果及配体结合位点的具体信息。
1.6 酶与底物的分子对接
从Pubchem 下载p NPX 分子2D 结构[15],并以Sdf 格式保存,使用Schrodinger 2015 对p NPX 和β-木糖苷酶Xln-DT 的蛋白质结构进行预处理, 并使用Glide 6.6[16]在该蛋白质的配体结合位点处准备晶格文件,根据1.5 中获得的配体结合位点,将晶格中心坐标设置为x:80.92,y:91.18,z:82.72, 配体对接框长度2.0 nm,蛋白质的范德华半径比例因子设为0.8,绝对部分电荷的截断值设为0.15。 最后将预处理好的小分子p NPX 在晶格文件中进行对接, 软件运行后获得优化的预测对接构象。
1.7 氨基酸亲和性提高突变位点预测
基于分子对接的结果, 使用BioLuminate 1.8[17]对p NPX 周围的氨基酸(活性口袋处的氨基酸)进行饱和突变,计算突变前后的亲和力变化,具体原理见图1。根据突变能由高到低排序,挑选出突变能排序靠前的突变位点进行后续突变实验。 计算时,将突变的氨基酸看作配体,余下的所有氨基酸看作受体。 在此情况下,亲和力的改变可以用突变能ΔΔG(bind)来表征,该数值的负值代表着突变体比母体对小分子结合的更紧密。 具体计算公式为:

式(1)中,ΔG1为非突变体自由能变化,kJ/mol;ΔG2为 突 变 体 自 由 能 变 化,kJ/mol;ΔG3为BioLuminate 1.8 软件计算得出的非突变体和突变体之间的自由能变化,kJ/mol;ΔG4为BioLuminate 1.8 软件计算得出的结合配体后非突变和突变体之间的自由能变化,kJ/mol。

图1 蛋白质亲和力改变的突变能计算原理图Fig. 1 Schematic diagram of mutation energy calculation for protein affinity change
1.8 实验方法
1.8.1 定点突变引物设计 利用同源建模、生物信息学分析、分子对接等手段,改变β-木糖苷酶Xln-DT 的部分氨基酸, 设计突变位点, 以嗜热菌D. thermophilum DSM 3960 的GH39 家族的β-木糖苷酶基因序列xln-DT 为模板, 设计带有酶切位点的引物,每个突变位点设计正反向两条寡核苷酸序列,见表1。 利用反向PCR 技术获得突变序列。

表1 定点突变引物表Table 1 Nucleotide sequences of used primers
1.8.2 定点突变实验方案 将上、 下游引物用TE缓冲溶液稀释成10 μmol/L 工作液,以pET28a-xln-DT 为模板, 利用反向PCR 技术获得重组突变表达质粒。
PCR 反应体系如下:0.5 μL pET28a-xln-DT,各1.0 μL 的引物F 和引物R,4.0 μL dNTP Mixture,10.0 μL 5×PS 缓冲液,0.5 μL Prime STAR HS DNA聚合酶,44 μL 蒸馏水。
PCR 反应条件如下:98 ℃保温5 min,98 ℃变性0.5 min,60 ℃退火0.5 min,72 ℃延伸4.5 min,18个循环,72 ℃延伸10 min 后于4 ℃保持。 将扩增后PCR 片段于37 ℃下磷酸化反应1 h, 加入1 μL T4 ligase 连接酶,于16 ℃下连接3 h 后在42 ℃水浴锅中热击转化至大肠杆菌E.coli Top 10F′感受态细胞中,挑取单菌落接入到含有Kana 抗性的LB 培养基中过夜培养,提取质粒后进行测序鉴定。
1.9 突变酶的酶活测定、纯化及SDS-PAGE 分析
将测序正确的重组表达质粒pET-28a-xln-DT-161、pET-28a-xln-DT-167、pET-28a-xln-DT-202 和pET-28a-xln-DT-231 热击转化至大肠杆菌E.coli BL21(DE3)中。 挑取单菌落至5 mL 的LB 液体培养基中, 加入0.01 mmol/L 的异丙基硫代半乳糖苷(IPTG)过夜诱导表达后离心,沉淀加入柠檬酸-磷酸盐缓冲液(pH 6.0)重悬,经超声破碎后离心10 min,上清液即为粗酶液。将收集的粗酶液进行酶活测定,以pNPX 为底物,根据文献[18]进行酶活测定。酶活定义如下:75 ℃、pH 6.0 时每分钟产生摩尔质量为1 mmol 对硝基苯酚所需的酶量为1 个酶活单位。
酶的纯化方式如下:Ni2+亲核层析柱平衡后,将粗酶液以1 mL/min 上样,将25 mmol/L 磷酸盐缓冲液以同流速洗去未吸附的酶蛋白及杂质; 随后用200 mmol/L 的咪唑缓冲液进行洗脱, 并收集蛋白质;纯化后的酶液经透析除盐后进行SDS-PAGE 分析。 目的蛋白质采用Bradford 法进行蛋白质浓度的测定。 酶活(A)以及比酶活(B)的计算公式如下:

式中:c 为由对硝基苯酚标准方程计算出的酶反应后的对硝基苯酚的量,μmol;t 为酶与底物反应时间,min;V1为反应体系总体积,mL;V2为酶液体积,mL;N 为酶液稀释倍数;C 为蛋白质质量浓度,mg/mL。
1.10 突变酶的酶学性质分析
最适温度: 在pH 6.0 的柠檬酸-磷酸盐缓冲液中,分别测定突变酶和Xln-DT 在65、70、75、80、85℃下的酶活, 以测定的最高酶活为100%计算相对酶活,最高酶活对应的温度即为最适温度。
最适pH:在各自的最适温度下,分别测定突变酶和Xln-DT 在pH 值为4.5、4.5、5.0、5.5、6.0、6.5、7.0 下的酶活,以测定的最高酶活为100%计算相对酶活,最高酶活对应的pH 即为最适pH。
温度稳定性: 将酶质量浓度分别为1.10、1.25、1.29、1.09 mg/mL 的野生型酶Xln-DT、突变酶Xln-DT-202PHE、Xln-DT-202LEU、Xln-DT-167ALA 在75、85 ℃下分别保温30、60、90、120、180、240 min,以未育温的酶液所测定的酶活为100%计算剩余酶活力,即为温度稳定性。
pH 稳定性:在4 ℃下,分别将突变酶和Xln-DT置于不同pH 值(4.0~7.0)的柠檬酸-磷酸盐缓冲液中保存24 h, 在最适温度及最适pH 下测定其残余酶活力, 以未经pH 缓冲液处理的酶液所测定的酶活为相对100%,即为pH 稳定性。
耐木糖系数Ki:在添加不同浓度木糖的反应体系中,在最适温度和pH 下测定突变酶和Xln-DT 的酶活力值,以不加糖所测的酶活力值为100%,计算并获得不同木糖浓度下重组酶的相对酶活力值,以相对酶活力值为50%时所对应的木糖浓度即为Ki。
动力学常数:以p NPX 为底物,底物浓度范围为0.01~3.00 mmol/L, 分别测定纯化后的突变酶和Xln-DT 的酶活。采用双倒数作图法[19]计算突变酶和Xln-DT 的动力学参数(Vmax,Km,Vmax/ Km)。
2 结果与讨论
2.1 突变位点的选择
由于嗜热菌D. thermophilum 来源的Xln-DT蛋白结构尚未解析,基于PDB 在线数据库中来源于Thermoanaerobacterium saccharolyticum 的GH 39 家族的β-木糖苷酶XynB (1UHV)[20]与Xln-DT 具有70.18%的同源性。 利用Swiss-Model 在线软件对Xln-DT 进行同源建模,使用可视化工具PyMOL 对Xln-DT 进行结构模拟,结果见图2。 利用Glide 6.6软件对人工底物p NPX 与β-木糖苷酶Xln-DT 进行分子对接,计算筛选出3 个正相关的关键突变位点(GLU161、CYS202 和TYR231) 和1 个阴性对照位点(PHE167),见表2。
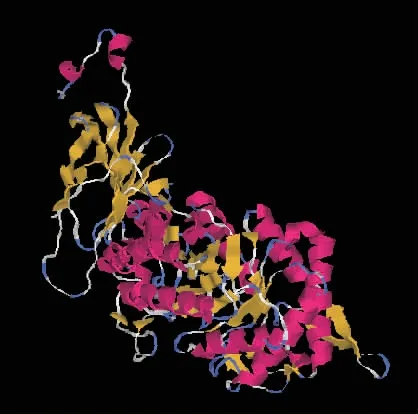
图2 β-木糖苷酶Xln-DT 的分子模型Fig. 2 Molecular model of Xln-DT

表2 Xln-DT 突变能计算Table 2 Calculation of Xln-DT mutation energy (binding)
2.2 突变体重组表达质粒的构建和表达
以重组表达质粒pET-28a-Xln-DT 为模板,通过反向PCR 引入6 个位点的氨基酸基因,经测序验证所有点突变编码正确。 将突变正确的质粒转化E.coli BL21(DE3)感受态细胞,随机挑取转化子进行诱导表达,诱导表达结果见图3。 当GLU161 突变成HIS 和LEU、TYR231 突变成TRP 之后, 酶活丧失, 而CYS202 突变成PHE 和LEU 后酶活分别提高了3.28 和2.97 倍, 而PHE167 突变成ALA 之后酶活降低了50%。 结合表2 中突变能的预测数值可知, 除去经试验验证的酶活丧失的阴性突变体GLU161HIS、TYR231TRP、GLU161LEU 外, 突变体CYS202PHE、CYS202LEU、PHE167ALA 的ΔΔG 逐次升高,分别为-1.22、-1.15、1.33,而实验结果显示这3 个突变体表达的酶活则依次降低,由此可见ΔΔG 的数值为负值且数值越小,突变体比野生型原酶对小分子的结合越紧密,理论上较野生型原酶的亲和力就越强,从而可通过提高突变体的比酶活来提高表达的酶活力。 因此,为了验证此猜想,作者对各突变体及野生型原酶进行了纯化,以比较其比酶活、动力学参数等。

图3 酶活提高关键位点突变后的酶活Fig. 3 Enzyme activity after mutation of key site for enzyme activity improvement
收集发酵后的Xln-DT 及突变体经镍柱纯化后, 获得电泳纯的Xln-DT、Xln-DT-202PHE、Xln-DT-202LEU 和Xln-DT-167ALA 多位点突变体,见图4。 将纯化后的Xln-DT 和突变体分别测定蛋白质质量浓度和比酶活,其中,CYS202 突变成PHE 和LEU 后,比酶活分别提高了2.86 和2.54 倍,由此可知,202 位点为酶活提高的关键氨基酸位点。

图4 重组酶Xln-DT 及突变体的蛋白质电泳图Fig. 4 SDS-PAGE of recombinant protein Xln-DT and 202/167 mutants
2.3 突变体的酶学性质研究
2.3.1 突变体的最适温度和最适pH 突变体酶和Xln-DT 的最适温度见图5(a)。 Xln-DT 的最适温度为75 ℃, 突变体Xln-DT-202PHE 和Xln-DT-167ALA 的最适温度维持不变,而Xln-DT-202LEU则升高至80 ℃。
突变体酶和Xln-DT 的最适pH 见图5(b)。Xln-DT-202PHE 和Xln-DT-202LEU 的最适pH 由原酶的6.0 分别下降至4.5 和5.0, 而Xln-DT-167ALA 则降为5.0。

图5 202/167 突变体的最适温度和最适pHFig. 5 Optimal temperature and p H values of 202/167 mutants
2.3.2 突变体的温度稳定性和pH 稳定性 对突变体酶和Xln-DT 在75、85 ℃下的热稳定性进行研究,结果见图6。突变体Xln-DT-202PHE 在75 ℃下的温度稳定性有显著提高,保温2 h 后,剩余酶活力仍能保持100%。 而突变体Xln-DT-167ALA 在75、85 ℃下的温度稳定性均有明显下降。 由图1 可知,配体的自由能不变, 所以当突变体的△△G 为负值时,可理解为突变酶蛋白质的自由能均小于野生型酶蛋白的自由能,而自由能越小酶越稳定,因此表现为突变酶的热稳定性提高。

图6 202/167 突变体的温度稳定性Fig. 6 Temperature stability of mutants 202/167
突变体酶和Xln-DT 的pH 稳定性结果见图7。突变体Xln-DT-202PHE、Xln-DT-202LEU 和Xln-DT-167ALA 在pH 值为4.0~7.0 的范围内稳定性较原酶略有下降,但仍能保持80%以上的相对酶活力。

图7 202/167 突变体的p H 稳定性Fig. 7 pH stability of 202/167 mutants
2.3.3 突变体的耐糖系数Ki和动力学参数 将纯化后的Xln-DT 和突变体Xln-DT-202PHE、Xln-DT-202LEU、Xln-DT-167ALA 分别测定耐糖系数Ki和动力学常数,结果见表3。 其中,突变体Xln-DT-202PHE 和Xln-DT-202LEU 的Km值较原酶Xln-DT 相比下降明显,说明其对p NPX 的亲和力提高了,这与预测的△△G 结果一致,见表2。 突变体Xln-DT-202PHE 和Xln-DT-202LEU 突变后△△G为负值,对配体的亲和力更强;突变后的Ki系数显著降低,由原酶的3 394 mmol/L 降低到249 mmol/L和592 mmol/L, 但仍要高于已报道的β-木糖苷酶,尤其是GH 3 家族来源的β-木糖苷酶[18]。 而突变体Xln-DT-167ALA 动力学常数Km、Vmax变化不大,耐糖系数Ki则下降至1 023 mmol/L。

表3 202/167 突变体耐糖系数和动力学参数Table 3 Xylose tolerance coefficient and kinetic parameters of 202/167 mutants
3 结 语
以来源于D. thermophilum 的β-木糖苷酶Xln-DT 为研究对象,通过分子对接、定点突变和酶学性质分析等手段, 对Xln-DT 的酶活提高关键位点进行研究,主要结论如下:
1) 利用I-TASSER Server 在线软件对Xln-DT进行蛋白质结构预测, 利用p NPX 与Xln-DT 分子对接计算筛选出基于酶活提高的关键氨基酸位点202, 并获得突变体Xln-DT-202PHE 和Xln-DT-202LEU。
2)与Xln-DT 相比,突变体Xln-DT-202PHE 和Xln-DT-202LEU 的酶活分别提高了3.28 和2.97倍,比酶活分别提高了2.86 和2.54 倍。Km值也较原酶小, 说明突变体Xln-DT-202PHE 和Xln-DT-202LEU 对p NPX 的亲和力提高, 但突变后的Ki系数显著降低。
3)与Xln-DT 相比,突变体Xln-DT-202PHE 和Xln-DT-202LEU 的最适温度维持不变;最适pH 则下降明显。 突变体Xln-DT-202LEU 的温度稳定性有显著提高; 而所有突变体的pH 稳定性均有不同程度下降,但仍能保持80%以上的相对酶活力。
研究结果不但显著提高了酶的活力,而且热稳定性也得到显著改善,从而为该酶的进一步改造和实际应用奠定了基础。
