下丘脑腹内侧核腹外侧区激活恶化心肌梗死后的心脏功能
2021-05-17刘子韩刘志豪周雨扬许骁李泽衍周丽平江洪
刘子韩 刘志豪 周雨扬 许骁 李泽衍 周丽平 江洪
(武汉大学人民医院心内科 武汉大学心脏自主神经研究中心 武汉大学心血管病研究所 心血管病湖北省重点实验室,湖北 武汉 430060)
心血管疾病是目前最常见的疾病及死亡因素之一[1],而社会压力引起的长期情绪应激在增加心血管疾病患病风险和影响疾病预后中起着重要作用[2]。目前已有大量临床研究表明,长期的抑郁情绪会通过改变机体神经免疫功能从而加重心脏功能障碍及促进心肌重构[3],而良好地缓解压力可很好地促进患者心肌梗死后心肌损伤修复及改善预后[4]。在这种压力下,大脑中主要激活的情绪核团包括下丘脑、杏仁核和孤束核等[5]。下丘脑腹内侧核(ventromedial hypothalamus,VMH)是大脑中调控进食、能量代谢和情绪的关键脑区[6-8]。下丘脑腹内侧核腹外侧区(ventrolateral part of ventromedial hypothalamus,VMHVL)是VMH中主要介导攻击行为和愤怒情绪的关键核团亚区,VMHVL活性的升高可直接诱导大鼠产生攻击行为与愤怒情绪,而抑制其活性可降低大鼠的活动性[9]。目前关于情绪应激行为对心脏影响的动物和临床研究已有大量报道,但较少关注情绪核团与心脏的关系,而研究这种关系最直接的方法就是特异性激活特定核团来观察其对心脏的影响。本研究通过化学遗传技术精准激活愤怒情绪相关核团VMHVL,利用脑立体定位技术将激活型的化学遗传病毒[rAAV-hSyn-hM3D(Gq)-EGFP-WPRE-pA]精准表达在VMHVL脑区中,并于腹腔注射氯氮平一氧化氮(clozapine N-oxide,CNO)激活神经元上表达的hM3D(Gq)受体从而激活VMHVL,连续干预14 d后检测其对心肌梗死后心脏结构和功能的影响。
1 材料与方法
1.1 实验动物准备
本实验经武汉大学动物实验伦理委员会审核并批准。10只健康成年SD大鼠(体重200~250 g)由武汉大学实验动物中心提供,将10只大鼠随机分为激活组(n=5)和对照组(n=5)。在SPF环境分笼进行适应性饲养1周,每日给予充足标准饲料和水。实验前大鼠禁食禁饮12 h,在实验过程中保持环境安静,室温保持在(22±2)℃。
1.2 VMHVL脑立体定位注射
用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,将头部剃毛并固定。碘伏消毒后切开头皮,用过氧化氢去除脑膜并暴露颅骨人字缝和矢状缝。定位针端以前囟为定位原点(X=0 mm,Y=0 mm,Z=0 mm),查阅图谱可得VMHVL核团中心坐标为(X=0.8 mm,Y=-2.76 mm,Z=9.8 mm)。根据VMHVL定位在右侧颅骨钻孔,并将吸取病毒的微量注射针针尖调整至VMHVL所在坐标处。在激活组右侧VMHVL以10 nL/min缓慢注射rAAV-hSyn-hM3D(Gq)-EGFP-WPRE-pA;AAV2/9(2.0×1012viral particles/mL,200 nL,枢密科技,中国武汉)。在对照组相同位置注射等量rAAV-hSyn-EGFP-WPRE-pA;AAV2/9。注射完毕停留10 min后缓慢退出微量注射针,完成定位注射。伤口缝合后将大鼠继续饲养3周,保证病毒高度表达。
1.3 心肌梗死模型构建
病毒注射3周后,将激活组与对照组的大鼠用戊巴比妥钠麻醉,仰卧位固定于实验台上,连接至小动物呼吸机并给予正压通气。经左前胸剃毛、消毒后打开胸腔,暴露心脏。打开心包,暴露左心耳,肉眼可见左心耳下方有一往下走行的左冠状动脉前降支,结扎后可见结扎部位以下心肌明显缺血。关胸后密切关注生命体征,等待大鼠清醒。
1.4 超声心动图测量
心肌梗死造模后,激活组与对照组均连续14 d腹腔注射CNO[3 mg/kg,2 mL/(次·d)]。14 d后将大鼠麻醉后仰卧固定于实验台,左前胸剃毛,测定心脏二维超声心动图,分别测量左室射血分数(LVEF)、左室短轴缩短率(LVFS)、左室舒张末期内径(LVEDd)、左室收缩末期内径(LVESd)、左室舒张末期容积(LVEDV)和左室收缩末期容积(LVESV)。
1.5 VMHVL核团激活、血清去甲肾上腺素及免疫荧光检测
处死大鼠之前,打开腹腔并从下腔静脉收集外周血,以3 000 r/min离心15 min并提取血清,储存于-80 ℃环境下,之后采用ELISA试剂盒进行血清去甲肾上腺素(norepinephrine,NE)含量测定,检测步骤根据试剂盒说明书操作。处死大鼠后,将脑组织完全取下,浸泡在多聚甲醛中保存,脱水后在VMHVL脑区取5 μm冰冻切片进行荧光分析。增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)为自发免疫荧光,直接在荧光显微镜下观察。使用C-FOS抗体(Abcam,英国剑桥)和兔抗二抗对脑区C-FOS进行免疫荧光染色并在荧光显微镜下观察。全程操作注意避光。
1.6 统计学分析
本实验所有数据均以平均数±标准差表示。采用GraphPad Prism 8.0系统进行统计学分析与作图。先对所有计量数据进行Kolmogorov-Smirnov检验以明确是否符合正态分布,再采用独立样本t检验进行组间比较,将P<0.05定义为差异具有显著性。
2 结果
2.1 两组干预对VMHVL神经元活性的影响
激活组和对照组SD大鼠在接受VMHVL化学遗传病毒注射3周后,发现VMHVL处有大量绿色荧光蛋白表达,见图1A。两组均腹腔注射CNO后,激活组VMHVL神经元活性显著高于对照组(标准化C-FOS计数,激活组vs对照组:1.40±0.08 vs 1.00±0.09,P<0.01),见图1B和图1C。
2.2 VMHVL激活对外周交感神经活性的影响
激活组和对照组SD大鼠接受CNO注射2周后,取外周血清检测NE活性。发现激活组大鼠血清中的NE相较于对照组,NE的浓度被VMHVL的化学遗传激活效应升高[激活组vs对照组:(4 372.26±221.10) pg/mL vs (2 018.47±466.89) pg/mL,P<0.001]。见图1D。
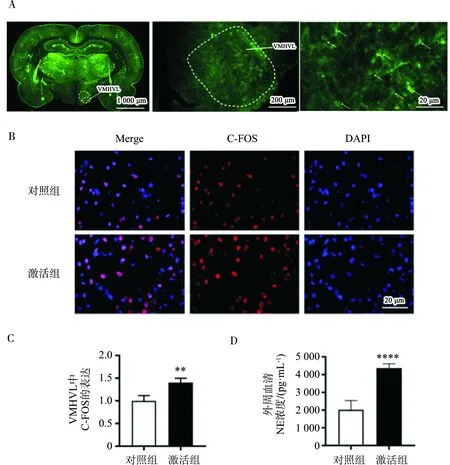
注:图A左一(1 000 μm):该视野下转染了化学遗传病毒的VMHVL层面全脑脑片EGFP荧光图,白色虚线区域为VMH,白色箭头所指部位为VMHVL;图A左二(200 μm):该视野下转染了化学遗传病毒的右侧下丘脑局部EGFP荧光图,白色虚线区域为VMHVL;图A左三(20 μm):该视野下转染了化学遗传病毒的VMHVL局部EGFP荧光图,白色箭头所指为转染腺病毒后表达的EGFP的神经细胞;图B(20 μm):两组大鼠VMHVL中C-FOS表达;图C:两组C-FOS阳性细胞标准化计数,**:P<0.01;图D:两组外周血清中NE浓度(pg/mL),****:P<0.001。Merge:荧光图叠加C-FOS+DAPI;DAPI:4’,6-二眯基-2-苯基吲哚。图1 VMHVL中化学遗传病毒转染、神经元激活情况以及外周循环交感神经激活情况
2.3 VMHVL激活对心肌梗死后心脏结构和功能的影响
心肌梗死后两周,测定大鼠二维超声心动图,见图2A。超声心动图显示,激活组大鼠对比对照组大鼠,LVEF明显降低[(63.60±2.12)% vs (44.90±6.39)%,P<0.005],LVFS明显降低[(29.39±3.36)% vs (19.62±3.27)%,P<0.01]。LVEDd显著增宽[(8.36±0.55) mm vs (6.54±0.54)mm,P<0.01],LVESd也显著增宽[(6.74±0.50) mm vs (4.38±0.48) mm,P<0.005]。此外,LVEDV明显增加[(1.28±0.21) mL vs (0.65±0.15) mL,P<0.001],LVESV也明显增加[(0.70±0.15) mL vs (0.22±0.08) mL,P<0.001]。见图2B。
3 讨论
下丘脑是大脑皮层下植物神经的最高中枢,可调节包括心脏在内的许多内脏的生理活动。有研究表明,下丘脑可从经典的情绪相关核团,例如杏仁核和海马中,接受神经纤维的投射,并已被证明其在复杂的情绪调节中起重要作用[10-11]。在情绪应激的环境下,下丘脑-垂体-肾上腺轴(HPA轴)被认为是导致循环糖皮质激素升高和自主神经活动增加的主要神经生物学机制,并在心血管应激反应中起重要作用[12]。下丘脑中主要的与情绪相关的子核团包括下丘脑腹内侧[11]、弓状核[13]和下丘脑背内侧核[14]。VMH是大脑中涉及情绪网络的一个相关脑区,且有研究表明VMH活性的改变在调节机体的血压和心率上有一定的作用[15],VMH活性变化也与机体自主神经系统的活性改变密切相关。研究表明,电刺激VMH会增加外周交感神经活性,而直接损毁VMH则会增加外周副交感神经活性[12]。Lin等[9]用光遗传学和化学遗传学的方法,通过改变核团活性来改变小鼠的行为,从而证实位于VMH内的子核团VMHVL是介导攻击行为和愤怒情绪的关键核团。由此可见,中枢情绪核团的激活与外周自主神经系统活性是密切相关的。
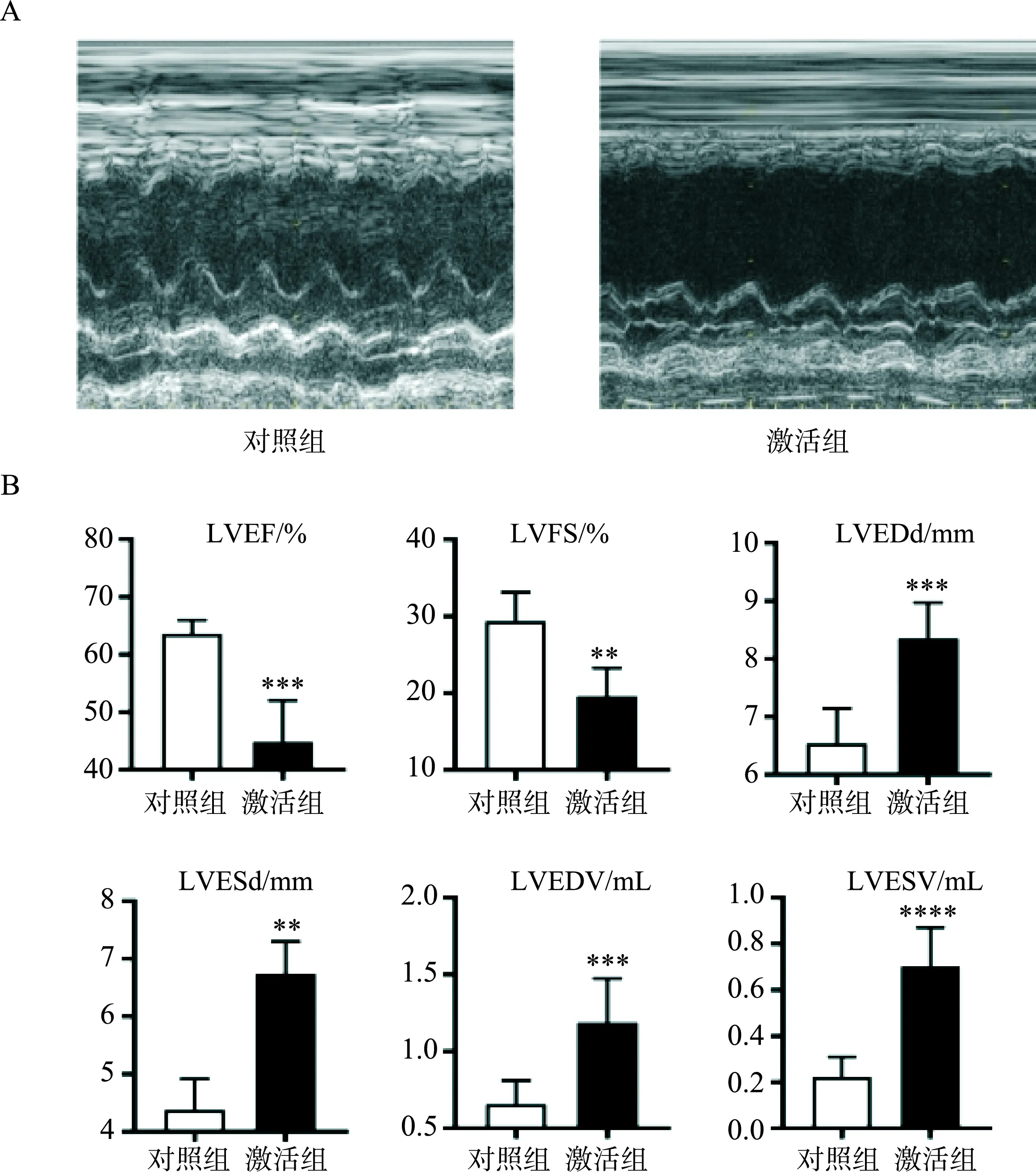
注:图A为两组大鼠二维超声心动图对比;图B为经二维超声心动图检查所得各项心脏指标。***表示P<0.005,**表示P<0.01,****表示P<0.001。图2 VMHVL激活对心肌梗死后心脏结构和功能的影响
在此基础上,本研究采用化学遗传方法中仅由定制药物激活的定制受体(designer receptors exclusively activated by designer drugs,DREADDs)来特异性激活VMHVL。DREADDs可通过惰性药物(如小分子)激活,以对细胞信号传导、神经元活动和行为进行长时程的调控[16-17]。通过定向分子转化的过程,创建人突变型毒蕈碱型乙酰胆碱受体(M1、M2、M3、M4和M5型),该类受体对内源性配体乙酰胆碱无效,却能被CNO激活[10]。选取激活型受体hM3D(Gq),其激活将触发细胞膜Ca2+的内流产生膜电位,从而诱发神经元产生神经冲动,该效应会持续至结合的CNO被机体完全代谢消除。目前评价DREADD效应的指标主要有四种(前两种为最常用的方法):(1)急性离体脑切片电生理学检测[18];(2)神经元活性相关的蛋白C-FOS含量[19];(3)在体多通道微电极阵列神经信号技术检测神经元活性;(4)基于钙成像技术的神经元活性检测[20]。本研究选择C-FOS荧光染色作为判断神经元激活的指标[21]。此外,腺病毒通常用作目的基因传递载体,用来在目标神经元中实现目标受体的高水平表达[16]。目前化学遗传技术已广泛应用于神经科学领域,并成为鉴定神经回路结构和功能的重要工具,用以特异性激活或抑制特定的中枢脑区[22]。在本研究中,利用化学遗传技术成功将hM3D(Gq)受体表达在VMHVL神经元上,并通过腹腔注射CNO,激活VMHVL神经元细胞膜上的hM3D(Gq)受体。有实验荧光结果显示,激活组VMHVL较对照组有更多的C-FOS表达,提示VMHVL神经元被成功激活。
在外周,自主神经系统在心血管功能的调节上发挥重要作用。生理状态下,机体交感神经与副交感神经的活性处于动态平衡,而绝大部分心脏疾病的发生和发展都与交感神经的过度激活有关[23]。从大脑皮层到脊髓的各级神经系统,也分布着调节心脏活动的中枢。在大脑中,下丘脑室旁核(paraventricular nucleus,PVN)已被证明是整个交感神经活性和调节心血管功能的中心环节,而PVN功能的激活可增加心脏交感神经活性并加重心脏功能障碍和结构重构[24]。最近的研究表明,PVN与VMHVL之间存在神经纤维的双向投射,即二者之间存在结构与功能的连接[25]。在本研究中,成功激活心肌梗死后大鼠的VMHVL两周,超声结果发现大鼠心脏功能在VMHVL激活后明显恶化,结构改变也较对照组明显。这提示,VMHVL的激活可能会通过激活PVN,提高机体的交感神经活性,打破交感神经与副交感神经的动态平衡,从而影响外周心脏的功能障碍和结构改变。值得一提的是,VMHVL与心脏之间相互影响的自主神经通路需进一步的研究和探索。血清NE的结果提示,化学遗传激活VMHVL神经元确实引起外周交感神经指标的升高,提示一定程度的交感神经激活作用。
由此可见,机体的情绪应激对心肌梗死后心脏功能变化有着重要影响。本研究将中枢情绪脑区与外周器官的功能变化相联系,通过干预核团活性从而对外周心血管系统的功能和结构进行调控,而实验结果也提示VMHVL介导的慢性情绪应激可恶化心肌梗死后心脏功能。未来需进一步研究VMHVL情绪核团激活影响心脏的具体神经通路,并探索其潜在的分子机制,可在临床上为心肌梗死患者精准调控情绪,进一步改善心肌梗死后心功能的恢复,提供新思路和新的治疗方案,也为心血管疾病高风险及情绪易激动的患者提供新颖的心血管疾病预防策略。
