垂体后叶素致渗透性脱髓鞘综合征1例
2021-05-14刘全生曾小凤张雯凌
刘全生,曾小凤,张雯凌,吴 涛
1.川北医学院附属医院神经内科,四川南充 637000;2.川北医学院附属医院全科医学科,四川南充 637000;3.四川省宜宾市第二人民医院全科医学科,四川宜宾 644000
渗透性脱髓鞘综合征(ODS)又称为渗透性髓鞘溶解综合征,是一种急性非炎性中枢神经脱髓鞘病变。ODS的主要特点是临床症状与影像学表现不同步,易被漏诊和误诊。ODS在成年人中很少见(0.40%~0.56%)[1]。国内关于使用垂体后叶素导致ODS报道较少。现将川北医学院附属医院神经内科收治的1例因使用垂体后叶素引起低钠血症导致ODS的病例报道如下。
1 临床资料
患者,男,42岁,因“发热、咳嗽半月,咯血1周,精神行为异常3 d” 于2019年4月9日就诊于川北医学院附属医院。入院前半月患者无明显诱因出现发热、咳嗽,最高体温达39 ℃,咳少量白色黏液痰,于当地医院输液治疗3 d无缓解。入院前1周,患者出现咯血2次(具体咯血量不详)于当地县人民医院住院治疗,完善相关检查考虑诊断“支气管扩张伴感染”,予以头孢噻肟2 g 每日两次、垂体后叶素12 U每日1次静脉滴注及输注等渗溶液等治疗。入院前3 d患者出现精神行为异常,主要表现为记忆力减退、言语减少,反应迟钝,伴非喷射性呕吐,呕吐物为胃内容物,伴食欲不振、腹泻,入院前7 h患者出现意识障碍、呼之不应,转入川北医学院附属医院神经内科进一步诊治。院外辅助检查4月2日血常规、电解质未见异常,甲状腺功能指标血清游离三碘甲状腺原氨酸(FT3)、血清游离甲状腺素(FT4)、促甲状腺激素(TSH)及皮质醇激素正常。4月6日血常规:白细胞计数7.89×109/L、中性粒细胞比例80.1%;电解质:钾3.59 mmol/L、钠112.8 mmol/L、氯77.2 mmol/L,予以3%氯化钠溶液输入纠正低钠血症、停用垂体后叶素。4月7日查电解质:钾3.32 mmol/L、钠108.1 mmol/L、氯73.6 mmol/L。4月8日查电解质:钾2.96 mmol/L、钠137.0 mmol/L、氯99.0 mmol/L。既往史:患者20年前曾诊断为肺结核,治疗经过不详,未定期复诊。近3年患者反复咳嗽、咳痰,予以口服药物治疗后有缓解(具体不详)。余无特殊。
入院查体:体温38.2 ℃,脉搏94次/分,呼吸27次/分,血压125/63 mm Hg。胸廓无畸形,双肺呼吸音粗,未闻及明显干湿啰音及胸膜摩擦音。心脏及腹部查体未见明显异常。专科查体:昏睡,疼痛刺激可睁眼,问之不答,高级神经功能检查不配合,颈阻阳性,双眼球居中、无震颤,双侧瞳孔等大等圆、对光反射灵敏,鼻唇沟对称,口角无歪斜,伸舌不配合,四肢查体不合作,疼痛刺激可见四肢活动,四肢肌张力正常,四肢深反射减弱,双侧病理征阴性。
入住川北医学院附属医院神经内科时,血常规:白细胞计数10.91×109/L、中性粒细胞比例84.6%;生化分析1:总蛋白64.2 g/L、清蛋白35.4 g/L、钾2.96 mmol/L、钠135.2 mmol/L、氯101.0 mmol/L、葡萄糖7.78 mmol/L;头颅CT:右侧额叶点状钙化灶;胸部CT:双肺散在多形性病变,考虑继发性肺结核,目前以纤维化、钙化灶为主,双肺上叶、右肺中叶多发支气管扩张,双肺上叶尖后段多发肺大疱形成。
诊治经过:患者入住川北医学院附属医院神经内科重症监护室,考虑诊断为颅内感染、代谢性脑病,下病危通知,监测生命体征,吸氧,予降颅内压、抗感染、营养支持、维持内环境平衡等治疗。入院当天查头颅MRI:弥散加权成像(DWI)显示双侧额颞顶部脑回分布稍高信号(图1)。完善腰椎穿刺术测脑脊液压力142.8 mm H2O,脑脊液清亮,常规、生化项目未见异常,涂片未查见细菌、抗酸杆菌、真菌,脑脊液及血清自身免疫性脑炎抗体阴性。结合患者病史及院外检查结果考虑为ODS,予抗感染、大剂量激素+丙种球蛋白、降颅内压、维持水电解质平衡等治疗。7 d后复查头颅MRI+MRV:双侧基底节呈对称性T1WI低信号、T2WI及T2液体衰减反转回复序列(FLAIR)高信号,双侧背侧丘脑、双颞叶、枕叶及脑干内可见条片样脑白质弥散受限,头部MRV未见异常(图2)。复查影像支持ODS的诊断,给予上述治疗后患者病情无明显好转。于2019年5月20日出院时患者呈去皮质状态,出院诊断:(1)ODS;(2)支气管扩张伴感染;(3)陈旧性肺结核;(4)电解质代谢紊乱;(5)肺大疱;(6)双下肢深静脉血栓形成;(7)低蛋白血症。
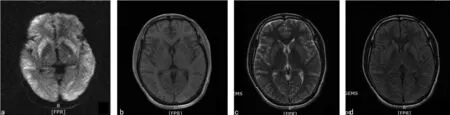
注:a为DWI示双侧基底节、颞叶高信号;b为T1WI示双侧基底节稍高信号;c为T2WI示双侧基底节稍高信号;d为FLAIR示双侧基底节稍高信号。
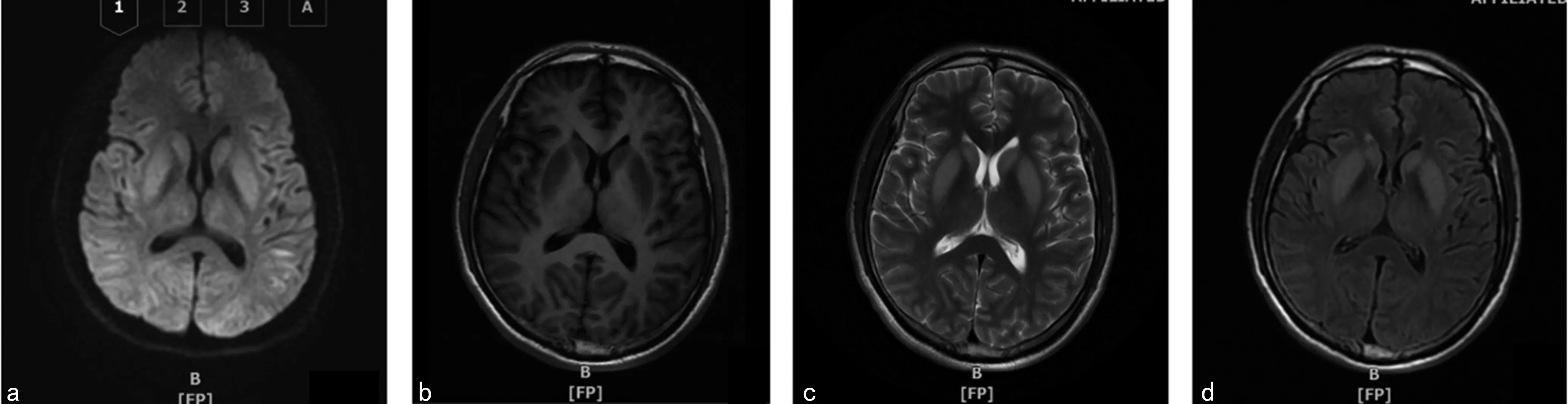
注:a为DWI示双侧基底节、背侧丘脑、枕叶、颞叶对称性高信号;b为T1WI示双侧基底节对称性高信号;c为T2WI示双侧基底节对称性高信号;d为FLAIR示双侧基底节对称性高信号。
2 讨 论
ODS根据发生部位分为脑桥中央髓鞘溶解症 (CPM)和脑桥外髓鞘溶解症(EPM),两者可以单独存在也可同时发生。当涉及脑桥、皮质和皮质脊髓束时,经典表现为构音障碍、吞咽困难以及松弛性麻痹转变为痉挛。如果病变进一步扩展,可导致动眼功能障碍和闭锁综合征。EPM的特征是震颤、共济失调和运动障碍,例如缄默症、帕金森病、肌张力障碍和紧张症[2]。当脑桥和脑桥外病变同时存在时,临床表现通常是混合且可变的。
ODS较早的病例见于慢性酒精中毒和营养不良,从20世纪70年代研究者开始提出ODS与快速纠正低钠血症有关。本例患者因咯血使用垂体后叶素,排除其他导致重度低钠血症原因,检索文献及相关报道,考虑垂体后叶素引起的严重低钠血症[3]。
垂体后叶素是从猪、牛等动物的脑垂体后叶中提取的水溶性成分,由催产素和血管加压素(抗利尿激素)组成。血管加压素通过激活位于血管平滑肌细胞中的V1受体引起血管收缩,从而达到止血目的;同时血管加压素可激活肾集合管细胞基底外侧膜的V2受体,使顶端细胞膜的透水性显著增加以促进水的重吸收,从而降低血浆渗透压。当患者有肺部疾病时,位于胸腔内容量感受器的信号传导障碍,对各种刺激所致的抗利尿激素抑制或分泌有异常反应,静脉滴注垂体后叶素时,可引发抗利尿激素分泌不当综合征,增加了尿钠的排出,使血钠更低。且本例患者有食欲不振、腹泻的症状,可进一步加重低钠血症。
急性低钠血症时细胞水肿,无机离子从脑细胞内转移到细胞外间隙以减轻水肿,当渗透压恢复时,这些无机离子可迅速转移至细胞内。而慢性低钠血症时,电解质和有机渗透物的丢失是调节脑容量的有效机制[4]。当慢性低钠血症被过快纠正,有机渗透物的再摄取比低钠血症适应期有机渗透物的丢失慢得多,细胞内、外水快速转移到血管引起少突胶质细胞脱水和髓鞘退化,导致脑桥和脑桥外结构中的少突胶质细胞凋亡,出现髓鞘脱失、溶解,即ODS[5]。
ODS的组织病理学特点是髓鞘破坏但神经元及轴突相对完好,无炎性反应及血管改变,病变呈对称性。目前头颅MRI是临床诊断 ODS的关键。ODS患者头颅MRI影像学改变可表现为病灶在 T2WI和T2 FLAIR显示高信号,在 T1WI显示低信号,DWI早期显示高信号。DWI、T2和T2 FLAIR序列在ODS诊断中具有同等的价值[6]。本病例头颅MRI影像学改变符合ODS影像学特点。有研究显示约20% ODS患者最初头颅MRI是正常的,往往在发病后1~2周才显示病灶。因此对于高度怀疑ODS且早期(<7 d)MRI检查病变不明显的患者,应在1~2周后复查头颅MRI。
ODS是由先前的原发疾病引起的继发性神经系统疾病。多数ODS患者在数周内死亡,少数存活患者遗留不同程度的不可逆性神经损害,后果严重。
目前对ODS的治疗仍处于试验阶段,主要有类固醇皮质激素、静脉注射丙种球蛋白、血浆置换以及高压氧等治疗方法[7],但尚无循证学依据。故在临床诊疗过程中应重视ODS的预防,尤其是慢性低钠血症的患者在纠正低钠的过程中需谨慎,补钠的速度应缓慢,24 h血钠升高水平不超过10 mmol/L。当患者有血钠水平≤120 mmol/L和(或)低钠血症持续时间>48 h、低钾血症、饮酒、营养不良、肝病晚期等ODS高危因素时,24 h血钠升高水平推荐4~6 mmol/L、24 h不超过8 mmol/L,每4~6小时复查血钠水平[8],及时调整速度。如还存在低钾血症,则须先纠正低钾血症[9]。
ODS在临床上发生较少,后果严重。该病极易被漏诊和误诊。本文报道1例使用垂体后叶素出现低钠血症,过快纠正血钠引起ODS的病例,回顾了相关文献,以期对临床医师认识、预防和诊断该病有所帮助。
