Hippo信号通路关键蛋白YAP调控巨噬细胞极化的分子机制研究
2021-05-13曾凯王欣冉杜雪
曾凯,王欣冉,杜雪
(哈尔滨医科大学附属第一医院重症医学科,黑龙江 哈尔滨 150000)
巨噬细胞是重要的天然免疫细胞,可以发生不同水平的活化状态,形成不同的极化类型,即 M1 型极化(介导促炎和杀伤)和 M2 型极化(介导抑炎和修复),且巨噬细胞极化是其发挥免疫稳态调控功能的重要形式[1-2]。由于巨噬细胞在微环境稳态调控中发挥重要的作用,若巨噬细胞的极化失衡,可导致微环境内免疫稳态平衡被破坏,引发多种免疫相关性疾病[3-4]。因此,寻找巨噬细胞极化的调控靶点,深入探讨其调控机制,对于靶向巨噬细胞的免疫干预意义重大。Hippo通路是细胞增殖、存活、分化和维持组织稳态的有效调节通路[5-6],而YAP既是Hippo信号通路中的关键蛋白,也是一种重要的免疫调控分子[7]。目前,尚无有关YAP对巨噬细胞极化的作用和机制详细报道,本研究旨在探讨Hippo信号通路关键蛋白YAP调控巨噬细胞极化的分子机制。
1 材料与方法
1.1 材料
人单核细胞系THP-1细胞购于ATCC,RPMI 1640培养基购自上海源培生物科技股份有限公司;胎牛血清购自天津康源生物技术有限公司;佛波酯(PMA)、脂多糖(LPS)、白细胞介素-4(IL-4)购自美国Sigma公司;FITC-CD86、PE-CD206抗体购自美国BD公司;YAP表达质粒、包含无序基因片段的对照质粒及YAP、IL-1β、CCL22、β-actin的引物由大连宝生物有限公司合成;Lipofectamine 2000转染试剂盒购自美国Invitrogen公司;TRIzol试剂、逆转录试剂盒、PCR Master Mix试剂盒购自大连大连宝生物有限公司;TNF-α和TGF-β酶联免疫吸附试剂盒购自美国eBiosicence公司;兔抗人YAP抗体、兔抗人IL-1β抗体、兔抗人CCL22抗体、兔抗人GAPDH抗体购自美国Cell Signaling Technology公司。
1.2 方法
1.2.1 细胞培养 THP-1细胞在含10%胎牛血清的RPMI1640培养基中培养,培养条件为37 ℃、5% CO2饱和湿度,待细胞处于80%融合时进行传代,取对数生长期细胞用于实验。
1.2.2 M1型和M2型巨噬细胞诱导 将处于对数生长期的THP-1细胞在含200 ng/mL佛波酯(PMA)、10%胎牛血清的RPMI1640培养基中培养48 h贴壁后,弃去培养液,1×PBS洗涤3次,诱导成为M0巨噬细胞作为对照组,然后将细胞继续在含500 ng/mL脂多糖(LPS)、10%胎牛血清的RPMI1640培养基中培养24 h,诱导为M1型巨噬细胞,在含20 ng/mL 白细胞介素-4(IL-4)、10%胎牛血清的RPMI1640培养基中培养24 h,诱导为M2型巨噬细胞。
1.2.3 细胞转染 取对数生长期的M1型巨噬细胞接种于6孔板,严格按照Lipofectamine 2000转染试剂盒操作说明书将慢病毒包装的YAP表达质粒(YAP表达质粒组,上游引物序列:5’-CCTGCGTAGCCAGTTACCAA-3’、下游引物序列:5’-CCATCTCATCCACACTGTTC-3’)、慢病毒包装的无序对照质粒(对照质粒组,上游引物序列:5’-CACCAAGCGAGGACTGAGCAT-3’、下游引物序列:5’-GCCAGACCCAGAAGGAGAAGC-3’)及慢病毒空载体(空载体组)转染至靶细胞,48 h后,应用实时定量PCR法检测转染细胞中YAP表达水平,收集细胞进行后续实验。
1.2.4 流式细胞术检测 M1型和M2型巨噬细胞标志物水平 收集诱导的各组细胞,细胞密度为5×105个/mL,每管加入500 μL细胞悬液,分别加入FITC-CD86、PE-CD206抗体和同型对照抗体,经室温避光孵育30 min 后,洗涤、弃上清,加入500 μL磷酸盐缓冲液上机检测。
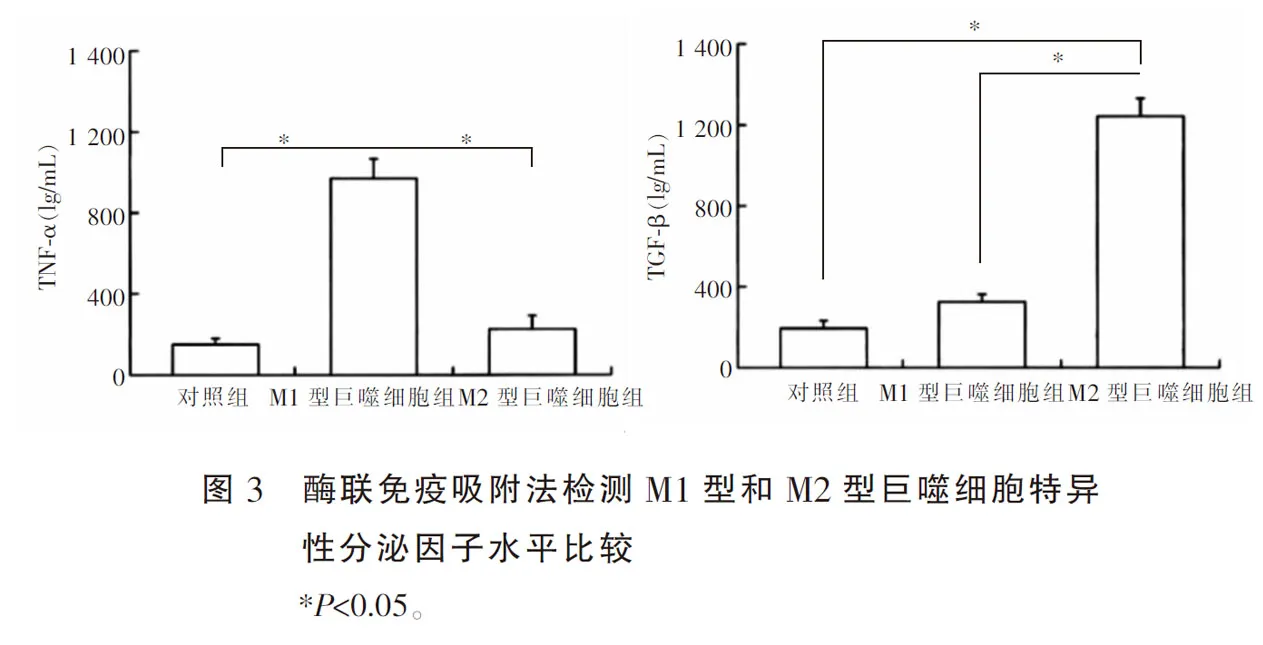
1.2.5 酶联免疫吸附法检测 M1型和M2型巨噬细胞特异性分泌因子水平 收集诱导的各组细胞培养上清液,严格按照TNF-α和TGF-β酶联免疫吸附试剂盒说明书进行操作,采用THERMO公司的BIOTEK酶标仪在450 nm处检测吸光度值,根据标准曲线(y=0.824-0.762x,r2=0.967),计算各组上清液中TNF-α和TGF-β水平。
1.2.6 实时定量PCR检测mRNA表达水平 收集各组细胞,采用TRIzol法提取细胞总mRNA,按照逆转录试剂盒操作说明书进行逆转录反应合成cDNA,产物4 ℃保存备用。使用7500型实施定量PCR检测仪进行实时PCR扩增反应,YAP mRNA上游引物序列:5’-CCTGCGTAGCCAGTTACCAA-3’、下游引物序列:5’-CCATCTCATCCACACTGTTC-3’;CCL22 mRNA上游引物序列5’AGGATGCGTGACTT
TGTG3’、下游引物序列:5’GTATCTACTATTGCGAGG
TG3’;IL-1β mRNA上游引物序列:5’-GACACATGGGATAACGAGGC-3’、下游引物序列:5’-ACGCAGGACAGGTACAGATT-3’;β-actin mRNA上游引物序列:5’-TACAACTCCTTGCAGCTCC-3’、下游引物序列:5’-ATCTTCATGAGGTAGTCAGTC-3’,以β-actin作为内参基因,最后采用2-△△CT方法计算目的基因mRNA表达水平。
1.2.7 Western blot检测蛋白表达 收集各组细胞,经超声破碎后,提取蛋白,BCA法测定蛋白浓度后,进行SDS-PAGE电泳,并湿转至硝酸纤维素膜上,奶粉封闭2 h,加入已稀释的一抗( 兔抗人YAP 抗体1∶500、兔抗人CCL22抗体1∶1 000、兔抗人IL-1β抗体1∶1 000、兔抗人β-actin抗体抗体1∶8 000),4 ℃过夜;次日,经洗涤后,加入二抗(辣根过氧化物酶标记的羊抗兔IgG1∶40 000),室温孵育2 h;经TBS-T洗涤后,使用化学发光底物试剂检测目的蛋白,并曝光X线胶片,使用mage J软件对蛋白条带进行灰度分析,以GAPDH为内参蛋白。
1.3 统计学分析

2 结果
2.1 M1型和M2型巨噬细胞诱导结果
流式细胞术检测结果显示,M1型巨噬细胞组CD86+细胞比例[(47.89±6.32)%]及M2型巨噬细胞组CD206+细胞比例[(70.2±78.93)%]高于对照组[(3.09±0.28)%,(6.56±0.43)%],差异均有统计学意义(P<0.05);酶联免疫吸附法检测结果显示,M1型巨噬细胞组培养上清液中TNF-α水平高于对照组和M2型巨噬细胞组,M2型巨噬细胞组培养上清液中TGF-β水平高于对照组和M1型巨噬细胞组,差异均有统计学意义(P<0.05),提示M1型和M2型巨噬细胞诱导成功。见图1-图3。
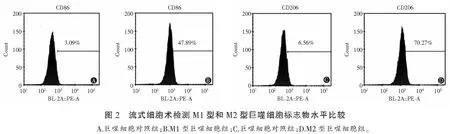
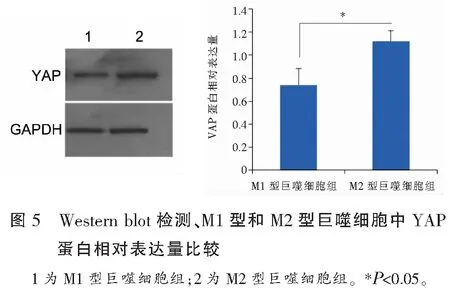
2.2 YAP在M1型和M2型巨噬细胞中的表达比较
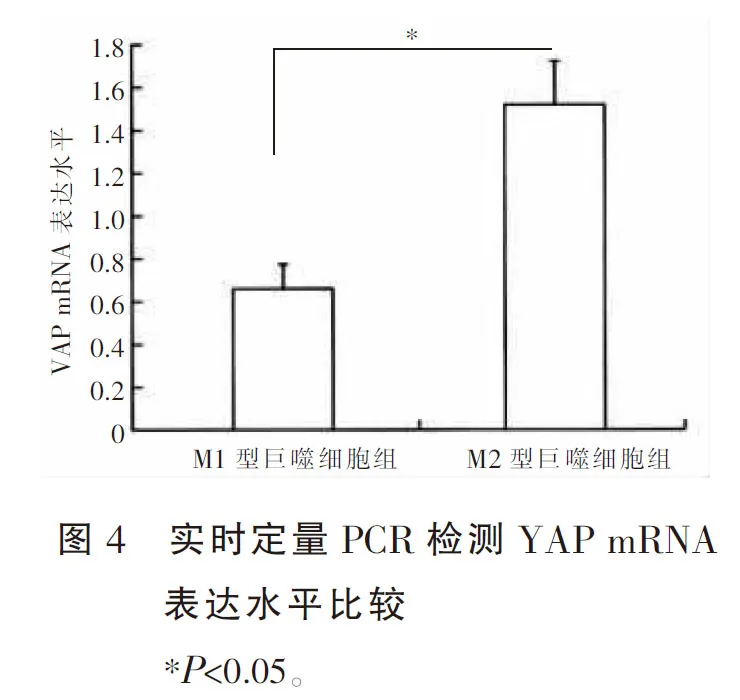
实时定量PCR检测结果显示,YAP在M1型巨噬细胞中的表达水平低于M2型巨噬细胞(P<0.05),见图4;Western blot检测结果显示,YAP在M1型巨噬细胞中的表达水平低于M2型巨噬细胞(P<0.05),提示YAP可能与M2型巨噬细胞的表型维持有关。见图5。
2.3 YAP抑制M1表型形成和促进M2表型形成比较
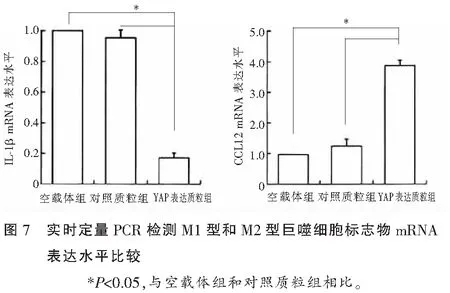
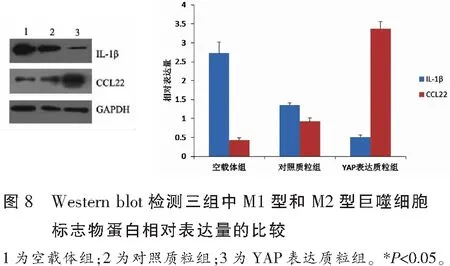
流式细胞术检测结果显示,空载体组、对照质粒组、YAP表达质粒组CD86+细胞比例分别为(46.5±17.03)%、(45.5±85.92)%、(26.4±78.02)%,空载体组、对照质粒组、YAP表达质粒组CD206+细胞比例分别为(13.27±2.46)%、(14.0±21.87)%、(53.62±10.35)%,YAP表达质粒组CD86+细胞比例低于空载体组和对照质粒组,而CD206+细胞比例高于空载体组和对照质粒组,差异均具有统计学意义(P<0.05),图6;实时定量PCR检测结果显示,与对照质粒组相比,YAP表达质粒组中,M1型巨噬细胞标志物IL-1β mRNA表达水平降低(P<0.05),M2型巨噬细胞标志物CCL22 mRNA表达水平升高(P<0.05),图7;Western blot检测结果显示,与对照质粒组相比,YAP表达质粒组中,M1型巨噬细胞标志物IL-1β 蛋白表达水平降低(P<0.05),M2型巨噬细胞标志物CCL22蛋白表达水平升高(P<0.05),提示YAP可能抑制M1型巨噬细胞的形成和促进M2表型形成,图8。

3 讨论
巨噬细胞是一种具有较强可塑性和功能异质性的免疫细胞,其可在不同刺激因素的作用下,分化成不同表型进而发挥不同的生物学作用[8]。研究[9-10]显示,在干扰素或脂多糖的刺激下,巨噬细胞可向M1型方向极化,而在白介素4或白介素3的刺激下,巨噬细胞可向M2型方向极化。M1型巨噬细胞具有杀伤病原体和抗肿瘤免疫反应的作用[11],而M2型巨噬细胞具有抑制免疫应答的能力[12]。巨噬细胞极化是巨噬细胞发挥免疫稳态调控功能的重要形式,若极化失衡,则可引起免疫稳态紊乱,导致疾病发生[13-14]。因此,寻找巨噬细胞极化的调控靶点,深入探讨其调控机制,对于靶向巨噬细胞的免疫干预意义重大。
Hippo通路是细胞增殖、存活、分化和维持组织稳态的有效调节通路[15-16]。研究[17]显示,YAP是Hippo信号通路的关键蛋白,其可作为转录共激活分子促进肿瘤细胞的增殖。另有研究[18]发现,YAP 还可诱导趋化因子2的表达,协助肿瘤细胞发生免疫逃逸。最近还有研究[19]发现,YAP 能促进肿瘤细胞释放炎症因子,同时招募肿瘤相关巨噬细胞。然而,目前有关YAP对巨噬细胞极化的作用和机制的研究极少。
本研究首先通过PMA诱导THP-1细胞成为巨噬细胞,再经脂多糖诱导为M1型巨噬细胞,经白介素-4诱导为M2型巨噬细胞,并通过流式细胞术检测了M1型巨噬细胞标志物CD86+M2型巨噬细胞标志物CD206的表达,通过酶联免疫吸附法检测M1型巨噬细胞特异性分泌因子TNF-α和M2型巨噬细胞特异性分泌因子TGF-β水平,结果提示M1型和M2型巨噬细胞模型建立成功。为了确认YAP与巨噬细胞极化的关系,本研究应用诱导成功的M1型和M2型巨噬细胞,检测YAP在不同表型巨噬细胞中的表达差异,结果发现,无论在mRNA水平还是蛋白水平,YAP在M1型巨噬细胞中的表达均低于M2型巨噬细胞,提示YAP可能与M2型巨噬细胞的表型维持有关。为了进一步确认YAP在巨噬细胞极化中的作用,本研究将YAP表达质粒转染至M1型巨噬细胞,结果发现,在M1型巨噬细胞中过表达YAP,可抑制M1型巨噬细胞标志物IL-1β mRNA和蛋白的表达水平,但同时可增加M2型巨噬细胞标志物CCL22 mRNA和蛋白的表达水平,提示YAP可能抑制M1型巨噬细胞的形成和促进M2表型形成。
综上所述,Hippo信号通路关键蛋白YAP表达高低可调控巨噬细胞极化,YAP表达升高可抑制M1型巨噬细胞的形成和促进M2表型形成。
