低盐和高盐环境下刺参选育品系生长与摄食性能研究*
2021-05-12李成林赵洪友吴姚琳琳
赵 斌 胡 炜 李成林① 赵洪友吴 鹏 韩 莎 姚琳琳 王 琦
(1. 山东省海洋生物研究院 青岛 266104;2. 莱阳市海洋渔业有限公司 烟台 265200;3. 文登市渔业技术推广站 威海 264400)
刺参(Apostichopus j aponicus)是目前国内沿海具有重要经济价值的棘皮类养殖品种,近年来,养殖区域不断拓展,取得了显著的经济、社会和生态效益(李成林等, 2019)。随着刺参产业的蓬勃发展,部分养殖业户长期累代自繁,造成苗种生长迟缓、成活率低等现象,养殖刺参种质退化日趋严重。同时,由于近年来极端天气等灾害频发,当前养殖刺参种质暴露出抗逆性差、应对环境气候突变风险能力薄弱等问题,业内亟待提升优良种质创新水平。鉴于此,国内刺参育种科研与生产单位历经多年,相继选育出具有生长速度快、疣足数量多、耐高温、抗病等优异生产性状的刺参新品种,为国内刺参产业进一步发展奠定了种质基础。
盐度是海水养殖环境中的重要生态因子,其变化对水产动物的生长和消化生理活动有显著影响(李刚等, 2011),刺参的适宜盐度一般在26~33(王吉桥等,2009; 孙秀俊等, 2012)。在刺参产业带由传统的自然分布区域向山东省黄河三角洲沿海地区拓展过程中,刺参养殖受到海区盐度偏低或不稳定的影响,本研究课题组经多年选育,培育出耐盐范围广、生长快的刺参新品系,适宜在山东、辽宁、河北和福建等更广阔区域养殖。目前,关于不同盐度环境对刺参新品系生长、摄食影响的研究报道并不多见,本研究以刺参耐盐选育品系子四代(G4)和子五代(G5)群体为研究对象,研究了其在不同盐度环境下的生长、摄食和消化生理的变化,结果可为刺参新品种培育提供基础数据,为刺参耐盐新品种的创制和应用提供参考。
1 材料与方法
1.1 实验材料
实验用刺参为山东省海洋生物研究院种质资源研究中心培育的耐盐品系子四代(G4)和子五代(G5),2017 年3 月和2019 年4 月,分别选取各代选育刺参进行实验。苗种规格分别为[G4(30.1±2.2) g 和(60.2±3.8) g],G5[(30.4±2.3) g 和(60.8±3.6) g],分别暂养在整理箱中,使其适应实验室环境(pH 为8.1~8.3,水温为16℃~18℃)。暂养期间,日投喂刺参专用配合饲料1 次,投饵量为刺参总重的3%~5%,同时,按配合饲料与海泥重量比为1∶3 的比例搭配投喂海泥。选取表观正常、肉刺完整挺直、健康无病的个体作为实验对象。
1.2 实验设计与日常管理
设置18、20、22 三个低盐处理组和35、37、39三个高盐处理组,以盐度31 的自然海水为对照组。实验开始前,用经自然曝晒的自来水与自然海水混合的方式降低盐度,每天调整2~3 个盐度单位,直至达到实验盐度,并在实验盐度条件下对刺参进行驯化养殖5 d。驯化结束后,禁食48 h,分别将20 头实验刺参放置于整理箱(80 cm×60 cm×48 cm)中,每个处理设置3 个平行组。实验期间连续充气,每天全量换水,投喂等管理同上节。实验周期为30 d。
1.3 测定方法与数据计算
1.3.1 刺参生长及摄食的测定 实验开始前1 d 停止投喂,称量刺参初始体重W0(g),实验结束后测其体重最终值Wt(g)。称重时,先将刺参取出阴干,吸干体表水分后称量。t 为实验持续的时间(d)。刺参特定生长率(Specific growth rate, SGR, %/d)采用以下公式计算:
SGR=100×(lnWt-lnW0)/t
通过测定摄食率(Feeding rate, FR, %)考察盐度对刺参摄食的影响,计算公式如下:
FR=2F/[t(Wt+W0)]×100%
W0为体重初始值(g),Wt为测定值(g),t 为实验时间(d),F 为饲料总摄入量(g)。
1.3.2 刺参消化酶活力的测定 实验结束后,将实验刺参取出并排净体腔内海水,然后沿腹部剪开,取出消化道,剔除呼吸树,用超纯水冲洗干净,在-80℃超低温冰箱中保存。实验时,取肠组织置于玻璃匀浆器中,加入10 倍体积预冷的超纯水,在冰浴条件下匀浆 20 min,在高速冷冻离心机中(0 ℃~4 ℃,1000 r/min)离心30 min,所得上清液于冰箱保存,待测。蛋白酶、淀粉酶和脂肪酶的活力分别采用钼酸铵法、比浊法和黄嘌呤氧化酶法测定。
1.3.3 数据统计 实验数据利用SPSS 22.0 软件进行单因素方差分析(One-way ANOVA)和多重比较,以P<0.05 作为差异显著水平。
2 结果
2.1 低盐和高盐环境对选育刺参生长、存活与摄食的影响
2.1.1 G4 代选育刺参生长与摄食情况 耐盐品系G4 代选育刺参在高盐环境和低盐环境中的生长摄食情况见表1。30 d 实验结束时,2 种不同规格选育刺参在低盐环境中的末体重均随着盐度的降低而下降,盐度18 实验组的选育刺参末体重均显著低于其他盐度组(P<0.05),且低于初始值,体重呈现负增长,盐度20、22 实验组与盐度31 实验组差异不显著(P>0.05)。体重SGR 与FR 最高的分别为盐度31 实验组,分别为(0.83±0.07)%/d、(3.77±0.29)%/d,初始规格30 g 左右的其他低盐实验组随盐度降低出现显著下降;初始规格60 g 左右的低盐实验组中,盐度22 与31 实验组的SGR 与FR 差异不显著,其他实验组随盐度降低出现显著下降(P<0.05)。
在高盐实验条件下,2 种不同规格选育刺参末体重随着实验盐度升高而下降,其中,盐度35、37 实验组与盐度31 实验组差异不显著(P>0.05),盐度39实验组2 种规格刺参均出现负增长。初始规格30 g左右的高盐实验组SGR 与FR 随盐度升高出现显著下降(P<0.05),盐度39 实验组的SGR 为(-0.17±0.02)%/d,FR 为(0.15±0.02)%,均为最低值;规格60 g 左右的高盐实验组SGR 与FR 呈现类似的规律。
2.1.2 G5 代选育刺参生长与摄食情况 耐盐品系
G5 代选育刺参在高盐环境和低盐环境中的生长摄食情况见表2。由表2 可知,30 d 实验中,G5 代2 种规格选育刺参在低盐环境中的生长情况与G4 代相似,末体重随着实验盐度的降低而下降,但仅盐度18 实验组显著低于其他实验组(P<0.05)。2 种规格低盐实验组SGR 与FR 随盐度降低出现显著下降(P<0.05),但盐度22 实验组中,初始体重为60 g 实验组刺参的SGR 与盐度31 组无显著差异(P>0.05)。

表1 选育G4 代刺参在低盐和高盐环境下摄食、生长情况Tab.1 Growth and feeding of G4 breeding sea cucumber in low and high salinity environments
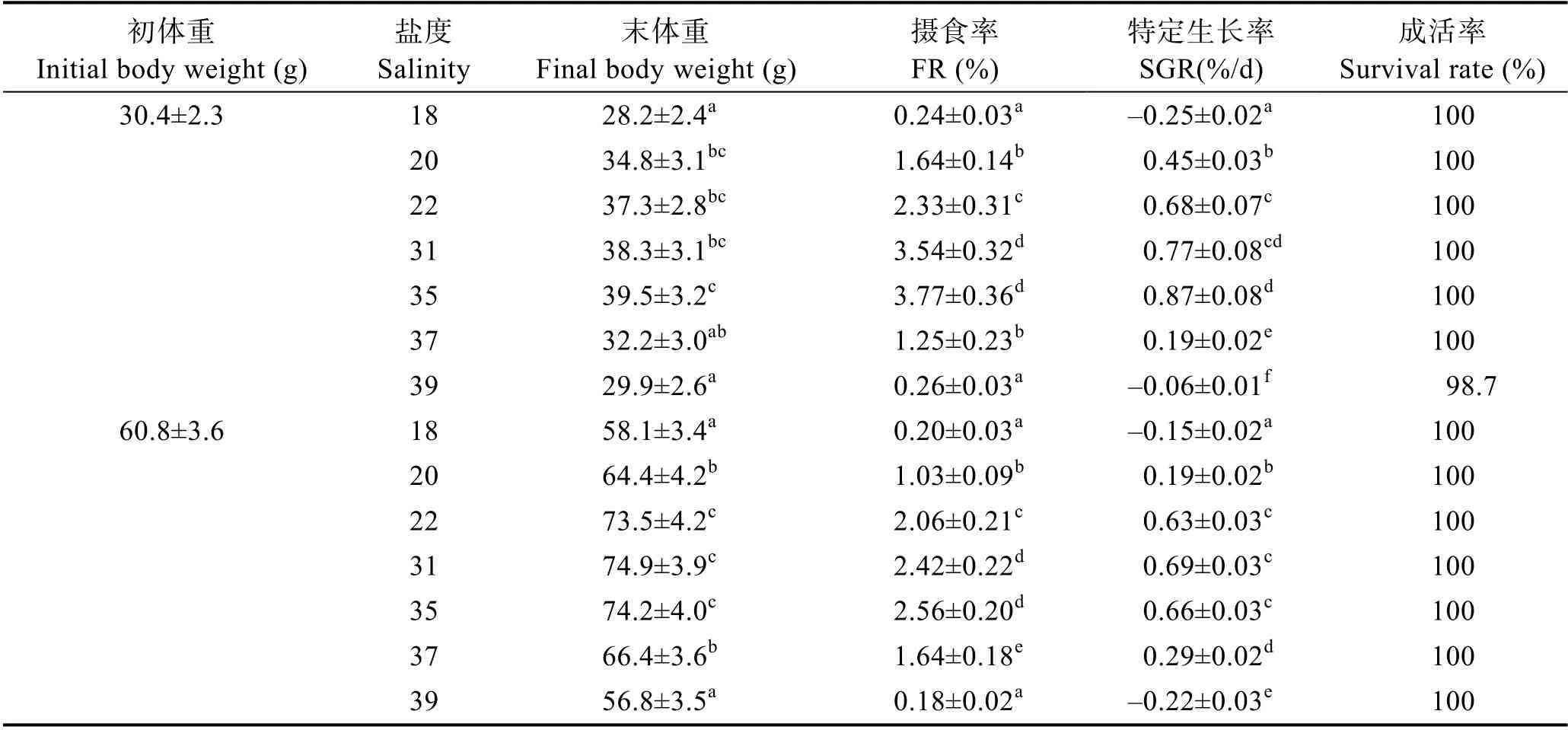
表2 选育G5 代刺参在低盐和高盐环境下摄食、生长情况Tab.2 Growth and feeding of G5 breeding sea cucumber in low and high salinity environments
在高盐环境中,2 种不同规格选育刺参末体重均随着实验盐度升高而下降,其中,初始体重30 g 实验组刺参在盐度35 时末体重最高,增至(39.5±3.2) g,但与盐度31 对照组差异不显著(P>0.05)。在2 种不同规格选育刺参高盐环境下SGR 与FR 测定结果中,盐度35 实验组与盐度31 对照组无显著差异(P>0.05),当盐度升至37 和39 时,其SGR 和FR 均随盐度升高而显著降低(P<0.05)。
2.2 低盐和高盐环境对选育刺参消化酶活力的影响
2.2.1 低盐和高盐环境中G4 和G5 代选育刺参蛋白酶活力 盐度对G4 和G5 代选育刺参蛋白酶活力的影响如图1 所示,L 为初始体重30 g 左右个体,B为初始体重60 g 左右个体。在盐度18~31 范围内,G4 和G5 代的不同规格选育刺参消化道蛋白酶活力随着设置盐度的降低而下降,最低值为G5 代盐度18小规格刺参实验组的1.55 U/mg prot;其中,盐度18和盐度20 实验组蛋白酶活力显著低于盐度22 实验组和盐度31 对照组(P<0.05),而盐度22 和盐度31 对照组之间差异不显著(P>0.05)。在盐度31~39 范围内,各实验组刺参蛋白酶活力随着设置盐度的升高呈降低趋势,但盐度35、37 实验组的蛋白酶活力与盐度31 对照组差异不显著(P>0.05),G5 代2 种规格实验刺参在盐度37 和39 的蛋白酶活力差异亦不显著(P>0.05)。
2.2.2 低盐和高盐环境中G4 和G5 代选育刺参淀粉酶活力 盐度对G4 和G5 代选育刺参淀粉酶活力的影响见图2,L 为初始体重30 g 左右个体,B 为初始体重60 g 左右个体。在盐度18~39 范围内,G4 和G5 代的不同规格选育刺参消化道淀粉酶活力随着设置盐度的变化而起伏,总体无太大差异。在G4 代实验组中,盐度37 实验组小规格刺参淀粉酶活力为0.36 U/mg prot,显著高于其他实验组(P<0.05),盐度22 与盐度37 的小规格刺参淀粉酶活力显著超过大规格刺参;在G5 代实验组中,淀粉酶活力峰值出现在盐度22 小规格实验组,最低值出现在盐度39 小规格实验组,为0.12 U/mg prot,同一盐度下2 种规格间的淀粉酶活力均无显著差异(P>0.05)。

图1 盐度环境对G4 和G5 代选育刺参蛋白酶活力的影响Fig.1 The effects of different salinity on the protease activity of G4 and G5 breeding sea cucumber

图2 盐度环境对G4 代和G5 代选育刺参淀粉酶活力的影响Fig.2 The effects of different salinity on the amylase activity of G4 and G5 breeding sea cucumber
2.2.3 低盐和高盐环境中G4 和G5 代选育刺参脂肪酶活力 盐度对G4 和G5 代选育刺参脂肪酶活力的影响见图3,L 为初始体重30 g 左右个体,B 为初始体重60 g 左右个体。在盐度18~31 范围内,G4 和G5 代的不同规格选育刺参消化道脂肪酶活力随着设置盐度的降低而下降,其中,盐度18 和盐度22 实验组脂肪酶活力显著低于盐度31 对照组(P<0.05),而盐度22 和盐度31 对照组之间差异不显著(P>0.05)。在盐度31~39 范围内,G4 和G5 代不同规格的盐度35实验组的脂肪酶活力与盐度31 对照组差异均不显著(P>0.05),盐度37 实验组脂肪酶活力值有所下降,但与对照组无显著差异(P>0.05),当盐度环境为39 时,各组实验刺参脂肪酶活力出现显著下降,最低值为G5 代盐度39 大规格刺参实验组的0.18 U/mg prot。

图3 盐度环境对G4 代和G5 代选育刺参脂肪酶活力的影响Fig.3 The effects of different salinity on the lipase activity of G4 and G5 breeding sea cucumber
3 讨论
3.1 刺参选育品系在低盐和高盐环境下的生长与摄食情况
盐度是影响水产动物生理生态学的重要环境因子,与其生长、发育关系密切(Talbot et al, 2002; Dong et al, 2008)。刺参属于典型的狭盐性棘皮动物,盐度的变化对刺参的生长、存活和繁殖等一系列生理活动均有影响(陈勇等, 2007; 郑慧等, 2014; Li et al, 2010;胡炜等, 2012; 于姗姗等, 2012)。研究表明,盐度变化存在影响刺参生长的拐点,超过拐点数值刺参生长将大幅降低,盐度低于22 时,刺参3.5 g 左右幼参出现负增长(王吉桥等, 2009),盐度36 时,规格为37.5 g的刺参特定生长率显著低于盐度 31 时(孟雷明等,2013)。本研究通过2 代不同规格刺参在低盐和高盐环境中的生长实验发现,选育刺参品系同样存在生长拐点,分别在盐度20 和盐度37 时,此条件下的选育刺参虽仍可生长,但体质量增长与特定生长率均与对照环境下出现显著差异,当盐度差异继续加剧时,便会出现负增长。在刺参人工选育品种和其他种内群体品种方面,包杰等(2015)研究发现,日本红刺参在盐度升高至38 或降低至23 时的能量代谢特征不利于其生长;朱厚祥等(2013)发现,白刺参与普通刺参幼虫阶段相同盐度耐受程度相近,在高盐度37 下成活率和生长率均较低。因此,在养殖盐度的适应性方面,本研究耐盐选育品系刺参相对普通刺参及部分无耐盐性状的选育品种有优势。
良种是产业健康发展的基础,连续多代选择可以有效纯化动植物优良性状,大多可以获得积极的选择反应,从而培育出良种(刘石林, 2015; 楼允东, 1999)。在良种缺乏和异常气候环境变化背景下,开展刺参抗逆品种的选育工作是长期以来国内刺参领域研究的热点(李成林等, 2019),特定性状的定向选育是改善刺参对恶劣环境抗逆能力的有效手段(隋凯港等,2014)。水产动物选育新品种通过审定一般至少应经过4 个世代以上,本研究所采用的G4、G5 代刺参耐盐选育品系在相同盐度环境下表现出的生长与摄食性能极为相似,表明新品系的选育性状稳定性较强,对刺参耐盐新品种的获得及其后的推广应用具有积极的意义。
3.2 刺参选育品系在低盐和高盐环境下的消化生理
消化酶活性与水产动物的营养吸收关联密切,进而影响水产动物的生长(田宏杰等, 2006)。同时,盐度对水产动物消化酶的影响已被广泛报道(黄凯等,2007; 陈品健等, 1998; 庄平等, 2008),且各类消化酶的最适盐度存在差异(孙双双等, 2009; 范超晶等,2016)。刺参虽然没有消化腺,但其消化道内具有多种重要的消化酶(唐黎等, 2007; 冯丹等, 2014)。本研究表明,低盐和高盐环境对选育刺参品系的消化酶均存在显著影响,且蛋白酶与脂肪酶活力的消长规律与个体生长与摄食呈现相关性。3 种酶活力中以蛋白酶活力最高,结果与李刚等(2011)在研究普通刺参时的结论一致。在激活消化酶活力的盐度值方面本研究结果则与已往报道不同。本研究中,蛋白酶活力最高时的盐度为31,而淀粉酶活力的2 个峰值大致在盐度22 和37。孙双双等(2009)研究得出,普通刺参淀粉酶与蛋白酶最适盐度为30,纤维素酶最适盐度为26,脂肪酶受盐度影响较小,而李刚等(2011)在研究8 g左右的幼参得出的结果则是蛋白酶活力在盐度29 时最高,淀粉酶活力在盐度32 时最高,前肠脂肪酶活力在盐度32 时最高,中肠在盐度29 时最高,均与本研究有所不同,分析原因主要是由于选育群体经历代几定向选育,对在不同盐度的生活习性方面可能与普通刺参产生了遗传差异,而这种差异在子代中保持着较高的稳定性,虽然G5 代耐盐刺参品系与G4 代的遗传进展不明显,但这种遗传稳定性表现出对更大范围盐度的适应性,从遗传改良角度上考虑更具有生产应用潜力。
