螺旋藻养殖加工和安全性研究进展
2021-05-06许洪高周琪乐鲁绯
许洪高 周琪乐 鲁绯
摘要:螺旋藻(Spirulina)是四大人工养殖微藻中产量和产值最大的微藻,在营养健康、畜牧养殖、固碳减排、环境工程等领域的作用正被越来越充分地认识和挖掘。我国的螺旋藻粉产量占全球产量的80%,市场上流通的螺旋藻产品(粉、片、胶囊等)中,90%属于膳食补充剂。本文主要立足于营养健康领域,对螺旋藻产业化养殖、加工环节的影响因素和研究进展进行综述,同时概述螺旋藻产品的营养特性和安全特性,最后对不同国家和地区的螺旋藻产品标准进行梳理,并对螺旋藻产业在营养健康领域的发展方向进行展望。可进行CO2生物转化和具有可持续发展特性的螺旋藻产业,需要在提高单位产量、养殖作业标准化的基础上,提升产品的安全性以及结合物联网技术,大力拓展新鲜螺旋藻在营养健康领域的应用。
关键词:螺旋藻;养殖;加工;营养;安全性;质量
螺旋藻(Spirulina)是低等原核生物“节旋藻”的别称,是一种碱性水体(pH值约为9.5)中天然存在的浮游光合蓝细菌,少数属于底栖型[1]。螺旋藻由单列细胞组成不分枝丝状体,藻丝体长为200~500 μm,宽为5~10 μm,呈疏松或紧密的有规则的螺旋形弯曲,在生长到一定长度(螺旋数)后通过断裂进行繁殖。1519年,西班牙科学家Hernando Cortez在墨西哥的Texcoco湖首次发现螺旋藻[2]。在南非乍得共和国,螺旋藻干燥的藻泥饼粉末有与番茄酱、胡椒拌和后浇淋在食物(米饭、豆、鱼、肉)上食用的习惯[3]。螺旋藻不仅可以应用于食品(功能食品、添加剂)、医药(天然胡萝卜素)和饲料工业,还在环境(检测、修复)、生物技术、可再生能源等领域具有广泛的应用前景。
目前,全球螺旋藻的总产量约12 000 t/年,单位产量最高达到91.0 t/(hm2·年)[2]。我国的螺旋藻养殖企业有60余家,年总产量占全球产量的80%,约9 600 t[4];养殖面积约为750 hm2[5],单位产量仅约13 t/(hm2·年),螺旋藻的养殖及管理水平还亟待提高。本文主要对螺旋藻养殖、采收、干燥过程中的影响因素,以及螺旋藻的营养特性与安全性的研究进展进行综述,旨在为螺旋藻产业及食品工业提供一个全面的信息。
1 螺旋藻养殖及影响因素
螺旋藻约有38种,人工养殖的螺旋藻主要是钝顶螺旋藻(S. platensis)和极大螺旋藻(S. maxima)2种[6-7]。在生长发育过程中,螺旋藻形态易因环境胁迫而发生改变,同时伴随着生理学、营养学、遗传学、蛋白质组学等方面的变化[8]。
1.1 螺旋藻的培养基组成
螺旋藻作为一种可人工大规模养殖的微藻,其营养成分与培养基的组成紧密相关。在实际生产中,常用的有扎鲁克(Zarrouk)培养基[1-2]、改良Zarrouk培养基[1]、Rao培养基、Oferr培养基[2],也可以使用其他简易培养基进行养殖[9]。螺旋藻传统养殖过程中的NaHCO3用量很大,一方面是提供足量的碳源,另一方面是使培养基pH值呈碱性,有利于螺旋藻的生长。在扩藻期,培养基中NaHCO3的浓度一般为8~10 g/L,正常养殖期间NaHCO3可降低到2.5~4.0 g/L。Olguín等曾于1998—2001年将海水与淡水以体积比1 ∶ 4混合并加入2%(体积分数)猪粪厌氧发酵后的上清液作为培养基养殖螺旋藻,同时在第0、3、5天向养殖池中补充2 g/L的NaHCO3,保持水体的pH值为9.5,螺旋藻在夏天的平均产量达到 14.4 g/(m2·d)(池水深为0.15 m)和 15.1 g/(m2·d)(池水深为0.20 m);养殖水体中的氨基态氮利用率为84%~96%,磷的利用率为 72%~87%[10]。
螺旋藻培养基的组成应基于养殖用水的水源品质进行,为了避免其他藻类的生长与污染,以及螺旋藻的品质,养殖用水必须达标,城市管网用水是一个便捷的选择。养殖后的水体在重复利用前需进行适当处理,其中反渗透处理的水对螺旋藻的生长影响最小,也能够保证螺旋藻品质的稳定性。
养殖批次间增补的培养基主要是硝酸钠或尿素,尿素和硝酸根离子能够供给螺旋藻足够的氮,但高浓度会致毒。螺旋藻可以在仅含硝酸根或尿素的培养液中生长,但复合使用2种氮源对螺旋藻的生长有好处。磷酸盐、Mg2+和Ca2+的添加量需要控制。K+可以适当增加,以不超过Na+浓度的5倍为宜[2],可以基于实际生长条件确定培养基组成。
藻类与陆生植物类似,可以通过光合作用固定二氧化碳(CO2),理论表明,1 hm2的微藻可以利用12.6%的太阳能产生280 t/年的干物质,相当于生物转化513 t CO2[11-12],Sydney等发现,钝顶螺旋藻(S. platensis LEB-52)的CO2生物转化能力为318.61 mg/(L·d)[13]。有机胺作为一类CO2捕集吸附剂,固碳效率高。Da Rosa等采用CO2替代Zarrouk培养基中的NaHCO3作为碳源,CO2的供给量是每天每毫升培养液中通入0.36 mL CO2,然后在光照时间内,每小时通气2 min,最终得到的钝顶螺旋藻粉(Spirulina sp. LEB 18)的蛋白质含量为60.8%,碳水化合物含量为14.4%,脂肪含量为100%[14];为了延长CO2在培养液中的保留时间,在培养液中添加0.2 mmol/L乙醇胺(Ethanolamine,简称MEA),所得螺旋藻粉的蛋白质含量为44.4%,碳水化合物含量为282%,脂肪含量为8.3%;螺旋藻产量提高31.4%。但添加乙醇胺影响了螺旋藻对氮元素的生物转化,从而螺旋藻粉中含有更多的碳水化合物。王兆印等比较乙醇胺、二乙醇胺、三乙醇胺和N-甲基-二乙醇胺对螺旋藻生长和固碳的效果,发现三乙醇胺能够显著促进螺旋藻对CO2的生物转化,增加螺旋藻的产量,提高固碳速率[15];但与da Rosa等研究结果[14]相似的是螺旋藻中多糖含量增加而蛋白質含量减少。有机胺具有一定的毒性,其用于食用螺旋藻养殖时存在安全风险。
1.2 螺旋藻养殖的影响因素
螺旋藻的生长不仅取决于培养基组成和CO2供应,还与藻种、养殖池、养殖场所处地理位置、养殖季节(温度、光照)、其他因素(pH值、虫害)等密切相关。
1.2.1 藻种 钝顶螺旋藻与极大螺旋藻的生长速率不一致,在相同培养条件下,钝顶螺旋藻比极大螺旋藻的生长速度快。螺旋藻不同藻株的光合速率和呼吸速率不同,来源于非洲乍得湖的钝顶螺旋藻和墨西哥Texcoco湖的极大螺旋藻的光合速率远大于来源于内蒙古鄂尔多斯沙区碱湖(察罕淖尔湖)的钝顶螺旋藻[16]。螺旋藻的光合速率日变化表明,螺旋藻在每日13:00时光合速率达到最大,早于或晚于这一时间点的光合速率都有所下降。螺旋藻的呼吸速率与生长速度负相关,且随温度的升高而增大。
1.2.2 养殖池 螺旋藻的养殖分为异养培养和自养培养,大规模的养殖都属于自养培养,形式包括开放养殖系统(开放池、跑道池、圆型池)、封闭养殖系统(光生物反应器)和复合系统等。Soni等从空间需求、面积/体积比、蒸发量、水分损失、CO2损失、温度、气候依赖性、过程控制、可清洁性、生物量质量、生物量密度、采收效率、采收成本、光利用率、成本最高的工序、污染控制、投资额、产量、水动力对螺旋藻的压力等指标对不同螺旋藻养殖系统进行了比较[2,17]。
开放养殖系统包括天然湖泊、濒海湖、池塘、人工池塘或者容器等,最常见的是人工开挖的狭长型大池、圆形池和跑道池。开放养殖系统的建设和操作比较简单,但存在产量相对较低、光利用率低下、蒸发损失、CO2逸散损失、占地面积大且容易污染(包括动物和其他异养生物)等缺点。
封闭养殖系统的光生反应器分为直柱型、盘式、管式、板式等多种类型,光源有自然光源,也有人工光源,便于生物量聚集,污染可以做到最小,反应系统的材质有玻璃、聚酯塑料等多种,但系统清洗以及大规模养殖还有待进一步的技术提升。
复合系统主要是让光生反应器类似于开放池以便降低运营成本,有2种类型:一种是将开放池覆盖隔断外界污染,另一种将光生反应器的管道直径尽可能扩大到类似于开放池[18],这样的复合系统综合了开放池和光生反应器的优点,从而在保证最小污染的同时,具有最大产量、最小CO2逸散损失的特点,但还需要大量的陆地面积和技术攻关。
为了提高螺旋藻的生物采收量,生物膜贴壁培养法成为研究开发的重点[19]。中国科学院青岛生物能源与过程研究所刘天中团队建立的生物膜贴壁培养技术,以CO2为碳源,螺旋藻的产量达到 38 g/(m2·d),CO2的利用率为75.1%,螺旋藻粉的蛋白质含量超过60%,但整个中试系统的建设成本达到200美元/m2,较传统开放池高出许多。以CO2为碳源进行螺旋藻养殖是提升螺旋藻养殖的环境效应,同时也是降低养殖成本的重要途径,已成为微藻养殖技术发展的趋势,但如何提高CO2的利用率,降低补碳成本需要进一步科技攻关[20]。
1.2.3 温度 温度是螺旋藻生长的重要影响因素之一,螺旋藻可以在低于45 ℃的条件下生长,温度低于17 ℃和高于38 ℃时,螺旋藻的生长会受到抑制,但不会死亡。螺旋藻的最适生长温度是29~35 ℃。温度对螺旋藻生长的影响在蛋白和碳水化合物的组成上显著,但对脂肪和γ-亚麻酸的影响不显著[21]。
1.2.4 光照 光源质量、光照度以及光照时长是影响藻类生长的重要因素[10]。在实际养殖螺旋藻时,推荐30%的阳光通量,但在养殖池水温需要快速升温的早晨除外。螺旋藻的生长仅在有光照的情况下发生,但螺旋藻需要在没有光照的间隙合成蛋白质和色素,故不推荐24 h/d的长时间光照。
Bezerra等将螺旋藻养殖过程中的光照度(光合光子通量密度)從36 μmol/(m2·s)提高到 72 μmol/(m2·s) 时,最大细胞浓度从5 200 mg/L提高到5 800 mg/L,当进一步将光照度提高到 108 μmol/(m2·s) 时,最大细胞浓度的获得时间从8 d降到6 d[22]。这说明低光照度更适合新生态藻丝体的生长,而高光照度能够缩短螺旋藻的生长周期[23]。2004年,Danesi等也得到类似的结论[24],使用尿素作为螺旋藻的氮源,光照度在2 000~5 000 lx 时,通过快速光合作用产生的ATP和NADPH能加速细胞生长,但当细胞浓度达到 5 800 mg/L 时,细胞生长由于光通量密度的饱和而停止。
1.2.5 pH值 螺旋藻养殖的最适pH值为9.0~11.0,碱性pH值既可以防止其他藻株的污染,又可以影响螺旋藻中色素和蛋白质的富集。当pH值高于11时,螺旋藻藻丝体会结块、变短,发生细胞裂解,胞内物流出,养殖池的颜色逐渐变成黄绿色,最终发生藻体死亡的结果[2]。钝顶螺旋藻的色泽、生长速率随pH值的变化有显著差异,在pH值为 8.5~9.5时,螺旋藻的生长速率随着pH值的升高而升高,但在pH值为9.5~11.0时,螺旋藻的生长速率随着pH值的升高而逐渐降低;在培养8 d时,螺旋藻的细胞干质量随着pH值的增加而降低[25]。
1.2.6 搅拌混合和通气量 螺旋藻的规模化养殖目前均采用液体悬浮法培养,养殖过程中对培养液进行周期性搅拌,以便保证营养液的均一性及螺旋藻藻丝体接受光照度的一致性。搅拌混合和通气对生产高密度的藻丝体和高质量的螺旋藻产品非常必要。搅拌混合和通气(空气)能够让培养池中的螺旋藻藻丝体具有均一的光照量,同时有助于二氧化碳气体的分布及除去螺旋藻的生长抑制因子——溶解氧。在跑道池中,多采用5~60 cm/s的搅拌混合速度,过低的搅拌混合速度将在跑道池的拐角处产生死角(将跑道池的拐角设置成弧形可规避死角的产生),而过高的搅拌混合速度需要更高的能耗,其所产生的剪切力将增加藻丝体的断裂。在无NaHCO3的Zarrouk培养液中,螺旋藻的最适参数是光照度低于200 μmol/(m2·s),含0.5%二氧化碳的通气速度是0.0056 m/s[26]。
不同实验室规模养殖下,养殖参数的变化对螺旋藻蛋白质含量的变化见表2[27]。
1.2.7 虫害 目前,在螺旋藻的养殖过程中经常出现轮虫(Brachionus Plicatilis)危害,严重时轮虫大量吞食螺旋藻而导致绝收,造成灾害性损失。防治螺旋藻培养液中的轮虫,主要有物理过滤(250目以上滤网)去除轮虫成虫法和化学防治等2种方法。化学防治是利用漂白粉、硫酸铜、高锰酸钾等强氧化剂或毒物将螺旋藻和轮虫一起杀死,然后清洗培养池重新扩种培养。物理防治的方法过滤不彻底,部分成虫、幼虫和几乎全部虫卵随着滤液返回培养池,需要再次过滤,且随着过滤次数的增加,产生危害间隔的天数越来越少。化学防治虽然能较长时间控制危害,但由于一次性的将螺旋藻也杀死,造成一定的经济损失,同时重新扩种又浪费了时间和资金,导致生产成本增加。另外,阿维菌素与尿素的交替使用可以降低轮虫的抗药性[28-29]。
螺旋藻养殖过程中还可遇见点滴变形虫、半眉虫、原生动物和水蝇等虫害。用40目以上滤网可以除去/减少藻泥中水蝇(幼虫和蛹)的数量和其他杂质,降低藻粉中昆虫碎片的数量[30]。
2 螺旋藻的采收和干燥
2.1 螺旋藻的采收
理论而言,螺旋藻的采收需选择在藻丝体中的蛋白质达到最高浓度时进行,但在实际操作过程中,一般对含螺旋藻的养殖水体进行吸光度测定,当560 nm波长下的吸光度>1.0时,便着手采收[31],也有选用680 nm波长下的吸光度>0.8时采收的报道[32]。
螺旋藻采收一般经历三大步骤,即螺旋藻藻丝体(藻细胞)采集分离、螺旋藻聚集物(即藻泥)清洗、螺旋藻干燥。螺旋藻藻丝体(藻细胞)采集所用的技术包括过滤法、絮凝沉淀法、离心沉淀法等,清洗工序包括漂洗、离子交换、电渗析、超声波清洗等,干燥包括自然晒干、冷冻干燥、喷雾干燥、滚筒干燥和炒干等。改进螺旋藻藻丝体的采集方法、提高采集效率、降低生产成本仍是业界努力的方向。
螺旋藻采收时使用的过滤网或滤布的网孔密度一般低于50 μm,以便将螺旋藻藻丝体从培养液基质中有效分离出来。常用的过滤筛有倾斜筛和震动筛2种,倾斜筛的筛网面积为2~4 m2,筛网孔径为380~500目,能够过滤10~18 m3/h的螺旋藻培养液[33]。在相同采收效率的前提下,震动筛需要的筛网面积约为固定倾斜筛筛网面积的1/3,但震动筛并不适用于大规模采收,震动导致的螺旋藻藻丝体变形和断裂反而降低了螺旋藻的产率。尽管新鲜的螺旋藻能够被直接消费,但鲜螺旋藻不宜久存,可食用的保质期仅为6 h[2],干燥后的螺旋藻粉可以储存1年以上。
利用Ca2+的絮凝作用能够将螺旋藻快速絮凝沉淀,但絮凝剂用量大,絮凝藻体的盐含量大,后续处理困难。而传统过滤也存在效率过低,损失严重等缺陷,需要进行改进。Lai等使用壳聚糖和鸡蛋壳作为生物絮凝剂对螺旋藻进行采收时发现,325目的鸡蛋壳粉溶于盐酸溶液后,在4 g/L、pH值为4的条件下絮凝8 min,最高效率达到97.2%,而壳聚糖溶于盐酸后,在50 mg/L、pH值为8的条件下絮凝50 min,最高效率达到80%[34]。尽管鸡蛋壳的得率较高,但从营养液的重复利用方面考虑,壳聚糖絮凝剂更贴近于实际生产。
2.2 螺旋藻的干燥
Nouri等对比研究了自然干燥、阴干、微波干燥、冷冻干燥、真空干燥、传统热风干燥等对螺旋藻理化成分和抗氧化性的影响[35]。真空干燥有助于螺旋藻粉抗氧化活性和总酚物质的保留,喷雾干燥和冷冻干燥有助于保留螺旋藻中的不饱和脂肪酸,而冷冻干燥对钠、钾、镁、锰、钙、磷的流失比较显著,其他干燥方式对金属元素的影响不显著。
使用φ=80 μm孔径的支撑物有助于螺旋藻的快速干燥(热风对流干燥),规格为80 mm×80 mm ×3 mm的螺旋藻藻泥餅的干燥时间可降低30%,挤压的螺旋藻藻泥条(φ=3 mm×120 mm)间隔10、20 mm,可降低干燥时间35%[36]。
企业总是试图在干燥工序成本可控的前提下,减少螺旋藻营养成分的损失并得到最大纯度的产品。由于螺旋藻的细胞壁特别薄且易碎,自然晒干作为最原始、最传统的干燥方式曾被广为使用,但自然晒干必须非常快速,否则叶绿素被破坏,干燥的产品变成蓝色。尽管冷冻干燥被认为是最适合螺旋藻干燥的方式,但高昂的成本和复杂的工序,使其应用相对较低。喷雾干燥是实际生产中最常用的螺旋藻干燥方式。不同螺旋藻干燥工艺对螺旋藻营养成分的损失程度见表3。
3 螺旋藻的营养及安全
3.1 螺旋藻的营养
螺旋藻的营养价值很高,蛋白质含量占干质量的60%~70%,且富含植物中不常见的维生素B12和铁元素, 其中维生素B12含量是肝脏中维生素B12含量的2~4倍,铁元素浓度是常见植物铁元素的 8~12倍。螺旋藻还含有抗肿瘤作用的藻蓝素,被宣称为未来的最佳食品[45],2003年,联合国成立了一个“联合国利用微藻类螺旋藻抗击营养不良政府间机构”(the Intergovernmental Institution for the Use of Micro-algae Spirulina Against Malnutrition,简称IIMSAM)以便在发展中国家推动开发螺旋藻用于消除饥饿和营养不良[2]。
不同企业的螺旋藻产品各功能成分含量并不一致,这种差异不仅与藻种相关,也因温度、pH值、培养基、光照等养殖条件的不一致而存在差异。以蛋白质为例,螺旋藻的蛋白质含量在17%~73%(干质量)之间变动[30],部分市售螺旋藻产品的氨基酸组成如表4所示[33,46-48]。
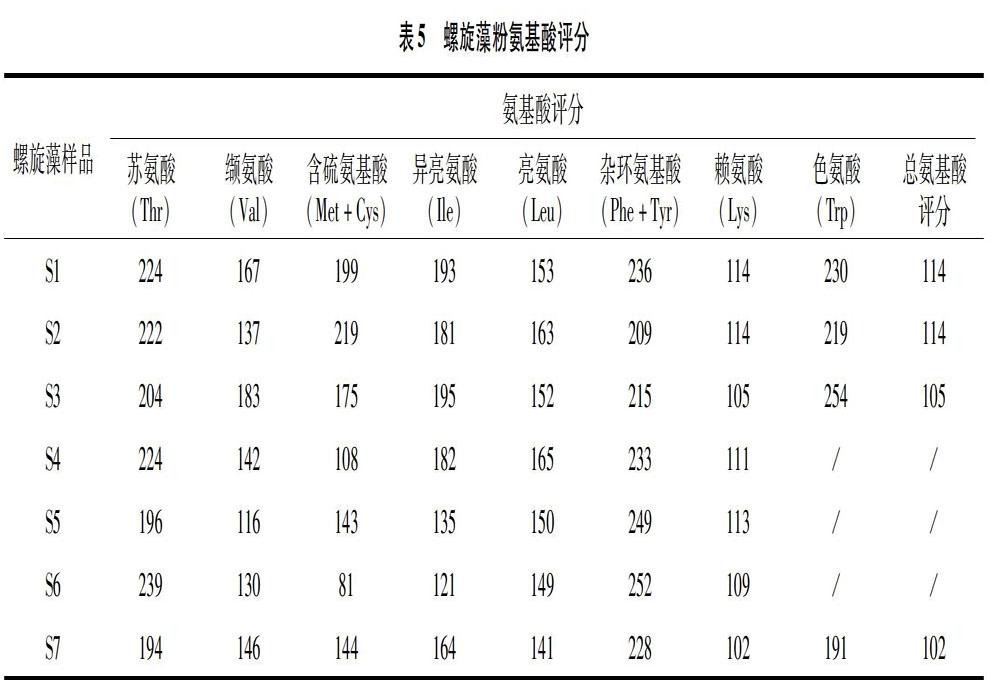
氨基酸评分法是蛋白质质量评价中广泛采用的方法之一。基于成人的必需氨基酸需求[50],不同螺旋藻样品的必需氨基酸评分见表5。由表5可知,螺旋藻蛋白与谷物蛋白类似,限制性氨基酸均为赖氨酸,但不同产地、品牌螺旋藻产品的氨基酸评分均大于100,所以螺旋藻是一个优质蛋白,满足人体所有必需氨基酸的需求, 因此螺旋藻的消化率成为螺旋藻氨基酸评分的第一限制因素[50],从而螺旋藻的消化率修正氨基酸评分等于螺旋藻的消化率。
螺旋藻的细胞壁类似于革兰氏阴性菌的肽聚糖细胞壁,非常易于消化。据报道,螺旋藻的平均体外消化吸收率为61%[51],其蛋白质的消化吸收率为70%~85%[52],螺旋藻细胞壁多糖的生物利用度达到86%[53]。但不同研究者采用的消化吸收测试方法不一致,数据间的可比较性相对较差。不可忽视的是,加工工艺可以改变螺旋藻的体外消化吸收率[54],滚筒干燥与自然晒干的螺旋藻的体外消化吸收率分别为84%、76%。
3.2 螺旋藻的安全性
同大多数微藻一样,螺旋藻可以吸附培养液中的农药残留滴滴涕(DDT)[55],重金属(Cr3+、Cd2+、Cu2+、Zn2+、As、Hg等)[56-59],石油烷烃[60]和雌激素(17α-乙炔基雌二醇、17β-雌二醇)[61]等,因而螺旋藻也被认为是用于污水处理的热点材料[62]。在食用螺旋藻生产中,其不安全因素主要集中于养殖过程的重金属(铅、砷等)、生物毒素等的污染影响,还包括干燥加工过程的热源污染(如多环芳烃), 硝酸盐/亚硝酸盐、亚硫酸盐残留和辐照剂量残留等污染。
3.2.1 重金属 目前我国南方企业生产的螺旋藻粉普遍存在铅含量超标的问题,而北方(主要是内蒙古自治区)企业生产的螺旋藻粉存在砷含量偏高的现象。在2012年,曾因为程海湖污染(铅超标)媒体对我国螺旋藻养殖业、螺旋藻产品进行了长篇累牍地报道,对螺旋藻品质产生了怀疑。螺旋藻产品中的重金属组成及含量与养殖水体紧密相关,也与养殖过程中培养基(碳酸钠或碳酸氢钠等原料)中的重金属残留有关。GB 2762—2017《食品安全国家标准 食品中污染物限量》中规定螺旋藻及其制品中的铅含量上限为2.0 mg/kg(干质量计)。欧盟对膳食补充剂中的铅残留设定为3.0 mg/kg,但有报道说螺旋藻中的铅残留在0.1~15.0 mg/kg之间变化[63-64]。赵楠发现,国内螺旋藻原粉中的铅残留为0.03~1.71 mg/kg,但笔者团队对部分市售螺旋藻粉样品的检测发现,有个别样品的铅含量超过2.0 mg/kg。铅残留仍是螺旋藻养殖过程中亟待解决的问题之一[65]。
砷是一种准金属物质,以各种形态分布于土壤、石头、河流等环境中,在组成地壳的92种元素中,含量排名为第20位。天然砷矿在自然风化及雨水冲刷等活动过程中进入水体,常以亚砷酸盐和砷酸盐的形态存在。砷可分为有机砷与无机砷2种,无机砷又分为砷元素、三价砷和五价砷3种形式,其中三价砷的毒性最高,而有机砷对人体的毒性较小。水产品中常见的砷酸甜菜碱和砷酸胆碱等有机砷化合物对人体没有毒性,且容易排出体外。螺旋藻具有富集砷的特性,当螺旋藻养殖水体中的砷浓度达到0.04 mg/L时,乍得湖钝顶螺旋藻藻粉中的砷含量超过1.0 mg/kg[66]。我国螺旋藻原粉中的砷残留为0.01~0.41 mg/kg[65],但笔者团队对部分市售螺旋藻藻粉样品的检测发现,很多样品的砷含量超过固体营养补充食品的砷残留限量标准(0.5 mg/kg,GB 2762—2017《食品安全国家标准 食品中污染物限量》),但无机砷均小于0.02 mg/kg。建议我国GB/T 16919—1997《食用螺旋藻粉》和NY/T 1709—2011《绿色食品 藻类及其制品》在后续修订时,将有关砷的指标明确为无机砷。
铅具有神经毒性,铅暴露会损伤儿童发育期的学习记忆。铅镉联合暴露的神经毒性较铅镉单独暴露的神经毒性强[67],欧盟对膳食补充剂中的镉残留限量设定为1.0 mg/kg。Muys等曾发现,螺旋藻中的镉残留为0.01~0.17 mg/kg,我国螺旋藻粉的镉残留为0.003~0.123 mg/kg,所有报道数据均在镉残留方面比较理想[27]。欧盟对膳食补充剂中的汞残留设定为0.1 mg/kg;未对镍残留作出限定,Muys等发现,螺旋藻样品中的汞残留为0.02~0.11 mg/kg,镍残留为1.1~3.4 mg/kg[27]。
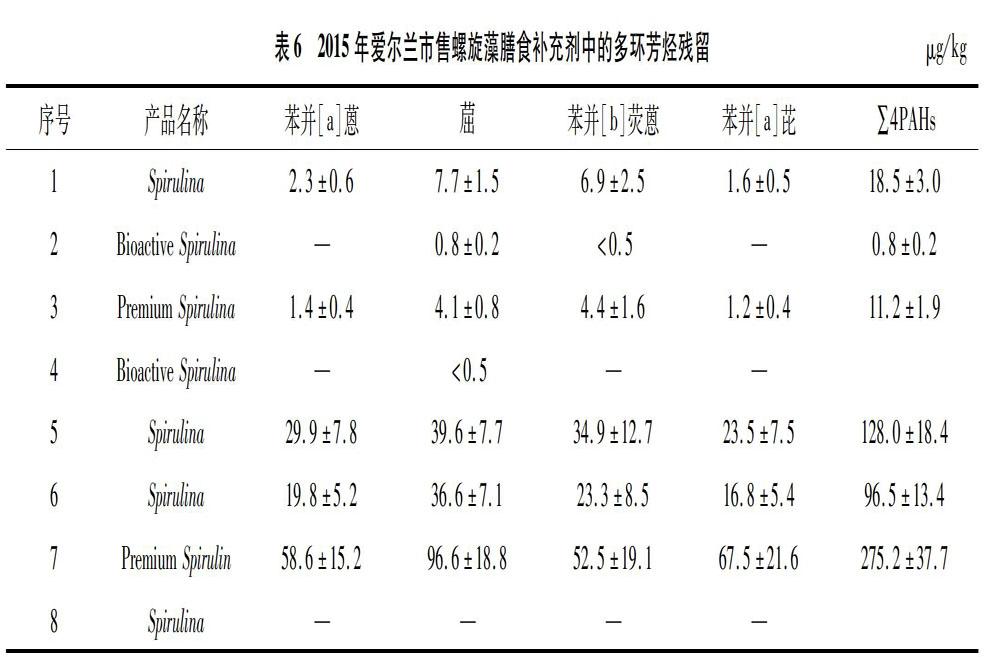
3.2.2 多环芳烃 多环芳烃来源于天然和人类生产活动,最主要来源是有机物的不完全燃烧。螺旋藻在干燥工序方面,根据热源(煤、有机质、天然气)、加热方式(直接接触、非直接接触)和加热温度的不同,可能存在多环芳烃的污染。2015年10月27日,欧盟(EU)2015/1933对(EU)No 1881/2006食品中多环芳烃的限值进行增补。欧盟对含有螺旋藻及其制品的膳食补充剂中多环芳烃的残留标准是苯并[a]芘≤10 μg/kg;苯并[a]蒽(BaA)、(CHR)、苯并[b]荧蒽(BbF)和苯并[a]芘(BaP)等4种多环芳烃之和为≤50 μg/kg[68]。我国暂时尚未对螺旋藻及其制品中的多环芳烃残留进行规定。Zelinkova等曾对爱尔兰市售螺旋藻膳食补充剂的多环芳烃殘留进行检测[69],结果见表6。总体而言,当苯并[a]芘超标时,4种多环芳烃之和也超标。
3.2.3 其他安全因素 Muys等检测螺旋藻样品中的硝酸盐浓度在8~368 mg/kg之间,尽管这些数据对原料总氮的贡献有限,过高的硝酸盐残留可能是由于养殖过程中使用硝酸盐作为氮源引起的[27];在螺旋藻后续加工清洗充分的前提下,亚硝酸盐的高低反映了加工过程中原料腐败变质的程度。果蔬汁标准中,亚硝酸盐的残留控制标准是4 mg/kg,而硝酸盐的日允许摄入量(allowable daily intake,简称ADI)是3.7 mg/kg体质量。
食品行业所说的亚硫酸盐包括二氧化硫、亚硫酸氢钠、亚硫酸钠、低亚硫酸钠、焦亚硫酸钠、焦亚硫酸钾等在内的一系列物质。由于食物原料的腐败发酵能够产生亚硫酸盐,且有报道说亚硫酸盐具有生殖毒性[70]且能引发哮喘的过敏反应[71],所以部分国家对螺旋藻中的亚硫酸盐进行严格控制以便溯源螺旋藻加工过程中螺旋藻原料的腐败变质情况。欧盟和美国均要求食品中二氧化硫和亚硫酸盐(以SO2计)大于10 mg/kg时需要标注。2019年8月6日,德国对我国台湾一批次的食品补充剂因含未申报的过敏原——亚硫酸盐(22 mg/kg)而通报不合格。
螺旋藻中報道较多的藻毒素主要为微囊藻毒素(mycrocystins,简称MC),MC作为蓝藻毒素的一种,是目前暴露频率最高、污染范围最广、危害最为严重的肝毒性藻毒素[72],具有致畸、致癌、致突变的“三致”作用,也是目前发现的最强肝脏肿瘤促进剂。MC具有约100种结构变体,其中被列为2B类致癌物的微囊藻毒素LR(MC-LR)的毒性最大[73]。2002年,徐海滨等对市售的19种71份螺旋藻产品进行微囊藻毒素的检测时发现,平均污染水平为317.2 ng/g,其中锭片和胶囊中微囊藻毒素污染的平均水平分别为142.7、222.6 ng/g[74]。而在2001年Draisci等报道了从罗马供应商处收集的5个不同品牌的螺旋藻片和胶囊样品,有3个样品不仅含有高达10 μg/g的二氢同型鱼腥藻毒素-a(dyhydrohomoanatoxin-a)——一种神经毒素,其中2个还含有环氧鱼腥藻毒素-a异构体(含量分别为18、19 μg/g)[75]。
2018年11月28日,日本厚生劳动省发布药生食输发1128第3号文:修订辐射照射食品检测方法附录Ⅱ、Ⅲ、Ⅳ-ⅶ,分别涉及畜牧及渔业产品、农产品等,同时增加附录“Ⅳ-ⅶ 放射线照射”,追加对螺旋藻的辐照检查,检查件数为10件[76]。
3.3 螺旋藻标准
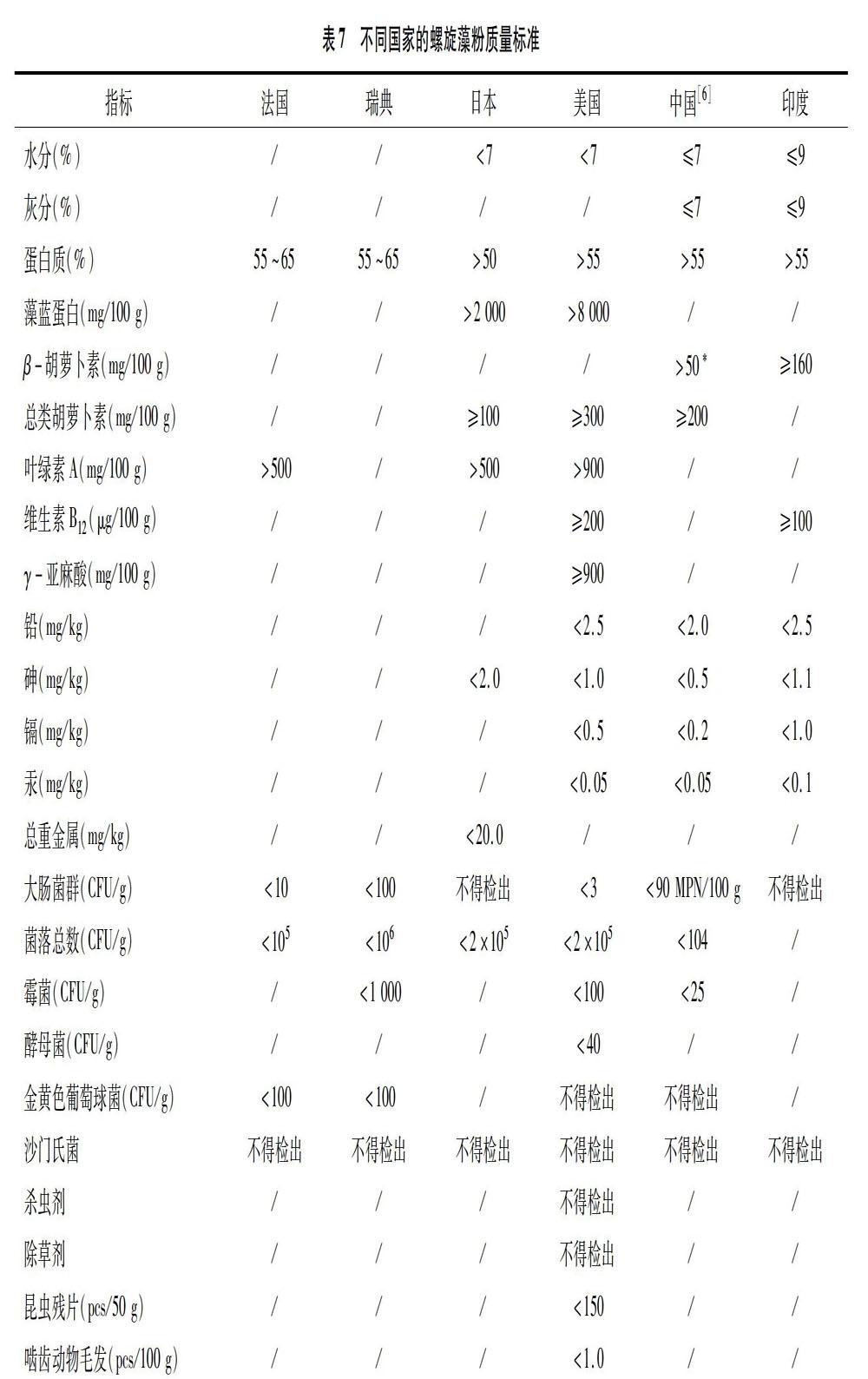
螺旋藻粉在不同国家和地区的质量标准见表7[65,77]。
由表7可知,螺旋藻的质量标准更多地关注了产品本身的质量和微生物安全,对可能存在的生物污染和化学污染尚未列为控制标准。但基于90%以上的螺旋藻均是作为膳食补充剂为人类消费,需要对可能存在的影响螺旋藻产品安全性的因素,特别是养殖用水可能存在的污染指标进行监控。
4 结论与讨论
螺旋藻是一种优质的微生物蛋白源,其产业链由养殖、初加工(藻粉)、深加工(藻片、螺旋藻提取物和其他成品)、成品应用4个环节组成。本文对螺旋藻产业链上游的养殖、采收、初加工等环节进行了总结。螺旋藻养殖和加工过程对生产要求极其严格,螺旋藻的养殖受外界环境影响较大,适宜养殖的水质必须高碱、高温、高光照,养殖过程需防止其他藻类或者微生物的污染。螺旋藻的采收和粗加工需要经过抽水、冲洗、过滤、干燥等工序,干燥的及时与否将严重影响螺旋藻粉的质量。养殖用水的污染使我国螺旋藻产业链上游面临挑战,产品质量标准(重金属等)需要进一步提升。业界需要从水源、生产原料、藻种培养、规模化养殖、采收、干燥、加工、包装以及养殖废水处理等方面制定一个操作或加工指南。螺旋藻的生产成本仍满足不了市场的需求,还需要通过技术创新和规模化养殖进行破解;减少生产加工过程中的营养成分损失或者结合快速发展的物联网产业,实现生鲜宅配是螺旋藻产业链发展延伸的另一方向。
参考文献:
[1]王志忠. 鄂尔多斯高原碱湖钝顶螺旋藻生产加工关键因子研究[D]. 呼和浩特:内蒙古农业大学,2015.
[2]Soni R A,Sudhakar K,Rana R S. Spirulina-from growth to nutritional product:a review[J]. Trends in Food Science and Technology,2017,69:157-171.
[3]Henrikson R. Earth food Spirulina[M]. 6th ed. Hawaii:Ronore Enterprises,Inc.,2009:18.
[4]Chen J,Wang Y,Benemann J R,et al. Microalgal industry in China:challenges and prospects[J]. Journal of Applied Phycology,2016,28(2):715-725.
[5]张学成,薛命雄. 我国螺旋藻产业的现状和发展潜力[J]. 生物产业技术,2012(2):47-53.
[6]卫生部. 中华人民共和国卫生部公告2004年第17号[J]. 中国食品卫生杂志,2004,16(6):570.
[7]国家技术监督局.食用螺旋藻粉:GB/T 16919—1997[S]. 北京:中国标准出版社,1997.
[8]王福双,董世瑞,王素英. 螺旋藻形态建成研究进展[J]. 生物技术通报,2016,32(8):28-33.
[9]乔 辰,栗淑媛. 鄂尔多斯高原碱湖螺旋藻[M]. 北京:科学出版社, 2013(3):332-337.
[10]Olguín E J,Galicia S,Mercado G,et al. Annual productivity of Spirulina(Arthrospira) and nutrient removal in a pig wastewater recycling process under tropical conditions[J]. Journal of Applied Phycology,2003,15(2/3):249-257.
[11]Bilanovic D,Andargatchew A,Kroeger T,et al. Freshwater and marine microalgae sequestering of CO2 at different C and N concentrations-response surface methodology analysis[J]. Energy Conversion and Management,2009,50(2):262-267.
[12]Ceullar-Bermudez S P,Garcia-Perez J S,Rittmann B E,et al. Photosynthetic bioenergy utilizing CO2:an approach on flue gases utilization for third generation biofuels[J]. Journal of Cleaner Production,2015,98:53-65.
[13]Sydney E B,Sturm W,de Carvalho J C,et al. Potential carbon dioxide fixation by industrially important microalgae[J]. Bioresource Technology,2010,101(15):5892-5896.
[14]da Rosa G M,Moraes L,Cardias B B,et al. Chemical absorption and CO2 biofixation via the cultivation of Spirulina in semicontinuous mode with nutrient recycle[J]. Bioresource Technology,2015,192:321-327.
[15]王兆印,李一锋,张 旭,等. 有机胺对螺旋藻生长及固碳效果的影响[J]. 高校化学工程学报,2017,31(2):377-386.
[16]刘 华. 螺旋藻光合生理的比较研究[D]. 呼和浩特:内蒙古农业大学, 2002.
[17]Pires J C M,Alvim-Ferraz M C M,Martins F G,et al. Carbon dioxide capture from flue gases using microalgae:engineering aspects and biorefinery concept[J]. Renewable and Sustainable Energy Reviews,2012,16(5):3043-3053.
[18]Zittelli G C,Biondi N,Rodolfi L,et al. Photobioreactors for mass production of microalgae[M]//Handbook of microalgal culture:applied phycology and biotechnology. Oxford:Blackwell Publishing,2013:225-266.
[19]张兰兰. 螺旋藻(Spirulina platensis)和紫球藻(Porphyridium cruentum)贴壁培养与工艺条件优化[D]. 青岛:中国海洋大学,2015.
[20]Wang J F,Cheng W T,Liu W,et al. Field study on attached cultivation of Arthrospira(Spirulina) with carbon dioxide as carbon source[J]. Bioresource Technology,2019,283:270-276.
[21]de Oliveira M A C L,Monteiro M P C,Robbs P G,et al. Growth and chemical composition of Spirulina maxima and Spirulina platensis biomass at different temperatures[J]. Aquaculture International,1999,7(4):261-275.
[22]Bezerra R P,Montoya E Y O,Sato S,et al. Effects of light intensity and dilution rate on the semicontinuous cultivation of Arthrospira(Spirulina) platensis. akinetic Monod-type approach[J]. Bioresource Technology,2011,102(3):3215-3219.
[23]尤 珊,鄭必胜,郭祀远. 光照对螺旋藻形态及胞外多糖的影响和机理[J]. 海湖盐与化工,2003,33(1):23-26.
[24]Danesi E D G,Rangel-Yagui C O,Carvalho J C M,et al. Effect of reducing the light intensity on the growth and production of chlorophyll by Spirulina platensis[J]. Biomass and Bioenergy,2004,26(4):329-335.
[25]马成浩,于丽娟,彭奇均. pH值对钝顶螺旋藻生长的影响[J]. 中国食品添加剂,2004(4):69-71,68.
[26]Zhang L L,Chen L,Wang J F,et al. Attached cultivation for improving the biomass productivity of Spirulina platensis[J]. Bioresource Technology,2015,181:136-142.
[27]Muys M,Sui Y,Schwaiger B,et al. High variability in nutritional value and safety of commercially available Chlorella and Spirulina biomass indicates the need for smart production strategies[J]. Bioresource Technology,2019,275:247-257.
[28]張克勤,陈玉梅. 螺旋藻(Spirulina)培养液中轮虫的防治方法[J]. 水产科学情报,2008,35(1):18-20.
[29]赵素芬,黄益叁,官武林. 药物杀除极大螺旋藻培养液中轮虫的初步研究[J]. 福建水产,2007,31(5):1-3,16.
[30]冯伟民,汪 廷,方光如,等. 螺旋藻养殖中害虫防治[J]. 植物保护,1999,25(6):48-49.
[31]薛祥武. 螺旋藻高产养殖技术[J]. 福建水产,2004(4):59-60.
[32]Güroy B,Karadal O,Manto gˇlu S,et al. Effect of different drying methods on C-phycocyanin content of Spirulina platensis powder[J]. Ege Journal of Fisheries and Aquatic Sciences,2017,34(2):129-132.
[33]杨卫杰. 螺旋藻肠内营养制剂干预Ⅱ型糖尿病实验动物代谢特性的研究[D]. 上海:上海海洋大学,2018.
[34]Lai Y H,Azmi F H M,Fatehah N A,et al. Efficiency of chitosan and eggshell on harvesting of Spirulina sp. in a bioflocculation process[J]. Malaysian Journal of Microbiology,2019,15(3):188-194.
[35]Nouri E,Abbasi H. Effect of different processing methods on phytochemical compounds and antioxidant activity of Spirulina platensis[J]. Applied Food Biotechnology,2018,5(4):221-232.
[36]Ghnimi T,Hassini L,Bagane M. Intensification of the convective drying process of Arthrospira(Spirulina) platensis by capillary draining:effect of the draining support[J]. Journal of Applied Phycology,2019,31:2921-2931.
[37]Desmorieux H,Hernandez F. Biochemical and physical criteria of Spirulina after different drying processes[C]// Proceedings of the 14th International Drying Symposium(IDS 2004),Sào Paulo,August 22-25,2004:900-907.
[38]Larrosa A P Q,Comitre A A,Vaz L B,et al. Influence of air temperature on physical characteristics and bioactive compounds in vacuum drying of Arthrospira Spirulina[J]. Journal of Food Process Engineering,2017,40:e12359.
[39]Papadaki S,Kyriakopoulou K,Stramarkou M,et al. Environmental assessment of industrially applied drying technologies for the treatment of Spirulina platensis[J]. IOSR Journal of Environmental Science,Toxicology and Food Technology,2017,11:41-46.
[40]Oliveira E G,Duarte J H,Moraes K,et al. Optimisation of Spirulina platensis convective drying:evaluation of phycocyanin loss and lipid oxidation[J]. International Journal of Food Science & Technology,2010,45(8):1572-1578.
[41]Oliveira E G,Rosa G S,Moraes M A,et al. Phycocyanin content of Spirulina platensis dried in spouted bed and thin layer[J]. Journal of Food Process Engineering,2008,31(1):34-50.
[42]Sarada R,Pillai M G,Ravishankar G A. Phycocyanin from Spirulina sp.:influence of processing of biomass on phycocyanin yield,analysis of efficacy of extraction methods and stability studies on phycocyanin[J]. Process Biochemistry,1999,34(8):795-801.
[43]Agustini T W,Suzery M,Sutrisnanto D,et al. Comparative study of bioactive substances extracted from fresh and dried Spirulina sp.[J]. Procedia Environmental Sciences,2015,23:282-289.
[44]Seshadri C V,Uuesh B V,Manoharan R. Beta-carotene studies in Spirulina[J]. Bioresource Technology,1991,38(2/3):111-113.
[45]Pulz M O,Gross W. Valuable products from biotechnology of microalgae[J]. Applied Microbiology Biotechnology,2004,65(6):635-648.
[46]包國良,王 茵. 螺旋藻中氨基酸含量水平测定及其营养保健价值[J]. 中国卫生检验杂志,2012,22(7):1571-1572,1575.
[47]王大志,朱友芳,李少菁,等. 七种微藻蛋白质含量和氨基酸组成的比较[J]. 台湾海峡,1999,18(3):297-302.
[48]肖 涵,申 亮,缪德仁,等. 滇产螺旋藻片营养组成评估[J]. 中国卫生检验杂志, 2014,24(5):664-667.
[49]Bashir S,Sharif M K,Butt M S,et al. Functional properties and amino acid profile of Spirulina platensis protein isolates[J]. Pakistan Journal of Scientific and Industrial Research Series B:Biological Sciences,2016,59(1):12-19.
[50]WHO Technical Report Series 935,Protein and amino acid requirements in human nutrition:report of a joint WHO/FAO/UNU expert consultation[R]. Geneva:World Health Organization Press,2007:113.
[51]Tibbetts S M,Milley J E,Lall S P. Chemical composition and nutritional properties of freshwater and marine microalgal biomass cultured in photobioreactors[J]. Journal of Applied Phycology,2015,27(3):1109-1119.
[52]Devi M A,Subbulakshmí G,Devi K M,et al. Studies on the proteins of mass-cultivated,blue-green-alga(Spirulina platensis)[J]. Journal of Agricultural and Food Chemistry,1981,29(3):522-525.
[53]Sjors V I,Alessandro F. Algae based biofuels,applications and coproducts[C]// Environment and natural resources management working paper. Environment climate change. Bioenergy monitoring and assessment. 2010.
[54]Becker E W. Micro-algae as a source of protein[J]. Biotechnology Advances,2007,25(2):207-210.
[55]Kurashvili M,Varazi T,Khatisashvili G,et al. Blue-green alga Spirulina as a tool against water pollution by 1,1′-(2,2,2-trichloroethane-1,1-diyl)bis(4-chlorobenzene)(DDT)[J]. Annals of Agrarian Science,2018,16(4):405-409.
[56]Rangsayatorn N,Upatham E S,Kruatrachue M,et al. Phytoremediation potential of Spirulina(Arthrospira) platensis:biosorption and toxicity studies of cadmium[J]. Environmental Pollution,2002,119(1):45-53.
[57]Chojnacka K,Chojnacki A,Górecka H. Biosorption of Cr3+,Cd2+ and Cu2+ ions by blue-green algae Spirulina sp.:kinetics,equilibrium and the mechanism of the process[J]. Chemosphere,2005,59:75-84.
[58]Ahmad A,Ghufran R,Wahid Z A. Cd,As,Cu,and Zn transfer through dry to rehydrated biomass of Spirulina platensis from wastewater[J]. Polish Journal of Environmental Studies,2010,19:887-893.
[59]Zinicovscaia I,Cepoi L,Chiriac T,et al. Application of Arthrospira(Spirulina) platensis biomass for silver removal from aqueous solutions[J]. International Journal of Phytoremediation,2017,19:1053-1058.
[60]Jacques N R,Mcmartin D W. Evaluation of algal phytoremediation of light extractable petroleum hydrocarbons in subarctic climates[J]. Remediation,2009,20(1):119-132.
[61]Shi W,Wang L,Rousseau D P L,et al. Removal of estrone,17α-ethinylestradiol,and 17β-estradiol in algae and duckweed-based wastewater treatment systems[J]. Environmental Science and Pollution Research,2010,17(4):824-833.
[62]Phang S M,Chu W L,Rabiei R. Phycoremediation[M]Netherlands:The Algae World,Springer,2015:357-389.
[63]Al-Dhabi N A. Heavy metal analysis in commercial Spirulina products for human consumption[J]. Saudi Journal of Biological Sciences,2013,20(4):383-389.
[64]Al-Homaidan A A. Heavy metal levels in Saudi Arabian Spirulina[J]. Pakistan Journal of Biological Sciences,2006,9(14):2693-2695.
[65]趙 楠. 螺旋藻原粉的质量分析研究[D]. 曲阜:曲阜师范大学,2013:15-23.
[66]王志忠,刘果厚,巩东辉,等. 不同来源钝顶螺旋藻砷富集特性[J]. 科技导报,2014(32):37-40.
[67]赵 静. 铅镉联合暴露导致的神经毒性及HDAC2在其中的调控作用[D]. 合肥:合肥工业大学,2019:41-44.
[68]Wenzl T,Zelinkova Z. Polycyclic aromatic hydrocarbons in food and feed[M]. Encyclopedia of Food Chemistry,2019:455-469.
[69]Zelinkova Z,Wenzl T. EU marker polycyclic aromatic hydrocarbons in food supplements:analytical approach and occurrence[J]. Food Additives and Contaminants:Part A,2015,32(11):1914-1926.
[70]Chemicals known to the state to cause cancer of reproductive toxicity;California environmental protection agency:Sacramento,CA 1012. http://www.Oehha.ca.gov/prop65/prop65_list/Newlist.html.
[71]Vally H,de Klerk N,Thompson P J. Alcoholic drinks:important triggers for asthma[J]. Journal of Allergy Clinical Immunology,2000,105(3):462-467.
[72]陈 露,马 良,谭红霞,等. 食物中藻类毒素污染及暴露风险研究进展[J]. 食品与发酵工业,2019,45(12):272-278.
[73]何 丹,刘 媛,李先保,等. 微囊藻毒素LR免疫原及包被抗原的合成与鉴定[J]. 江苏农业科学,2019,47(9):226-230.
[74]徐海滨,陈 艳,李 芳,等. 螺旋藻类保健食品生产原料及产品中微囊藻毒素污染现状调查[J]. 卫生研究,2003,32(4):339-343.
[75]Draisci R,Ferretti E,Palleschi L,et al. Identification of anatoxins in blue-green algae food supplements using liquid chromatography-tandem mass spectrometry[J]. Food Additives and Contaminants,2001,18(6):525-531.
[76]日本医药生活卫生局食品监视安全科. 关于“平成30年进口食品监测计划”的实施(药生食发1128第3号)[EB/OL].(2018-11-28)[2019-12-13].https://www.mhlw.go.jp/content/11130500/000415019.pdf.
[77]Ma Z L,Ahmed F,Yuan B,et al. Fresh living Arthrospira as dietary supplements:current status and challenges[J]. Trends in Food Science and Technology,2019,88:439-444.李梦桐,王 楠,玛依拉·吐尔地别克,等. 羊肚菌栽培及富硒控制技术研究进展[J]. 江苏农业科学,2021,49(6):20-27.
