枸杞内生真菌NQ8GⅡ4菌株GFP标签蛋白表达载体的筛选
2021-05-06闫思远任苗苗杨富龙李嘉泓顾沛雯
闫思远,任苗苗,杜 娟,李 金,杨富龙,李嘉泓,顾沛雯
(宁夏大学 农学院,宁夏 银川 750021)
内生真菌是指在其生活史中某一阶段或全部阶段生活于健康植物的各种组织和器官内部,且被感染的宿主植物不表现出明显病害症状(至少是暂时)的一类真菌[1]。研究发现,内生真菌可促进植物生长,增强植物对生物胁迫和非生物胁迫的抗性,并且能给植物提供氮源、碳源等营养物质及一些激素[2]。目前,由于宿主植物生活环境的多样性以及内生真菌与宿主植物关系的复杂性,有关内生真菌在植物体内生命活动的研究仍处于探索阶段,对内生真菌与宿主植物间的营养代谢关系尚无定论[3]。解决以上问题的关键在于建立内生真菌遗传标记体系,并用于其在宿主植物中侵染定殖规律和内生机制研究。
绿色荧光蛋白(green fluorescent protein,GFP)作为一种新型报告蛋白,因荧光性能稳定,表达与受体细胞种属无关且检测方便,目前在研究真菌与宿主相互作用中应用广泛[4]。Yao等[5]利用GFP标记揭示了交枝顶孢(Acremoniumimplicatum)在番茄根部的内生性。赵兴丽等[6]借助GFP标记探究了钩状木霉(Trichodermahamatum)ACCC31649在辣椒植株中的定殖能力。隋丽等[7]用GFP标记研究了球孢白僵菌(Beauveriabassiana)在玉米中的定殖规律和促生长特性。
表达载体形式的基因转移是常用的外源基因转化方式[8]。外源基因在宿主细胞中的表达取决于两个因素,第一,启动子与目的菌株的匹配程度;第二,参与基因转录全过程的DNA顺式作用元件和反式作用元件的影响[9]。因此,筛选与宿主细胞相互匹配的表达载体,是促使外源基因表达的重要前提[10]。2008年,郭丽琼等[10]分别使用表达载体pAN7-1和pLE-hph转化银耳(Tremellafuciformis),发现pLE-hph转化子具有较好的遗传稳定性。2015年,Sun等[11]使用表达载体pTFCM和Pgpd-hph-TtrpC 3300对茯苓(Wolfiporiacocos)进行转化,结果显示只有使用表达载体Pgpd-hph-TtrpC 3300才能成功获得转化子。2020年,李栋等[12]分别将GFP标签蛋白表达载体pKD5-GFP、pKD8-GFP、pEC-Gpd、pEC-H3和pEC-Tef转入蝉棒束孢菌(Isariacicadae)中,通过荧光显微观察发现,pKD5-GFP转化子的荧光明显强于其他转化子。
枸杞内生真菌(Fusariumnematophilum)NQ8GⅡ4是宁夏大学植物病理实验室从健康宁杞8号枸杞根部分离到的一株高活性功能菌株[13]。该菌株对枸杞胶孢炭疽菌(Colletotrichumgloeosporioides)、葡萄灰霉病菌(Botrytiscinerea)和玉米大斑病菌(Exserohilumturcicum)等多种植物病原真菌具有较强的拮抗作用,同时还能产生具有抑菌活性的挥发性物质[14]。本研究采用PEG介导原生质体转化法分别将pFL2、pDL2、r-KNT和KNTG 4种携带GFP基因的表达载体转入NQ8GⅡ4菌株中,通过对比4种GFP转化子的荧光强度、遗传稳定性、拮抗活性和致病性,筛选出适宜NQ8GⅡ4菌株GFP标记的表达载体,以期为研究该菌株在宿主植物中的侵染行为和定殖规律奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株和表达载体 枸杞内生真菌NQ8GⅡ4(CGMCC No.19271)、枸杞胶孢炭疽菌由宁夏大学植物病理实验室分离鉴定并保存。表达载体pFL2(含NEO和GFP基因)、pDL2(含HPH和GFP基因)由西北农林科技大学胡小平教授惠赠,表达载体r-KNT(含NEO和GFP基因)由中国农业大学彭有良教授惠赠,表达载体KNTG(含NEO和GFP基因)由西北农林科技大学赵磊副教授惠赠。
1.1.2 试 剂 潮霉素B(Hygromycin B,HmB)购于德国Roche公司,Miracloth购于美国Calbiochem公司,崩溃酶(Driselase)、溶壁酶(Lyticase)购于美国Sigma公司,LB固体/液体培养基、氨苄青霉素(Ampicillin,Amp)、遗传霉素(Genetinic,G418)购于北京索莱宝科技有限公司,AxyPrep表达载体DNA小量试剂盒购自美国康宁生命科学有限公司,DH10B大肠杆菌感受态细胞购自北京博迈德生物技术有限公司,EcoTaq®PCR SuperMix(+dye)购自北京全式金生物技术有限公司。
根据张世杰[15]的方法,配制马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖肉汤培养基(PDB)、酵母浸出粉胨葡萄糖培养基(YPD)、TB3培养基、Bottom Agar培养基、Top Agar培养基、山梨醇-Tris-氯化钙溶液(STC)和聚乙二醇-Tris-氯化钙溶液(PTC)。
1.2 试验方法
1.2.1 NQ8GⅡ4菌株对抗生素的耐受性 融化PDA培养基,待温度降至45 ℃,加入HmB或G418,使其在培养基中的终质量浓度均分别为0,10,20,30,40,50,60,70,80 mg/L,待培养基冷却后分别接种直径为0.5 cm的NQ8GⅡ4菌饼,25 ℃培养7 d,观察菌落生长情况,确定HmB或G418对NQ8GⅡ4菌株的最佳筛选质量浓度。
1.2.2 原生质体的制备 参照徐齐君等[16]的方法并略作调整,制备原生质体。NQ8GⅡ4菌株原生质体的制备条件为:将16 h菌龄的菌丝0.05 g置于1 mL酶解液(30.30 g/L崩溃酶+10 g/L溶壁酶)中反应2.5 h;以0.713 mol/L NaCl为稳渗剂,所获得的原生质体使用STC溶液调节密度为2×107~5×107mL-1,每管200 μL分装。
1.2.3 原生质体的转化 参照侯甲男等[17]的方法,略作调整,将NQ8GⅡ4原生质体转化表达载体。分别吸取20 μg表达载体pFL2、pDL2、r-KNT、KNTG装入有200 μL NQ8GⅡ4菌株原生质体的离心管中,轻轻混匀,冰上静置20 min,加入1.25 mL PTC轻微翻转混匀,冰上再静置20 min,转至50 mL离心管中,加入10 mL TB3培养基(含50 mg/L Amp),25 ℃、175 r/min培养过夜。将培养过夜的原生质体加入融化降温至45 ℃的Bottom Agar培养基(含50 mg/L Amp+20 mg/L HmB(或80 mg/L G418))中混匀倒平板。将平板于25 ℃倒置培养2 d后,再铺10 mL Top Agar培养基(含50 mg/L Amp+30 mg/L HmB(或100 mg/L G418)),25 ℃倒置培养7 d后挑取单菌落,转接到PDA培养基(含50 mg/L Amp+30 mg/L HmB(或100 mg/L G418))上复筛2次,能再生的视为转化子。转化效率(株/μg)=再生转化子数量/表达载体的质量。
1.2.4 转化子的PCR检测 使用Biospin真菌基因组DNA提取试剂盒提取转化子菌落DNA。PCR反应体系(25 μL):2×EcoTaq®PCR SuperMix(+dye)12.5 μL,上、下游引物(10 μmol/L)(表1)各0.5 μL,DNA模板1 μL,ddH2O补足。反应条件:94 ℃预变性3 min;94 ℃变性30 s,55~61.4 ℃退火40 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min,4 ℃ 保存。试验同时设表达载体和野生型菌株对照。PCR产物经过1.2%琼脂糖凝胶电泳检测后,通过凝胶成像系统(Azure c200,美国)分析结果。

表1 本研究所用的引物Table 1 Primers used in this study
1.2.5 转化子的荧光观察 使用埋片法[18]或压片法[19]获得NQ8GⅡ4野生型菌株和转化子菌株的菌丝,荧光显微镜(Olympus BX51,日本)400倍下观察,记录菌丝发荧光和不发荧光的转化子。
1.2.6 转化子的遗传稳定性检测 根据研究人员Bernardi-Wenzel等[20]的方法,略作调整,检测转化子的遗传稳定性。将野生型及再生的NQ8GⅡ4转化子接种在含有50 mg/L Amp+30 mg/L HmB(或100 mg/L G418)的PDA平板上,25 ℃培养7 d,从边缘挑取菌丝接种于不含抗生素的PDA平板上,重复5次,然后再接种于含有50 mg/L Amp+30 mg/L HmB(或100 mg/L G418)的PDA平板上,对比继代后转化子的生长情况和荧光强度。遗传稳定率=第5代转化子数目/第1代转化子数目×100%。
1.2.7 荧光转化子的拮抗活性测定 根据胡丽杰[21]的方法,采用平板对峙法测定NQ8GⅡ4野生型菌株和转化子对枸杞胶孢炭疽菌的拮抗活性。
抑菌率=[(对照菌落直径-各处理菌落直径)/(对照菌落直径-原菌饼直径)]×100%。
1.2.8 荧光转化子的致病性检测 根据崔伟业等[22]的方法,略作调整,检测荧光转化子的致病性。采集健康枸杞叶片,用体积分数75%酒精消毒30 s,再用体积分数7%次氯酸钠处理8 min,无菌水冲洗5次,吸取5 μL浓度为107个/mL的NQ8GⅡ4野生型菌株或转化子孢子悬浮液滴加于枸杞叶片上,培养48 h,观察病斑情况。以滴加无菌水处理的叶片为阴性对照,以滴加枸杞胶孢炭疽菌孢子悬浮液处理的叶片为阳性对照。
1.3 数据处理
采用SPSS 23软件对试验数据进行差异显著性检验(Duncan’s,α=0.05)。
2 结果与分析
2.1 抗生素对NQ8GⅡ4菌株生长的抑制作用
采用生长速率法测定NQ8GⅡ4菌株对抗生素HmB和G418的敏感性。结果(图1)表明,当PDA平板中含有20 mg/L HmB 或80 mg/L G418时,NQ8GⅡ4菌株生长完全停止。因此,后续试验选择20 mg/L HmB用于pDL2阳性转化子的初筛,80 mg/L G418用于pFL2、r-KNT和KNTG阳性转化子的初筛。
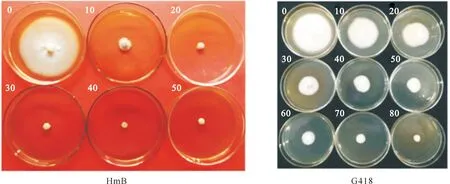
图中数字表示抗生素质量浓度(mg/L)The numbers in the figure indicate concentrations of antibiotic (mg/L)图1 抗生素对NQ8GⅡ4菌株生长的影响Fig.1 Effect of antibiotic on growth of NQ8GⅡ4 strain
2.2 不同表达载体对NQ8GⅡ4菌株原生质体的转化效率
不同表达载体对NQ8GⅡ4菌株原生质体的转化效率见表2。

表2 不同表达载体对NQ8GⅡ4菌株原生质体的转化效率Table 2 Transformation efficiency of different expression vector transformed into protoplasts of NQ8GⅡ4 strain
由表2可知,将表达载体pFL2、pDL2、r-KNT和KNTG分别转入NQ8GⅡ4菌株原生质体后,获得pFL2转化子272株、pDL2转化子57株、r-KNT转化子73株和KNTG转化子226株。其中表达载体pFL2和KNTG的转化效率比较高,分别为13.60和11.30株/μg;表达载体pDL2和r-KNT的转化效率较低,分别为2.85和3.65株/μg。
2.3 NQ8GⅡ4菌株转化子的PCR检测
随机挑取在50 mg/L Amp+30 mg/L HmB(或100 mg/L G418)上生长良好的菌落,分别提取菌丝体DNA进行PCR扩增,结果发现pFL2和pDL2转化子均可以扩增出500 bp左右的目的条带,r-KNT和KNTG转化子均可以扩增出700 bp左右的目的条带,与表达载体扩增出的条带相同,而野生型NQ8GⅡ4菌株均未扩增出目的条带(图2)。说明GFP基因被成功整合到了NQ8GⅡ4菌株基因组中。

M.DNA Marker;1~15.转化子;P.表达载体;WT.野生型菌株M.DNA Marker;1-15.Transformants;P.Expression vector;WT.Wild type strain图2 NQ8GⅡ4菌株转化子GFP基因的PCR检测Fig.2 PCR detection of NQ8GⅡ4 transformants with specific GFP primer
2.4 不同表达载体NQ8GⅡ4菌株转化子的荧光强度
由图3可知,pDL2转化子和KNTG转化子产生的绿色荧光明显强于r-KNT转化子,而pFL2转化子和野生型NQ8GⅡ4菌株均不产生绿色荧光。

图3 不同表达载体NQ8GⅡ4菌株转化子的荧光强度Fig.3 Fluorescence intensity of NQ8GⅡ4 transformants with different expression vectors
2.5 4种NQ8GⅡ4菌株转化子的遗传稳定性
4种NQ8GⅡ4菌株转化子的遗传稳定性检测结果见图4、图5和表3。

图4 4种NQ8GⅡ4菌株转化子的遗传稳定性观察Fig.4 Observation of mitotic stability of 4 types of NQ8GⅡ4 transformants

图5 4种NQ8GⅡ4菌株转化子在荧光下的遗传稳定性Fig.5 Fluorescence stability of 4 types of NQ8GⅡ4 transformants

表3 4种NQ8GⅡ4菌株转化子的遗传稳定性检测Table 3 Detection of mitotic stability of 4 types of NQ8GⅡ4 transformants
对获得的272株pFL2转化子、57株pDL2转化子、73株r-KNT转化子和226株KNTG转化子进行继代培养,其中183株pFL2转化子、51株pDL2转化子、50株r-KNT转化子和133株KNTG转化子均能正常生长,且荧光强度未发生变化(图4,图5和表3)。说明67.28%的pFL2转化子、89.47%的pDL2转化子、68.49%的r-KNT转化子和58.85%的KNTG转化子具有良好的遗传稳定性(表3)。
2.6 4种NQ8GⅡ4菌株转化子对枸杞胶孢炭疽菌的拮抗活性
4种NQ8GⅡ4菌株转化子对枸杞胶孢炭疽菌的拮抗活性见图6和表4。

图6 4种NQ8GⅡ4转化子对枸杞胶孢炭疽菌的拮抗表现Fig.6 Antagonistic of 4 types of NQ8GⅡ4 transformants against C. gloeosporioides

表4 4种NQ8GⅡ4转化子对枸杞胶孢炭疽菌的拮抗作用Table 4 Antagonistic role of 4 types of NQ8GⅡ4 transformants against C. gloeosporioides
皿内对峙试验结果(图6)表明,NQ8GⅡ4野生型菌株和4种转化子与枸杞胶孢炭疽菌之间均能够产生明显的抑菌带,病原菌的菌丝体分布不均,边缘明显变薄,颜色变黄褐色,菌丝的生长受到明显抑制。其中pDL2转化子对枸杞胶孢炭疽菌抑制率为58.98%,相对于野生型NQ8GⅡ4菌株(55.29%)略有提升。pFL2转化子、r-KNT转化子和KNTG转化子对枸杞胶孢炭疽菌抑菌率分别为53.29%,54.27%和52.88%,相对于野生型NQ8GⅡ4菌株略有下降,但抑菌率间差异均不显著(表4)。
2.7 4种NQ8GⅡ4菌株转化子对枸杞离体叶片的致病性
枸杞离体叶片致病性检测结果(图7)表明,4种NQ8GⅡ4菌株转化子均不能使枸杞叶片发病,与野生型NQ8GⅡ4菌株无异。

图7 NQ8GⅡ4菌株转化子对枸杞离体叶片的致病性Fig.7 Pathogenicity analysis of NQ8GⅡ4 transformants on Lycium barbarum leaves
3 讨 论
抗生素敏感性筛选是菌株转化的必要前提,是影响转化效率的重要原因之一[23]。但以抗生素作为抗性筛选标记,通常假阳性背景高,为克服筛选假阳性,通常会使用高于其致死浓度的抗生素来筛选转化子[24]。高静等[25]在将含50 mg/L HmB Top培养基上长出的菌落挑到含有100 mg/L HmB Top培养基上复筛,获得了苹果腐烂病菌(Valsamali)转化子。徐齐君等[16]在含250 mg/L HmB的Bottom Agar培养基上覆盖一层含400 mg/L HmB的Top Agar培养基,获得了GFP标记的尖孢镰刀菌(F.oxysporumf.sp.vasinfectum)转化子。本研究使用含有20 mg/L HmB或者80 mg/L G418的Bottom Agar培养基初筛,再使用含有30 mg/L HmB或者100 mg/L G418的Top Agar/PDA培养基复筛,获得pFL2转化子272株、pDL2转化子57株、r-KNT转化子73株和KNTG转化子226株,经过荧光观察和PCR检测,均为阳性转化子,转化效率为2.85~13.60株/μg。
由于抗生素抗性基因的差异和表达载体插入位点的不同,在真菌转化中常常会出现夭折的转化子。刘海青[26]建立了以潮霉素磷酸转移酶(HPH)基因作为选择标记的禾谷镰刀菌(F.graminearum)遗传转化体系,结果表明100%的转化子可以稳定遗传。Sørensen等[27]以新霉素抗性(NEO)基因建立了禾谷镰刀菌(F.graminearum)的遗传转化体系,结果显示只有85%的转化子可以稳定遗传。本研究在转化NQ8GⅡ4菌株时出现了类似的结果。pDL2转化子是以HPH基因作为抗性标记的,其转化子有89.47%可以稳定遗传,而pFL2、r-KNT和KNTG转化子是以NEO基因作为选择标记的,遗传稳定率分别为67.28%,68.49%和58.85%,远低于pDL2转化子的遗传稳定率。初步分析产生差异的原因可能是,NQ8GⅡ4菌株对潮霉素和遗传霉素耐药性存在差异。说明在继代培养过程中,有10.53%的pDL2转化子、32.72%的pFL2转化子、31.51%的r-KNT转化子和41.15%的KNTG转化子丧失了对潮霉素或遗传霉素的抗性,可能是表达载体DNA整合到真菌基因组中一个不稳定的区域;也可能是表达载体DNA插入后被真菌细胞内的酶降解了;还可能是原生质体凝聚融合形成多核体导致继代培养中丢失了外源DNA[25]。
外源基因在微生物体内进行特异性表达的同时,也会改变转化菌株的代谢途径,增强转化菌株的代谢负荷。在和其他微生物共同生长的情况下,转化菌株会处于不利地位,反映在生理特性上,即为转化子拮抗活性和致病性的变化[28]。黄贵修等[29]发现,外源基因插入使橡胶多主棒孢(Corynesporacassiicola)的拮抗性发生变化。张晓斐等[30]对构建的芸薹生链格孢(Alternariabrassicicola)转化子库进行筛选,发现有部分转化子致病力与野生型菌株相比产生了差异。本研究对所获得的pFL2、pDL2、r-KNT和KNTG等4种转化子进行拮抗活性和致病性比较,发现4种转化子的拮抗性和致病性与野生型NQ8GⅡ4菌株无明显差异。
综上所述,pDL2转化子具有良好的遗传稳定性,能够产生较强的绿色荧光,拮抗活性和致病性与野生型菌株无差异,可用于研究NQ8GⅡ4菌株与宿主植物的共生机制。
4 结 论
本研究通过PEG介导原生质体转化法,获得272株pFL2转化子、57株pDL2转化子、73株r-KNT转化子和226株KNTG转化子。通过对比4种转化子的荧光强度、遗传稳定性、拮抗活性和致病性发现,pDL2转化子具有良好的遗传稳定性,产生的绿色荧光较强,拮抗性和致病性与野生型菌株无差异,可用于后续NQ8GⅡ4菌株在宿主植物中的侵染行为和定殖规律研究。
