串钱柳间苯三酚衍生物抗耐甲氧西林金黄色葡萄球菌活性研究
2021-04-30纪翠芳李欢曾玉虹吉训恋
纪翠芳,李欢,曾玉虹,吉训恋
(中南大学湘雅医学院附属海口医院,海南海口570208)
耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)是导致烧伤感染、术后创伤感染、烫伤样皮肤综合征等软组织感染的主要致病菌[1-2],具有多重耐药性、感染率高及致死率高等特点[3],是医院感染的重要病原菌之一[4],所以被称为“超级细菌”。该类菌株不仅对青霉素类抗生素耐药,还能在一定程度上对四环素类和大环内酯类等抗生素耐药[5],其耐药性与抗生素的使用剂量呈正相关,尚无有效遏制这一趋势的药物[6]。目前临床上将万古霉素作为一线抗MRSA 感染的药物,但由于万古霉素有较大的肾毒性,而且还有部分金黄色葡萄球菌出现了对万古霉素中度耐药甚至完全耐药的现象[7],故万古霉素对MRSA 不是万能的,寻找新的能抑制MRSA的抗生素迫在眉睫。
串钱柳(Callistemon viminalis),又名垂枝红千层,系桃金娘科红千层属植物[8-9]。鉴于文献报道桃金娘科植物含有强抗菌活性[10-12]的化学成分,尤其是间苯三酚类化合物,例如广为熟悉的间苯三酚rhodomyrtone更是具有潜在的抗MRSA活性,最低抑菌浓度(MIC)为0.39 mg/mL[13]。而在Leejae 等[14]的深入研究rhodomytone 对抗生素耐药病原菌的抗菌机制中,发现rhodomytone 对病原菌的主要作用靶点不在细胞膜和细胞质中,这提示间苯三酚类化合物极有可能对包括MRSA在内的抗生素耐药病原菌拥有新的作用靶点。因此,本文对串钱柳植物中已分离鉴定的间苯三酚类化合物2,6-dihydroxy-4-methoxyisobutyrophenone(1)和2,6-dihydroxy-4-methoxyisovalerophenone(2)进行抗MRSA 活性评价,并进一步探讨其抗MRSA作用机制。
1 材料与方法
1.1 植物与试剂
串 钱 柳(Callistemon viminalis) 15 kg,2018 年4月,采集于海南省海口市,标本号No.20180401。
MTT 噻唑兰,美国Sigma 公司;叔丁基过氧化氢(t-BHP),成都格雷西亚化学技术有限公司;柱层析硅胶,200~300 目、300~400 目硅胶均为青岛海洋化工厂;TLC 预制薄层板(HSGF254),德国Merck 公司;葡聚糖凝胶Sephadex LH-20:Pharmacia Biotech AB,Uppsala,Sweden;MCI 树 脂:CHP20P(75~150 μm),Mitsubishi Chemical Corporation 生产;96 孔细胞培养板,美国CORNING 公司;胎牛血清(FBS),澳大利亚Gibco公司;青-链霉素(P/S),Thermo公司;DMEM培养基,美国Gibco公司;RPMI-1640培养基,德国Biological Industries 公司;DMSO 溶液,美国Sigma 公司;HPLC分析用乙腈,Merck公司;实验用水由美国Millipore公司纯水、超纯水系统提供;其他有机溶剂均为国产分析纯产品;TLC显色剂为5%香兰素乙醇液。
1.2 主要仪器
质谱:Waters 3100 SQDMS(低分辨ESI);核磁共振谱:Bruker Avance Ⅲ500 型核磁共振仪,δ(ppm),以氘代试剂残留溶剂峰为内标;液相色谱与质谱联用仪:Waters 2695 LC 偶联Waters Acquity ELSD、Waters 3100 SQDMS,分析色谱柱型号:Waters Sunfire®RP C18,3.5 μm,4.6 mm×100 mm;CO2细胞培养箱(上海力申科学仪器有限公司);垂直超净工作台(上海智城分析仪器制造有限公司);低速离心机(科大创新股份有限公司中佳分公司);MK3 型酶标仪(美国Thermo fisher 公司);超低温冰箱(日本三洋SANYO 公司);FM-500型倒置荧光生物显微镜(上海普丹光学仪器有限公司);TU-1901 双光束紫外可见分光光度计(北京普析通用仪器有限公司)。
1.3 方法
1.3.1 提取与分离
串钱柳枝叶15 kg,切断后用95%(φ)酒精室温浸泡3 次,每次7 d,合并提取液,减压浓缩至无乙醇味。将获到的总浸膏用水悬浮,然后用乙酸乙酯萃取,减压条件下浓缩萃取液,得到乙酸乙酯部位(825 g)。首先,选用MCI 柱层析处理乙酸乙酯部位,以乙醇-水(50%、70%、95%乙醇)为流动相梯度洗脱,分别获得组分A、B、C。随后,采用硅胶柱层析(200~300 目)对组分A 进行处理,正己烷∶乙酸乙酯(10∶1~1∶1,V∶V)梯度洗脱,薄层色谱(TLC)检测合并,获到子组分A1~A9。子组分A3经凝胶柱层析处理,甲醇洗脱,得到组分A3A~A3C;接下来对得到的子组分A3B 再进行硅胶(300~400 目)柱层析处理,正己烷∶乙酸乙酯(10∶1~1∶1,V∶V)洗脱,最后获得化合物1(1.3 g)、化合物2(1.2 g)。
1.3.2 化合物1和2的结构鉴定
化合物1,黄色粉末,ESI-MSm/z211.13[M+H]+,分子式C11H14O4(不饱和度Ω=5)。1H NMR(500 MHz,CDCl3):δH1.18(6H, d, 6.7 Hz, H-9,H-l0), 3.79(3H,s,CH3O),3.85(lH,sept,6.7 Hz,H-8),5.93(2H,s,H-3,H-5)。13C NMR(125 MHz,CD3OD):δC103.9(C-1),164.1(C-2),92.6(C-3),165.8(C-4),92.6(C-5),164.1(C-6),210.5(C-7),38.7(C-8),18.2(C-9),18.2(C-10),54.4(CH3O)。以上数据与文献[15]报道基本一致,故鉴定化合物1 为2,6-dihydroxy-4-methoxyisobutyrophenone。
化合物2,黄色粉末,ESI-MSm/z225.15[M+H]+,分子式C12H16O4(不饱和度Ω=5)。1H NMR(500 MHz,CDCl3):δH0.97(6H,d,6.8 Hz,H-10,H-l1),2.25(lH,m,H-9),2.95(2H,d,6.8 Hz,H2-8),3.76(3H,s,CH3O),5.94(2H,s,H-3,H-5)。13C NMR(125 MHz,CDCl3):δC105.2(C-1),163.6(C-2),92.6(C-3),165.7(C-4),94.3(C-5),164.1(C-6),206.4(C-7),52.7(C-8),25.5(C-9),22.8(C-10),22.8(C-11),55.5(CH3O)。以上数据与文献[16]报道基本一致,故鉴定化合物2 为2,6-dihydroxy-4-methoxyisovalerophenone。
1.3.3 体外抗菌活性评价
菌液制备方法:挑取MHA培养皿上单个菌落于10 mL MH 培养液中,摇床160 r/min、37 ℃条件下培养14 h。将待测菌液用MH 培养液适当稀释,摇均匀后,600 nm 波长、l cm比色皿测定吸光度值A,根据A600吸光度值1 时,对应细菌数量为1×109CFU/mL,将菌液浓度调整至1×106CFU/mL。
1.3.3.1 MIC与MBC测定实验 化合物1和2分别用DMSO 做溶剂配制成质量浓度为1 mg/mL 的溶液;阳性药物万古霉素用DMSO稀释成1 mg/mL;刃天青显色剂用双蒸水配置成100 μg/mL;分别用0.22 μm孔径的微孔滤膜过滤除菌,存于避光的棕色小瓶,4 ℃储存。二倍稀释法将最终样品浓度与万古霉素的浓度依次为100 μg/mL、50 μg/mL、25 μg/mL、12.5 μg/mL、6.25 μg/mL、3.12 μg/mL、1.56 μg/mL、0.78 μg/mL、0.39 μg/mL、0 μg/mL,然后将96 孔板在37 ℃下孵育18 h。通过颜色的变化来判断药物抗菌的MIC 值。根据2013 年CLSI 药敏实验规定,能够杀死大于99.9%初始细菌含量的最低药物浓度即为MBC 值。在读取MIC 值后,分别移取各组药物阴性孔(蓝色生长孔)液体少许后用培养基,稀释一定倍数,取50 μL稀释后的菌液,涂菌棒均匀涂布于预先制好的MHA琼脂平板上,将平板于37 ℃恒温培养箱培养24 h;取出平板读取菌落个数,计算对应孔内细菌数量,确定MBC值。
1.3.3.2 Time-killing 曲线考察 取稀释好的菌液(106~107CFU/mL)1.8 mL 于24 孔板中各个孔中,然后配制好的不同浓度化合物、万古霉素和DMSO(阴性对照)与菌液于37 ℃培养箱中孵育。在0 h、2 h、4 h、8 h、24 h分别吸取100 μL混合液,以MH为稀释液,连续稀释10倍稀释,吸取稀释后的菌液各5 μL,无菌接种环将菌液平铺开来涂布于预先制好的MHA 琼脂培养基平板上,将平板于37 ℃恒温培养箱培养24 h;取出平板读取菌落个数;以时间为横坐标,细菌数量对数值为纵坐标,绘制杀菌曲线,分析其动态杀菌效应。
1.3.4 抗菌机制探讨
1.3.4.1 细胞膜去极化实验 37 ℃,取培养至对数期的菌液,于4 000g,离心10 min,收集细胞,缓冲液洗涤3 次,制备A600为0.1 的菌悬液。将染色剂DiSC3-5加入细胞悬液中孵育,使染色剂终浓度为1 μmol/L,于30 ℃黑暗条件下培养20 min,直至吸收DiSC3-5。然后添加100 mmol/L KCl 溶液以平衡细胞质和外部K+浓度。最后分别指定浓度的化合物,调零对照组Hepes缓冲液组,荧光分光光度计读数。激发波长λex=660 nm、发射波长λem=675 nm。
1.3.4.2 SYTOX Green 实验 核染色剂SYTOX Green用DMSO 配制成为浓度为3 mmol/L,避光保存于-20 ℃冰箱。阳离子核酸染料SYTOX Green 其本身基本不发出荧光,与核酸结合,能够发出强荧光,相当于自身发荧光强度的500倍。细胞膜受损时其细胞膜通透性发生改变,SYTOX Green 核酸染料能够轻易穿透细胞膜。而活的细胞细胞膜功能完好,可以阻挡核酸染料。死细胞用SYTOX Green染色孵育一段时间,在488 nm 激发下发出荧光,SYTOX Green 荧光染色的方法可用于鉴定细胞悬浮液中的死活及总数。37 ℃,取培养至对数期的MRSA 于4 000g,离心10 min,收集细胞,用0.85% NaCl 缓冲液洗涤3 次,制备A600为0.2 的菌悬液,将其分别与8×MIC 浓度的化合物共同孵育,10 μg/mL 的蜂毒肽作阳性对照,与终浓度为3 μmol/L 的SYTOX green染料共同孵育5 min 激发波长λex=504 nm、发射波长λem=523 nm测量荧光。
1.3.4.3 扫描电镜实验 取培养至对数期的菌液于4 000g,离心10 min,收集细胞,用缓冲液(0.85%NaCl)洗涤3 次,制备A600为0.2 的菌悬液,37 ℃下用分别用8×MIC 的化合物溶液处理4 h。将细胞洗涤2 次,悬浮在PBS 中,并在含有2%戊二醛和2.5%多聚甲醛的0.1 mol/L 磷酸盐缓冲液(pH=7.2)中过夜处理。用PBS洗涤6次后,将样品在1%四氧化锇中固定2 h。再用PBS 洗涤3 次后,将样品通过分级乙醇(50%开始至100%)系列脱水,然后进行冷冻干燥至样品中的脱水剂彻底挥发干净。离子溅射法涂金,在扫描电子显微镜上拍照观察。
2 结果
2.1 MIC与MBC测定结果
化合物1 和2 对MRSA JCSC4474 的MIC、MBC值见表1。
2.2 Time-killing曲线考察
结果如图1 所示,当分别用化合物1 和2 的8 倍MIC 浓度作用于MRSA JCSC4474,测试菌的存活量随着时间的增加迅速减少,并在24 h 后降到极低点。

表1 化合物1和2对MRSA的MIC和MBC值Table 1 MIC and MBC of compounds 1 and 2 against MRSA
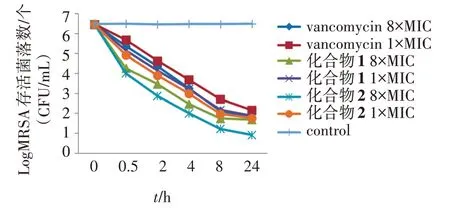
图1 化合物1和2对MRSA JCSC4744的致死曲线Figure 1 Time-killing assay of MRSA JCSC4744 by compounds 1 and 2
2.3 抗菌机制探讨
2.3.1 细胞膜去极化实验
结果如图2 所示,经化合物1 和2 作用后,DiSC3-5探针的荧光强度明显增强,呈现剂量浓度依赖性增大,表明化合物1 和2 在发挥抗菌活性时,会导致细菌细胞膜电势去极化。
2.3.2 SYTOX Green实验
实验结果如图3 所示,阳性对照荧光信号明显升高;化合物1 和2 随着作用时间的增加,荧光信号强度也随之增加,但作用效果不如阳性对照明显。
2.3.3 扫描电镜实验
结果如图4a和图4b所示,化合物1和2处理4 h后,细菌形态出现菌体大小不均,部分细菌破裂、变形,细菌表面出现皱缩等现象。

图2 DiSC3-5探针下,化合物1 和2 对MRSA JCSC4744 细胞膜去极化Figure 2 Cytoplasmic membrane depolarization assay of MRSA JCSC4744 with compounds 1 and 2 by DiSC3-5 probe

图3 化合物1和2对MRSA JCSC4744 的SYTOX green试验Figure 3 SYTOX green assay of MRSA JCSC4744 with compounds 1 and 2

图4 扫描电镜下,化合物1(a)和2(b)作用MRSA JCSC4744 4 h后细菌细胞形态图Figure 4 Cell morphology of MRSA JCSC4744 treated with compounds 1(a)and 2(b)for 4 h by scanning electron microscope
3 讨论
随着抗生素的使用[17],万古霉素的MIC 值呈现逐年上升的趋势,以致出现“MIC 漂移”的现象,为了减少耐药菌株的出现,亟需寻找新的能抑制MRSA 的抗生素。研究报道,桃金娘科植物特征性化学成分间苯三酚类化合物具有显著的抗MRSA活性。因此,从该科植物中寻求抗MRSA 先导化合物具有重要意义。而目前很多研究只是针对植物粗提物的抗菌活性,对单体化合物的活性研究尚少,本研究在对桃金娘科植物串钱柳的研究中,分离鉴定得到2 个间苯三酚类化合物,结构鉴定为2,6-dihydroxy-4-methoxyisobutyrophenone(1)、2,6-dihydroxy-4-methoxyisovalerophenone(2)。
化合物1 和2 的MIC(表1)与Time-killing 曲线结果(图1)显示,化合物1和2对MRSA JCSC4474的MIC/MBC 值分别为25/50、6.25/100 μg/mL;且在24 h内化合物1和2对MRSA均有持续杀菌效果,并与浓度成剂量依赖关系,因此化合物1和2对MRSA的杀菌效应是迅速且彻底的。在细胞膜去极化实验中(图2),DiSC3-5探针的荧光强度明显增强,表明化合物1 和2 在发挥抗菌活性时,会导致细菌细胞膜电势去极化,据此推测化合物是通过破坏膜结构而发挥抑菌活性的。在SYTOX Green 实验中(图3),尽管荧光信号强度增加不大,但仍可推测化合物1和2是通过作用于细菌细胞膜而发挥抗菌效应。据此,细胞膜去极化实验和SYTOX Green实验结果揭示该2 个化合物的抑菌机制是通过破坏细菌的细胞膜而发挥抑菌活性的,同时该结果得到扫描电镜实验的验证。
综上所述,可知串钱柳植物中的间苯三酚类化合物拥有潜在的抗MRSA 活性,值得深入系统研究该类化合物,并从该类化合物中筛选出抗MRSA 活性更强的先导化合物。本研究还丰富了串钱柳植物的化学成分研究以及丰富间苯三酚类化合物的结构类型,也为天然抗MRSA 药物研发提供科学依据和物质基础。
