核盘菌对大豆致病力差异与抗氧化酶系统酶活性的关系
2021-04-29李易初石凤梅马立功刘佳孟庆林
李易初 石凤梅 马立功 刘佳 孟庆林

摘要 采集黑龙江省大豆菌核病样分离得到15个菌株,选用大豆离体叶片接种法鉴定菌株致病力强弱,测定致病力差异菌株体内POD、SOD、CAT活性。结果发现,黑龙江地区大豆菌核病菌致病力分化明显,菌株致病力分化与来源地无明显相关性;致病力差异菌株体内POD、SOD、CAT活性存在差异;60%供试菌株体内SOD、POD和CAT活性与致病力呈正相关,菌株致病力强则菌株体内相应的酶活性强;菌株CAT活性与其致病力相关性不明显,需进一步试验验证。
关键词 大豆;核盘菌;致病力;酶活性;POD;SOD;CAT
中图分类号 S435.651文献标识码 A文章编号 0517-6611(2021)07-142-04
Abstract Fifteen strains were isolated from the samples of Sclerotinia sclerotiorum on soybean in Heilongjiang Province, and the pathogenicity of the strains were determined by inoculating the leaves in vitro, and the enzymes activity of POD, SOD and CAT in the strains with different pathogenicity were determined. It showed that the pathogenicity of S. sclerotiorum on soybean in Heilongjiang was differentiated obviously, and there was no obvious correlation between the pathogenicity and the collection places. The enzyme activities of POD, SOD and CAT were different in 15 strains. The enzyme activities of POD,SOD and CAT in strains were correlated with pathogenicity of the strains, and the enzyme activities of POD,SOD and CAT in the 60% strains of the test were bigger which strains with stronger pathogenicity. There was no significant correlation between the activity of CAT in strains and its pathogenicity.
Key words Soybean;Sclerotinia sclerotiorum;Pathogenic;Enzyme activity;POD;SOD;CAT
作者簡介 李易初(1986—),女,辽宁本溪人,助理研究员,硕士,从事植物病害研究。*通信作者,研究员,硕士,从事植物病害研究。
菌核病[Sclerotinia sclerotiorum(Lib.)de Bary]是危害全球大豆产量及品质的一种常见病害,我国以黑龙江省、内蒙古等地危害较重。大豆作为垦区主栽农作物,大豆菌核病每年都有发生,一般田块发病率达10%,重病田可达50%,减产可达50%以上[1]。菌核病可侵染各生育期的大豆植株,初期为水浸状病斑,逐渐引起叶片变黄萎缩,茎杆褪绿溢缩死亡,气候湿润叶部病斑背面可见大量白色菌丝,死亡植株可在大豆茎秆内部找到大量黑色鼠粪状菌核[2]。大豆菌核病致病菌为核盘菌[Sclerotinia sclerotiorum(Lib.)de Bary],属于子囊菌门柔膜菌目核盘菌属的一种植物病原真菌[3]。核盘菌生态分布广泛,可以侵染包括油菜、大豆、向日葵等多种双子叶农作物在内的400多种植物[4]。核盘菌在不良生存条件下形成菌核,以菌核为休眠体可保持萌发能力存活8年甚至更久[5]。单个菌核在适宜条件下能多点多次萌发形成子囊盘,每个健康的子囊盘可持续多天喷发子囊孢子,研究发现核盘菌多种菌态均可完成侵染,气生菌丝和子囊孢子都可直接侵染寄主,实际生产中无完全免疫大豆品种材料,因此对大豆菌核病的防治比较困难[6]。
核盘菌的致病机制仍未明确,研究发现核盘菌菌株在不同寄主上均表现出致病力分化,国外曾报道过致病力不同的核盘菌生理生化特性存在极大的差异[7],果胶酶、纤维素酶活性与核盘菌菌株致病力存在相关性[8-10],菌株体内抗氧化酶系统中SOD酶、POD酶及CAT酶活性与菌株致病力关系研究较少。笔者通过对病原菌致病力差异测定,确定致病力强弱菌株,并比较致病力差异菌株内3种酶的活性,揭示菌株致病力与酶活性的关系,旨在研究核盘菌致病力与病原菌体内氧化酶的相关性,为进一步研究大豆菌核病菌致病机制、致病力主控酶所属基因测定提供前期研究,为更加有效地预防控制菌核病提供理论依据。
1 材料与方法
1.1 病原菌的制备
收集到的菌核样本根据采集地点编号,通风阴凉处晾干,晾干后存放于纸袋,室温保存备用。实验室常规方法分离菌核样品,在无菌室内用75%无水乙醇浸泡菌核表面消毒30 s,无菌水冲洗3遍,菌核表面水分用滤纸吸干,镊子夹取菌核放在培养皿中,手术刀切取菌核薄片(如菌核过硬不易切片,可先用无菌水浸泡数分钟,再重复表面消毒等后续操作再切片),接种于PDA培养基25 ℃恒温培养,菌核片长出白色菌丝,挑取菌丝转接在新的PDA平板上,菌株分离试验中所用器具均需提前灭菌消毒,以此方法转接 3 次得到的菌株,可认为遗传稳定的纯化菌株。按照上述方法分离采集的大豆菌核样本,经柯赫氏法则回接试验再分离得到的菌株,转接保存于试管斜面,放置在4 ℃低温备用。试验前,菌株需提前在PDA培养基上活化再使用。分离得到黑龙江地区大豆菌核病致病菌,选取15个菌株进行试验(表1)。
1.2 大豆菌核病菌致病力差异
核盘菌的致病性测定方法主要有菌丝体接种法[11]、子囊孢子法[12]和草酸鉴定法[13]。目前致病力测定最常用的方法是菌丝体接种法,将菌核分离培养得到的PDA生长的菌丝体,采用菌块贴片的方法接种到对应寄主植物的组织上,接种部位多以植株叶片和茎杆为主[14-15]。采用室内离体叶片菌丝体接种法,通过接种相同时间内不同菌株侵染得到的病斑直径大小测定菌株的致病力差异。供试菌株先在PDA培养基上活化相同时间,取直径0.5 cm菌丝块转接在新PDA平板培养72 h,沿菌落外缘打取直径0.5 cm的菌块。温室提前种植大豆盆栽(垦丰41),摘取带有叶柄的同时期同位置的健康大豆叶片,一般选择三出复叶中间卵状复叶,将菌块着生菌丝一面避开叶脉贴在叶片表面,接种后用手轻微按压,确保菌块不掉落,每个菌株设3次重复,设置空白PDA菌块为对照试验。接种叶片统一盛放在铺有湿润无菌纱布的托盘中,湿润脱脂棉包裹叶柄保湿,保鲜膜覆盖托盘表面,25 ℃培养72 h后调查发病情况,根据十字交叉法测定病斑直径,记录不同菌株侵染后病斑直径大小。按照下列公式计算病斑直径及平均值。
病斑直径(cm)=病斑整体直径(cm)-菌块直径(cm)
1.3 强弱致病力差异菌株体内氧化酶活性的测定
选择致病力差异较大的菌株进行氧化酶活性测定。
方法参照《植物生理生化实验原理和技术》[16],具体试验步骤有改动。
菌丝的收集:将直径0.5 cm 新鲜菌块接种到铺有灭菌玻璃纸的PDA培养基中心,25 ℃培养箱中培养,每菌株设3次重复,菌株生长时间与致病力分化试验的培养时间一致。培养72 h后,无菌环境下刮取玻璃纸上生长的菌丝,收集存放在5 mL离心管中。离心管中加入1 mL無菌蒸馏水,放于室温下静置4 h,离心机10 000 r/s离心2 min,取上清液,即为粗酶液,如不立即试验需放置在-80 ℃冰箱保存。
按照POD 测试盒(购自上海酶联生物技术有限公司)说明书的方法,严格按照操作步骤进行过氧化物酶(POD)活性测定。
按照SOD 测试盒(购自上海酶联生物技术有限公司)说明书的方法,严格按照操作步骤进行SOD酶活性测定。
按照CAT 测试盒(购自上海酶联生物技术有限公司)说明书的方法,严格按照操作步骤进行测定。
1.4 数据分析
试验数据用Excel 2013及SPSS 22.0 软件进行处理并进行单因素方差分析。
2 结果与分析
2.1 核盘菌致病力分化
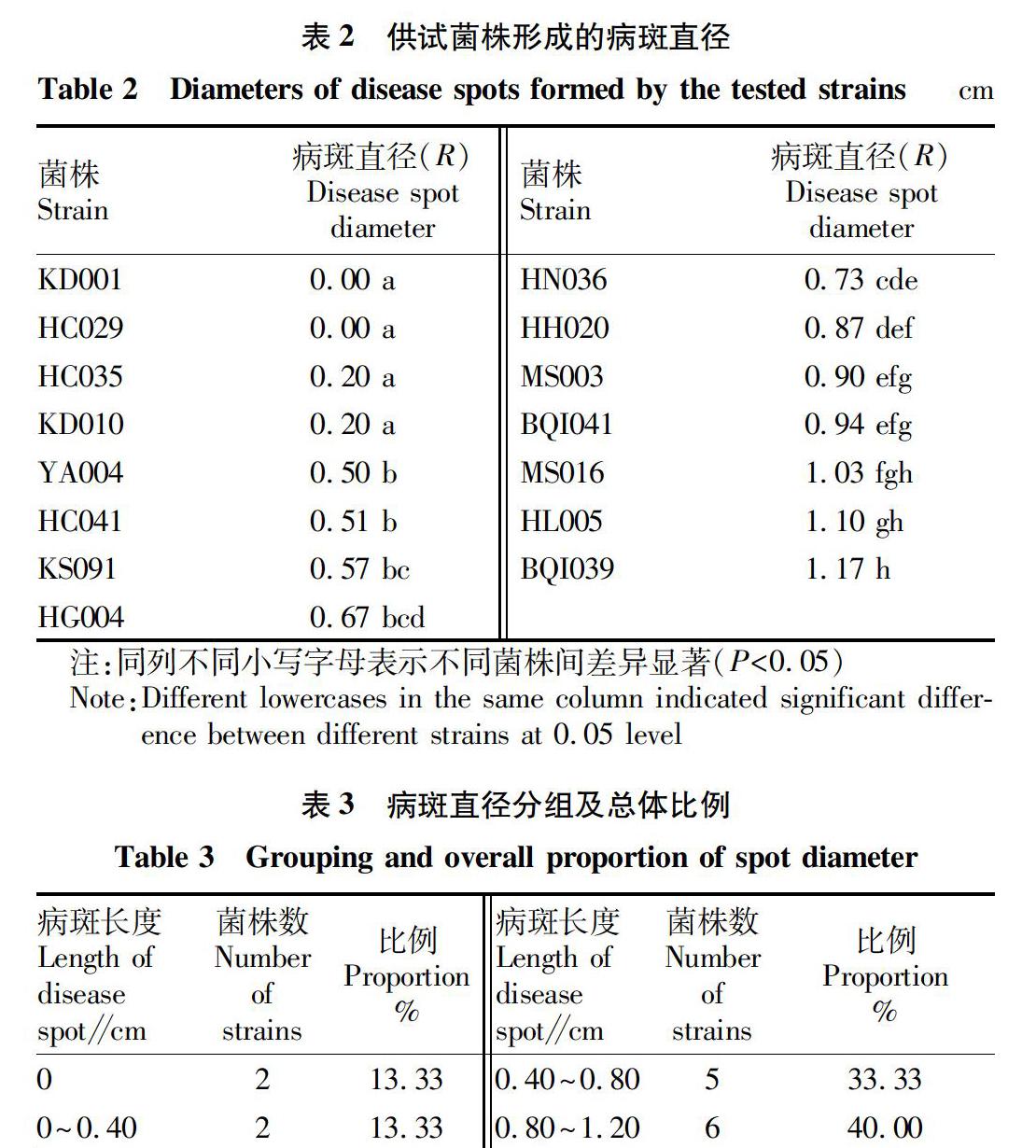
供试菌株离体叶片接菌试验得到的病斑直径均值见表2。由表2可知,病斑直径最小值为0 cm,接种后叶片无病斑,菌块着生的气生菌丝变长,接触叶片部位未发病;最大病斑直径是1.17 cm,叶片表面病斑明显,病部叶片颜色变黑、软烂。按照病斑直径从小到大顺序对供试菌株排序,菌株KD001、HC029、HC035、KD010和YA004形成病斑直径≤0.50 cm,其中菌株KD001和HC029未形成病斑;菌株HC041、KS091、HG004、HN036、HH020、MS003和BQI041形成病斑直径在0.50~1.00 cm,菌株MS016、HL005和BQI039形成病斑直径较大均≥1.00 cm。根据多重比较结果可知,致病力最强BQI039和最弱菌株KD001和HC029之间致病力差异最显著。供试菌株根据差异显著性被分成8组,组间差异较大。由表3可知,致病性强菌株占供试菌株比例较大,侵染病斑直径超过0.80 cm的菌株,占总供试菌株的比例最大(40.0%);病斑直径超过0.40 cm的菌株有11株,占比为73.33%;而侵染病斑直径在0~0.40 cm的致病力较弱菌株,仅有4株,占总菌株的26.66%。菌株形成病斑直径差异反映出致病力强弱菌株间差异较大,也表明核盘菌菌株致病力存在分化现象。
对供试核盘菌菌株致病力测定数据的F检验结果表明,核盘菌菌株间致病力分化明显,菌株间致病力存在极显著差异,黑龙江地区引起大豆病害的核盘菌菌株存在致病力差异。结合表1菌核采集地点,相同来源地菌株HC029、HC035和HC041的病斑直径分别是0、0.20、0.51 cm;致病力最强的菌株BQI039与相同采集地的菌株BQI041,病斑直径差为0.23 cm;菌株KD001和HC029,菌株HC035和KD010的来源地均不同,但致病力表现相同。综合上述情况,黑龙江省核盘菌菌株致病力与菌株来源地无明显相关性。
2.2 强弱致病力差异菌株体内氧化酶活性
2.2.1 CAT活性与致病力关系。
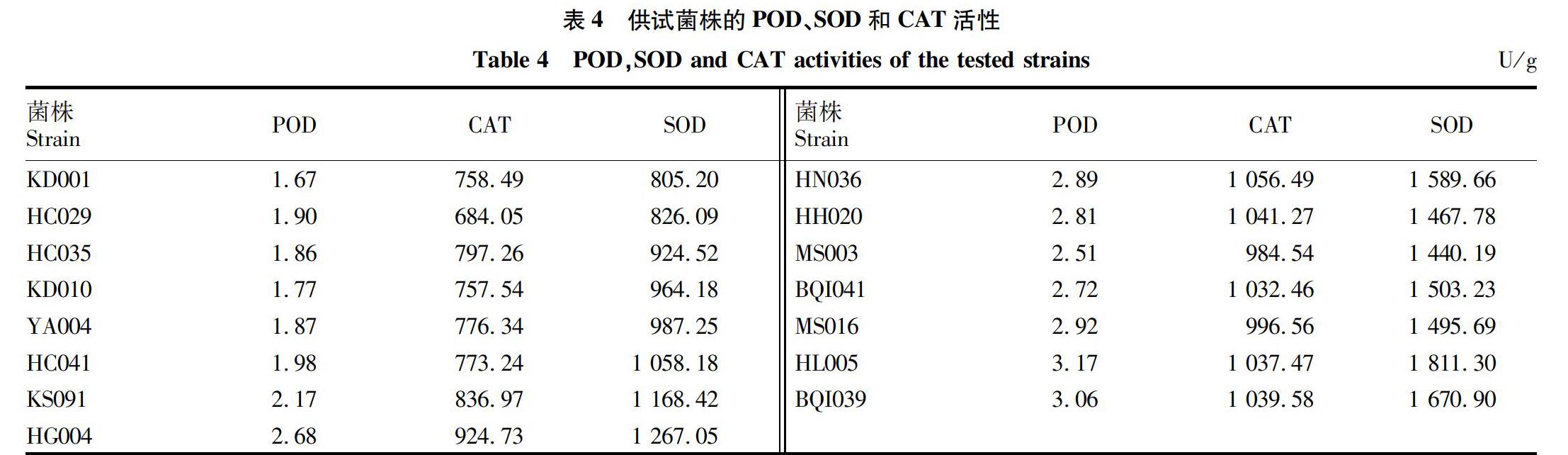
供试菌株中,CAT活性在684.05~1 056.49 U/g(表4),由菌株间CAT活性整体趋势可知,菌株致病力强,则菌株CAT活性强。其中,菌株KD001、HC035、HN036、HH020和MS016 CAT活性在总体起伏变化中与致病力强弱规律不相符,超过30%的供试菌株CAT活性与致病力无明显相关性,66.7%供试菌株的致病力强酶活性表现较强。致病力表现一致的菌株KD001和HC029,CAT活性分别是758.49和684.05 U/g,相差74.44 U/g;菌株HC035和KD010的致病力表现也相同,菌株酶活之差是39.72 U/g,酶活强弱未能体现菌株致病力相同的特性。综合上述情况,核盘菌菌株CAT活性总体趋势与菌株致病力有一定的相关性,菌株CAT活性与致病性表现未完全一致,两者相关性不显著。
2.2.2 SOD活性与致病力的关系。
供试菌株SOD活性在805.20~1 811.30 U/g,酶活性最大值与最小值差超过1 000 U/g,菌株间酶活性差异较大。接种形成病斑直径>0.5 cm的菌株,其SOD活性>1 000 U/g;病斑直径>1.0 cm的菌株,其酶活性均>1 500 U/g。按照致病力从弱到强顺序排列菌株,将菌株的酶活性制成柱形图观察(图1),菌株致病力强则菌株体内SOD活性越大。供试菌株中仅有菌株HN036和HL005较致病力相似菌株的酶活性高,未完全符合酶活性与致病力的关系,仍比致病力弱的菌株酶活大;菌株HH020酶活略高于致病力较强的菌株MS003;菌株KD001和HC029、菌株HC035和KD010致病力表现一致,菌株的SOD活性相近。供试12个菌株的SOD活性与菌株的致病力呈正相关,达供试菌株的80%,致病力强的核盘菌菌株,自身的SOD酶活性较大。
2.2.3 POD活性与致病力的关系。
由图2可知,供试菌株POD活性较小,最大值未超过3.2 U/g。菌株接种形成病斑直径≤0.5 cm,酶活性≤2.0 U/g;病斑直径>0.5 cm,酶活性>2.0 U/g;病斑直径>1.1 cm,酶活性>3.0 U/g。致病力最强菌株的POD活性是3.06 U/g,致病力最弱菌株酶活性为167 U/g,致病力强菌株的对应酶活性较大,致病力弱菌株对应酶活性较小,致病力差异菌株的POD活性也存在差异。菌株KD001和HC029致病力表现相同,菌株HC029酶活性高于KD001 0.23 U/g;菌株HC035与KD010致病力表现相同,菌株HC035酶活性较菌株KD010高0.09 U/g。菌株HC029、HC035、HG004、HN036、HH020和HL005酶活性增加幅度过大,略高于同致病力及致病力较强菌株,15株菌株中有60%的菌株完全符合菌株致病力强则菌株内POD活性较大的规律。供试菌株POD活性与致病力存在相关性,致病力强的菌株,酶活性亦较强。核盘菌菌株致病力强,菌株体内POD活性大,随着致病力增长酶活性总体呈上升趋势。
2.2.4 核盘菌体内酶活性变化。
由图3可知,CAT活性变化平缓,供试菌株的酶活性集中在600~1 100 U/g,酶活性最高值是菌株HH020的1 056.49 U/g,最低值是HC029为684.05 U/g,CAT活性最高值与致病力最强菌株不对应,活性最低菌株与致病力最弱菌株相对应,菌株间CAT活性变化不明显。供试菌株间SOD活性变化较大,活性最低值来自致病力最弱的菌株KD010,为805.2 U/g;活性最高为1 811.3 U/g,来自菌株致病力第二强的菌株HL005,致病力最强菌株活性第二高;菌株间酶活性变化较大,变化幅度超过1 000 U/g,CAT及SOD 2组酶活性变化趋势相关性不显著。
POD活性在1.67~3.17 U/g,酶活性最小值与致病力最弱菌株相一致,酶活性最大值来自致病性第二强的菌株HL005,致病力最强菌株酶活性为3.06 U/g,且与最大酶活性相差较小。POD活性最值与SOD最值来源菌株一致,POD整体变化趋势与SOD活性变化规律相似,核盘菌菌株体内SOD及POD活性表现总体趋势一致。
3 结论与讨论
15个供试菌株中有13个菌株72 h可侵染大豆叶片使其发病,接种后病斑大小差异为菌株致病力分化表现,核盘菌菌株间致病力存在明显差异。黑龙江大豆菌核病菌株的致病力差异明显,该地区核盘菌致病力存在分化现象,且核盘菌种群内致病性分化明显。导致大豆菌核病菌菌株致病力分化原因较多,除环境因素外,菌株致病力分化可能与菌株本身的特质密切相关。多地点来源样品比较发现,同一来源地的菌株存在致病力差异;致病力表现相同菌株来自不同地点,核盘菌致病力差异与地域性不相关[17-18]。
供试核盘菌菌株内抗氧化酶系统中CAT、SOD、POD活性与菌株的致病力有一定相关性,菌株体内3组酶的变化趋势与菌株致病力强弱表现存在相关性,超过60%供试菌株符合致病力越强,酶活性越大。3组酶中,菌株间SOD活性差异最大,与菌株致病力相关性最大,80%供试菌株符合致病力越强,菌株体内SOD活性越强;菌株内POD与SOD活性变化总体趋势一致,超过60%的菌株致病力强弱与酶活性强弱正相关;菌株间CAT活性变化不大,且CAT与SOD活性变化趋势相关性不显著,菌株CAT活性与致病力表现未完全一致,仍有待进一步验证。
参考文献
[1] 王云龙.浅析大豆菌核病发病原因及防治重点[J].农业与技术,2018,38(18):33.
[2] 李宪伟.大豆病虫害防治技术浅析[J].农民致富之友,2015(23):94.
[3] 羊国根,程家森.核盘菌致病机理研究进展[J].生物技术通报,2018,34(4):9-15.
[4] BOLAND G J,HALL R.Index of plant hosts of Sclerotinia sclerotiorum[J].Can J Plant Pathol,1994,16(2):93-108.
[5] ADAMS P B, AYERS W.Ecology of Sclerotinia species[J].Phytopathology,1979,69(8):896-899.
[6] 唐庆华,宋薇薇,朱辉,等.大豆菌核病及其病原核盘菌研究进展[C]∥中国植物病理学会.中国植物病理学会2011年学术年会论文集.北京:中国农业科学技术出版社,2011:58-64.
[7] 母玉翠.核盘菌(Sclerotinia sclerotiorum)致病性分化的生化機制研究[D].合肥:安徽农业大学,2013.
[8] 黄娟,李国庆.两株毒力不同的核盘菌产草酸、果胶酶的比较[J].氨基酸和生物资源,2008,30(2):5-8.
[9] POUSSEREAU N,CRETON S,BILLONGRAND G,et al.Regulation of acp1,encoding a nonaspartyl acid protease expressed during pathogenesis of Sclerotinia sclerotiorum[J].Microbiology,2001,147(3):717-726.
[10] POUSSEREAU N,GENTE S,RASCLE C,et al.aspS encoding an unusual asparty1 protease from Sclerotinia sclerotiorum is expressed during phytopathogenesis[J].FEMS Microbiology Letters,2001,194(1):27-32.
[11] 刘勇,布朗·霍尔腾斯.油菜苗期室内抗菌核病性研究——Ⅰ.离体叶片子囊孢子接种鉴定[J].西南农业学报,1993,6(S1):74-78.
[12] 刘勇,布朗·特伯德.油菜菌核病田间抗性鉴定和筛选——I.火柴棍茎杆菌丝接种法[J].西南农业学报,1993,6(S1):42-46.
[13] 刘胜毅,周必文,潘家荣.油菜对毒素草酸的吸收代谢与抗性机理[J].植物病理学报,1998,28(1):33-37.
[14] KULL L S,VUONG T D,POWERS K S,et al.Evaluation of resistance screening methods for Sclerotinia stem rot of soybean and dry bean[J].Plant disease,2003,87(12):1471-1476.
[15] 刘丹,李沛利,严吉明,等.核盘菌致病性测定方法研究[J].安徽农业科学,2011,39(30):18627-18629.
[16] 王学奎.植物生理生化实验原理和技术[M].2版.北京:高等教育出版社,2006:134-136.
[17] 李建厂,李永红,陈文杰,等.向日葵核盘菌菌株致病性研究及其温度效应[J].西北农业学报,2003,12(1):114-117.
[18] 李沛利,叶华智.核盘菌致病性分化研究[J].植物保护,2006,32(5):29-31.
