黄瓜CsGPX基因克隆与细菌性角斑病胁迫下的表达分析
2021-04-29孟令波孙婷婷赵倩胡宝忠
孟令波 孙婷婷 赵倩 胡宝忠


摘要 [目的]克隆CsGPX基因并研究其与黄瓜抗病性的关系。[方法]采用RT-PCR技术克隆黄瓜CsGPX基因cDNA序列全长,并对其进行生物信息学分析;采用荧光定量PCR的方法分析CsGPX基因在细菌性角斑病侵染0~96h下的表达情况。[结果]CsGPX基因cDNA序列全长914bp,包含一个513bp的开放阅读框,编码170个氨基酸,该基因编码蛋白的相对分子质量约为19.02kD,理论等电点是8.66,为亲水性蛋白,不具有跨膜结构,不含信号肽序列。实时荧光定量PCR分析表明,CsGPX在黄瓜叶中有表达。在黄瓜细菌性角斑病菌侵染下,该基因在黄瓜叶中表达增高,明显受黄瓜细菌性角斑病菌的诱导。[结论]CsGPX基因的分子鉴定为进一步解析该基因在黄瓜抗病机制方面的作用提供重要依据。
关键词 黄瓜;谷胱甘肽过氧化物酶;基因克隆;细菌性角斑病;荧光定量PCR
中图分类号 S.436.421文献标识码A
文章编号0517-6611(2021)07-0099-04
Abstract[Objective]TocloneCsGPXgeneandstudytherelationshipbetweenCsGPXgeneanddiseaseresistanceofcucumber.[Method]TheCsGPXgenecDNAfulllengthsequencewasclonedbyRT-PCRtechnology.CharacteristicsincludingthephysicochemicalpropertiesandconserveddomainofthededucedCsGPXproteinweredeterminedbyaseriesofbioinformaticstools.qRT-PCRtechnologywasperformedtomeasurethetranscriptlevelsofCsGPXgeneinducedbyP.syringaepv.Lachrymans.[Result]ThefulllengthnucleotidesequenceofCsGPXwas914bp,containingacompleteopenreadingframeof513bpwhichencodedapolypeptideof170aminoacids.Bioinformaticsanalysisoftheaminoacidsequenceshowedthatthemolecularweightofencodedproteinwas19.02kD,andtheoreticalisoelectricpointwas8.66.Thisproteinwasahydrophilicprotein,withouttransmembraneandsignalpeptidesequence.TheexpressionanalysesofthegenebyqRT-PCRshowedthattheCsGPXexpressdinCucumberleaves.InducedbyP.syringaepv.Lachrymans,thetranscriptlevelsofCsGPXincucumberleavesremarkablyincreasedwiththeextensionofinductiontime.[Conclusion]ThisstudylaidafoundationforprovidingimportantbasisforCsGPXgeneondiseaseresistancemechanismofcucumber.
KeywordsCucumber;Glutathioneperoxidase;Genecloning;Pseudomonassyringaepv.Lachrymans;RealtimefluorescencequantitativePCR
作者簡介 孟令波(1970—),男,黑龙江哈尔滨人,副教授,博士,从事蔬菜遗传育种与土壤微生物研究。*通信作者,教授,博士,从事植物学和植物分子生物学研究。
植物是好氧的生物体,在呼吸和光合作用过程中,线粒体、叶绿体和过氧化物酶体均可导致活性氧(reactiveoxygenspecies,ROS)的产生,尤其在外界环境胁迫下,活性氧含量大大增加[1]。为了避免ROS过量积累所造成的损伤,植物细胞内的防御系统(包括酶促和非酶促解毒系统)发挥了重要的作用。其中,酶促系统主要包括过氧化氢酶、超氧化物歧化酶、抗坏血酸过氧化物酶和谷胱甘肽过氧化物酶等[2-3]。其中,谷胱甘肽过氧化物酶(glutathioneperoxidase,GPX)是机体内清除活性氧自由基的主要酶类,起到保护细胞免受氧化胁迫的作用,具有重要的生理功能[4]。人们对GPX的认识最早从动物开始,1957年,Mills[5]在提取哺乳动物红细胞中的酶试验H2O2反应时发现的。由于哺乳动物中的GPX利用谷胱甘肽(GSH)为电子供体还原H2O2及有机氢过氧化物等,故GPX名称由此而来。相比之下,人们对植物GPX的研究开始较晚。第一个植物GPX的cDNA最早是从烟草中获得[6],后来相继在拟南芥[7]、水稻[8]、番茄[9]、菠菜[10]、小麦[11]、茶树[12]等植物中分离到GPX基因。近年来,对于植物GPXs的研究主要集中在生物胁迫(感染细菌、真菌或病毒)和非生物胁迫(如高温、低温、干旱、重金属毒害、耐盐等)方面。在生物胁迫条件下,RoeckelDrevet等[13]研究发现,当向日葵被一种霜霉病(Plasmoparahalstedii)感染后,GPXs基因的表达丰度显著增加;Saidi等[14]研究发现,枣椰树感染脆叶病(Brittleleafdisease)后,GPXs基因的表达水平在患病的根、叶中显著提高。这些研究结果表明,在植物应对病害胁迫的过程中,GPXs基因可能发挥作用。
黄瓜细菌性角斑病于20世纪70年代在我国严重暴发,目前已是我国乃至世界上影响黄瓜生长的重要病害之一[15],发病率在30%~50%,严重时可使植株中下部叶片全部坏死。目前黄瓜与细菌性角斑病相互作用的分子机理仍不清楚。该研究利用黄瓜叶cDNA文库数据获得了CsGPX编码区全长序列,并对该序列进行生物信息学分析,预测其功能。在此基础之上,采用qRT-PCR技术对黄瓜细菌性角斑病菌不同时间诱导下CsGPX基因的表达模式进行深入分析,以期为探求黄瓜的抗病机制提供科学依据。
1材料与方法
1.1材料试验中采用的黄瓜(CucumissativusL.)为抗病品種D0462,由东北农业大学园艺学院培育;细菌性角斑病(Pseudomonassyringaepv.Lachrymans)由东北农业大学园艺学院惠赠。诱导试验在黄瓜3片真叶期开展,用喷雾器将1×108CFU/mL菌悬液均匀喷至叶面密布水珠但不流动为可。病原菌诱导0、8、24、48、72、96h后收集叶片,用无菌水冲洗3遍,滤纸吸干,迅速置于液氮中后于-80℃冰箱备用。
1.2方法
1.2.1黄瓜总RNA提取。
采用植物总RNA提取试剂盒提取黄瓜抗病品种D0462总RNA,具体步骤参照说明书进行。提取总RNA后采用0.8%琼脂糖凝胶电泳检测其完整性,并用核酸分析仪检测RNA的纯度和浓度。
1.2.2CsGPX全长cDNA克隆。
根据前期所构建的黄瓜叶片cDNA文库[16],筛选获得谷胱甘肽过氧化酶GPX基因cDNA全长序列并设计引物CF1、CR1(表1),以黄瓜cDNA为模板进行PCR扩增,反应体系(50μL):2×PCRMix25μL,正反引物CF1、CR1(20μmol/L)各1μL,cDNA模板2μL,不足的部分用ddH2O补足。PCR扩增条件:94℃预变性5min;94℃30s、57℃40s、72℃1min,35个循环;最后72℃延伸10min。将PCR产物送生物公司测序。
1.2.3序列分析。
使用NCBI中的开放阅读框(openreadingframe,ORF)程序查找序列的ORF。分析ORF编码的氨基酸序列采用ExPASy服务器上的ProtParamtool软件(http:∥www.expasy.ch/cgi-bin/protparam)。CsGPX蛋白跨膜区、信号肽的预测和分析分别采用TMHMM(http:∥www.cbs.dtu.dk/services/TMHMM/)、Signalp5.0(http:∥www.cds.dtu.dk/services/signal.p/)。通过NCBI中CDD程序(https:∥www.ncbi.nlm.nih.gov/cdd/)对CsGPX氨基酸序列的保守结构域进行分析。用Netphos3.1server(http:∥www.cbs.dtu.dk/services/NetPhos-3.1/)对CsGPX氨基酸序列进行潜在磷酸化位点分析。分别用Plant-mPloc(http:∥www.csbio.sjtu.edu.cn/bioinf/plant-multi/)和psortprediction(https:∥www.psort.hgc.jp/form.html)对CsGPX进行亚细胞定位分析。利用SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/sopma.html)对CsGPX氨基酸序列进行二级结构分析,CsGPX三级结构采用SWISS-model(https:∥swissmodel.expasy.org/)预测。
1.2.4荧光定量PCR分析。
采用qRT-PCR方法,对经黄瓜细菌性角斑病菌不同时间诱导下的CsGPX基因的表达情况进行检测,分别提取侵染0、8、24、48、72、96h处理的黄瓜叶总RNA,反转录合成cDNA,取2μLcDNA为模板,加入SYBRPremixExTaqTM(2×)10μL,具体按宝生物工程大连有限公司说明书操作。在AgilentMx3000P型核酸扩增荧光检测仪上进行RT-PCR,用于定量PCR的CsGPX基因的特异性引物(CF-qRT、CR-qRT)及内参引物(18S-F、18S-R)见表1。PCR反应条件:94℃预变性30s;94℃12s,56℃30s,72℃30s,40个循环,读板温度为81℃,扩增完成后采用2-ΔΔCt进行计算[17]。
2结果与分析
2.1总RNA的提取及检测
提取黄瓜叶片总RNA,检测结果如图1所示,28SrRNA的亮度大约是18SrRNA的2倍,说明黄瓜总RNA完整性较好;经核酸蛋白检测仪测得OD260/OD280比值为1.88,介于1.8~2.1,表明提取的RNA纯度较高,可用于后续试验。
2.2CsGPX基因全长cDNA的获得
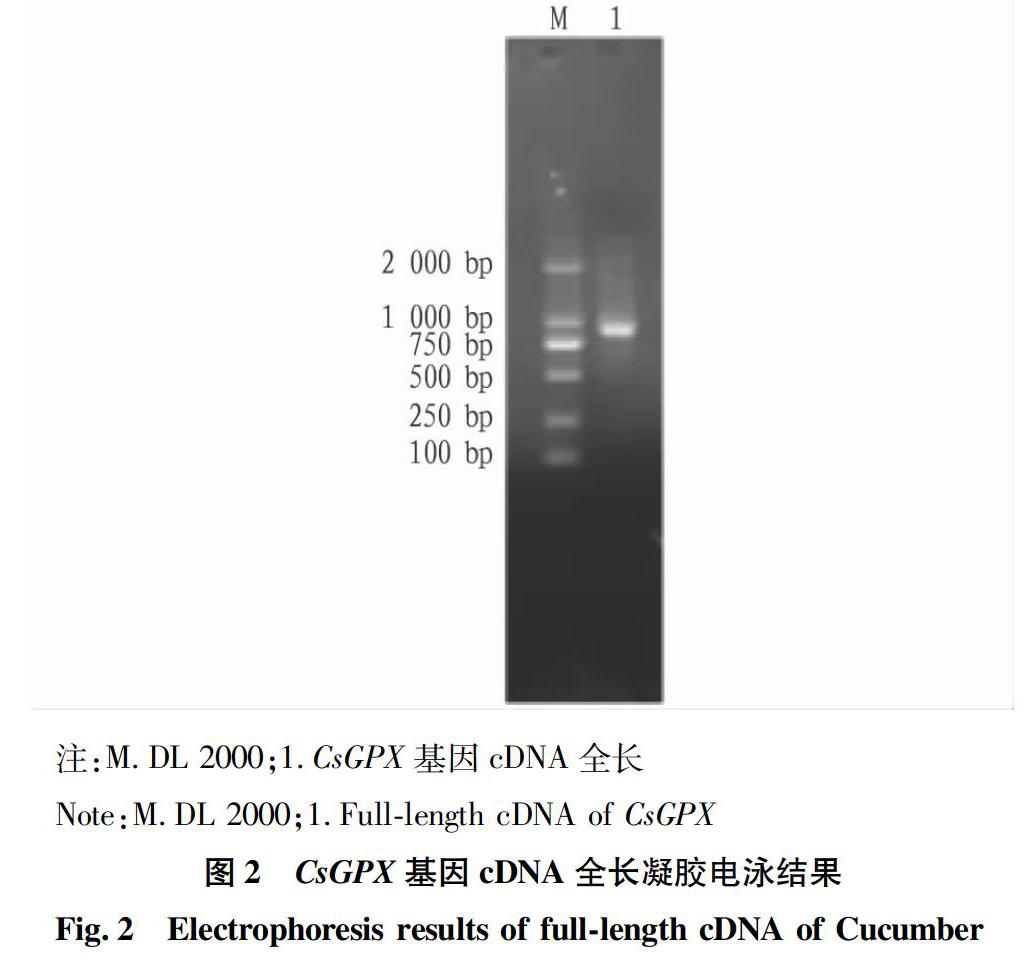
以黄瓜cDNA为模板,用特异性引物进行PCR扩增。由图2可知,在1000bp附近得到1条CsGPX基因的特异片段,与预期大小相符。PCR产物经回收纯化、测序后得到长度为914bp的序列。
2.3CsGPX全长序列分析
根据CsGPX全长测序结果,利用NCBI网站上的ORFFinder进行开放阅读框查找,发现CsGPX的cDNA序列全长914bp,其中包含513bp的开放阅读框,23bp的5′非翻译区以及378bp的3′非翻译区,编码170个氨基酸,起始密码子为ATG,终止密码子为TAA(图3)。通过与拟南芥的GPXs家族成员比较,发现有3个保守程度较高的特征结构域分别为VNVASKCGYT、ILAFPCNQF、KWNFTKFL,同时这3个结构域也是GPX的特征性基序。
2.3.1理化性质分析。
通过Protparam对CsGPX进行分析可知其分子式为C858H1341N223O257S4,相对分子质量为19.02kD,等电点(pI)为8.66,不稳定参数为24.23,蛋白质性质稳定(标准:40以下为稳定蛋白)。该蛋白中相对含量较多的氨基酸是Lys(10.0%,17个)、Leu(8.2%,14个)、Thr(7.6%,13个)。总的带负电荷残基(Asp+Glu)为19,总的带正电荷残基(Arg+Lys)为22。亲水性平均系数为-0.369,预测该蛋白为亲水性蛋白,其脂肪系数为78.00。TMHMM2.0分析显示CsGPX无跨膜结构域。Signalp5.0分析结果表明该蛋白无信号肽。将CsGPX與部分拟南芥GPXs家族成员的理化性质进行比较,结果显示CsGPX与AtGPX4在编码氨基酸个数、等电点、相对分子质量、所带正负电荷氨基酸的数量等方面均较相似(表2),因此可以推断黄瓜CsGPX与AtGPX4可能具有相似的功能。
2.3.2保守结构域、磷酸化位点、亚细胞定位的分析。
通过NCBI中CDD程序对CsGPX氨基酸序列的保守结构域分析结果(图4)显示,该基因所表达的蛋白质具有典型的保守结构域GSH_Peroxidase,属于硫氧还原蛋白超家族(thioredoxin-likesuperfamily)。用Netphos3.1server对CsGPX氨基酸序列进行潜在磷酸化位点分析,预测结果显示,潜在的磷酸化位点位于Ser、Thr和Tyr3个氨基酸上,其中Ser为8,Thr为6,Tyr为3,共17个磷酸化位点。分别用PlantmPloc和psortprediction进行CsGPX的亚细胞定位,CsGPX可能在叶绿体、细胞质、线粒体等位置。
2.3.3蛋白质二级、三级结构的预测。
利用SOPMA对CsGPX氨基酸序列进行分析,其结果显示CsGPX是由无规则卷曲、α螺旋、β转角、延伸链等组成,其中,无规则卷曲(41.18%)为主要结构,无规则卷曲存在的部位往往与该蛋白质分子维持空间构象有着重要的联系。
用SWISS-model对CsGPX的三级结构进行预测。由图5(A)可看出,CsGPX有4个α螺旋和6个β折叠,与植物中GPX的经典结构一致;图5(B)中3个带黄色标记的是半胱氨酸位点,通过这个位置容易与氢过氧化物类的底物相结合,从而消除机体内过多的活性氧自由基。
2.4黄瓜CsGPX基因的表达特性分析
采用qRT-PCR方法分析经黄瓜细菌性角斑病菌诱导不同时间的CsGPX基因表达情况。结果如图6所示,该基因在0~96h的表达水平呈现先升高(0~24h)后降低(24~48h)再升高(48~96h)的变化趋势。整体看,CsGPX基因受病原菌诱导后(8~96h)的表达量均高于对照,最高可达对照表达量的363.5倍。由此说明,CsGPX基因明显受黄瓜细菌性角斑病菌的诱导,推测该基因可能参与黄瓜细菌性病害的防御,在抵御生物胁迫中发挥作用。
3讨论与结论
GPXs是生物体内至关重要的活性氧自由基清除剂,可催化谷胱甘肽(GSH)转化为氧化型谷胱甘肽(GSSG),将有毒的过氧化物还原成无毒的羟基化合物,同时也可以促进H2O2的分解,从而保护细胞膜的结构及功能不遭受损害[18]。与动物相比,对植物中GPX的研究起步较晚。有研究表明,GPX氨基酸序列携带的是一个半胱氨酸残基,替代了动物基因组GPX核苷酸UGA终止密码子处插入的硒代半胱氨酸[19],即植物中的GPX蛋白不含有硒。GPXs常作为植物抗逆指标,用来反映植物的氧化胁迫伤害程度和评价该植物的抗逆能力。当植物遭受病原菌侵染[13]、高盐[20]、重金属[21]、干旱[22]、低温[23]等不同生物和非生物胁迫时,多数GPX的表达及活性会增强。目前,对植物GPXs的研究多集中在非生物胁迫中的功能作用。如烟草中过量表达NtGPX基因能够减少活性氧导致的膜损伤,提高烟草的耐盐性及抗冻性[24]。番茄中过表达LePHGPX基因可提高其耐高温胁迫的能力[25]。而有关于GPXs在生物胁迫中的功能作用研究相对较少。
黄瓜细菌性角斑病是黄瓜的一类重要细菌性病害,近年来,黄瓜细菌性角斑病几乎遍布全国各个黄瓜产区,严重时可导致整个温室的黄瓜发病死亡,发病率达100%[26]。目前黄瓜细菌性角斑病以化学防治为主,然而化学防治一方面会给环境和人类带来危害,另一方面还会引起病原物的抗药性,加重该病害防治的难度。因此,深入了解寄主植物与病原物的互作关系可为黄瓜细菌性角斑病的有效防治提供参考。
该研究通过对黄瓜CsGPX基因cDNA全长序列进行克隆和分析,获得全长cDNA序列914bp,包含一个513bp的开放阅读框,编码170个氨基酸,蛋白质性质稳定。通过与拟南芥GPXs比较发现,CsGPX与拟南芥具有相似的典型保守结构,无信号肽和跨膜结构,共有17个磷酸化位点,一般来说,氨基酸序列中的磷酸化位点越多,该蛋白越可能会发挥更多功能[27]。根据CsGPX的亚细胞定位可以推测该基因可能与光合作用、生理生化反应、能量传递、信号转导等有关。为进一步了解CsGPX在黄瓜抗病方面的功能,深入分析细菌性角斑病菌侵染下黄瓜CsGPX基因的表达模式,发现CsGPX的表达显著提高,最高可达对照表达量的363.5倍,说明该基因明显受黄瓜细菌性角斑病菌的诱导。该结果可为研究CsGPX基因在黄瓜抗病方面的功能以及解析黄瓜与病原物互作网络提供重要依据。
参考文献
[1]RODRIGUEZMILLAMA,MAURERA,RODRIGUEZHUETEA,etal.GlutathioneperoxidasegenesinArabidopsisareubiquitousandregulatedbyabioticstressesthroughdiversesignalingpathways[J].PlantJ,2003,36(5):602-615.
[2]杜秀敏,殷文璇,赵彦修,等.植物中活性氧的产生及清除机制[J].生物工程学报,2001,17(2):121-125.
[3]苗雨晨,白玲,苗琛,等.植物谷胱甘肽过氧化物酶研究进展[J].植物学通报,2005,40(3):350-356.
[4]FLOHL,GNZLERWA.Assaysofglutathioneperoxidase[J].MethodsEnzymol,1984,105(1):114-121.
[5]MILLSGC.Hemoglobincatabolism:I.Glutathioneperoxidase,anerythrocyteenzymewhichprotectshemoglobinfromoxidativebreakdown[J].JBiolChem,1957,229(1):189-197.
[6]CRIQUIMC,JAMETE,PARMENTIERY,etal.IsolationandcharacterizationofaplantcDNAshowinghomologytoanimalglutathioneperoxidases[J].PlantMolBiol,1992,18(3):623-627.
[7]SUGIMOTOM,SAKAMOTOW.PutativephospholipidhydroperoxideglutathioneperoxidasegenefromArabidopsisthalianainducedbyoxidativestress[J].GenesGenetSyst,1997,72(5):311-316.
[8]LIWJ,FENGH,FANJH,etal.MolecularcloningandexpressionofaphospholipidhydroperoxideglutathioneperoxidasehomologinOryzasativa[J].BiochimetBiophysActa(BBA)GeneStructExpr,2000,1493(1/2):225-230.
[9]DEPEGEN,DREVETJ,BOYERN.MolecularcloningandcharacterizationoftomatocDNAsencodingglutathioneperoxidaselikeproteins[J].EurJBiochem,1998,253(2):445-451.
[10]SUGIMOTOM,FURUIS,SUZUKIY.MolecularcloningandcharacterizationofacDNAencodingputativephospholipidhydroperoxideglutathioneperoxidasefromspinach[J].BiosciBiotechnolBiochem,1997,61(8):1379-1381.
[11]張蕾,于永昂,张明霞,等.小麦GPX基因的克隆及植物表达载体构建[J].贵州农业科学,2015,43(4):31-34.
[12]刘赛,刘硕谦,龙金花,等.茶树谷胱甘肽过氧化物酶编码基因CsGPX1功能分析[J].茶叶科学,2019,39(4):382-391.
[13]ROECKELDREVETP,GAGNEG,DELABROUHEDT,etal.Molecularcharacterization,organdistributionandstressmediatedinductionoftwoglutathioneperoxidaseencodingmRNAsinsunflower(Helianthusannuus)[J].PhysiolPlant,1998,103(3):385-394.
[14]SAIDIMN,JBIRR,GHORBELI,etal.Brittleleafdiseaseinducesanoxidativestressanddecreasestheexpressionofmanganeserelatedgenesindatepalm(PhoenixdactyliferaL.)[J].PlantPhysiolBiochem,2012,50(1):1-7.
[15]孙福在,何礼远.黄瓜细菌性角斑病病原菌与寄主范围鉴定[J].植物病理学报,1988,18(1):23-28.
[16]刘关君,王丽娟,秦智伟,等.黄瓜叶片细菌性角斑病侵染初期cDNA文库分析[J].遗传,2009,31(10):1042-1048.
[17]LIVAKKJ,SCHMITTGENTD.AnalysisofrelativegeneexpressiondatausingrealtimequantitativePCRandthe2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[18]齐增园,陶鹏,李必元,等.白菜谷胱甘肽过氧化物酶基因GPX的鉴定与分析[J].浙江农业学报,2016,28(1):64-69.
[19]ESHDATY,HOLLANDD,FALTINZ,etal.Plantglutathioneperoxidases[J].PhysiolPlant,1997,100(2):234-240.
[20]HOLLANDD,BENHAYYIMG,FALTINZ,etal.Molecularcharacterizationofsaltstressassociatedproteinincitrus:ProteinandcDNAsequencehomologytomammalianglutathioneperoxidases[J].PlantMolBiol,1993,21(5):923-927.
[21]NAVROTN,COLLINV,GUALBERTOJ,etal.Plantglutathioneperoxidasesarefunctionalperoxiredoxinsdistributedinseveralsubcellularcompartmentsandregulatedduringbioticandabioticstresses[J].PlantPhysiol,2006,142(4):1364-1379.
[22]FERREIRANETOJRC,PANDOLFIV,GUIMARAESFC,etal.Earlytranscriptionalresponseofsoybeancontrastingaccessionstorootdehydration[J].PLoSOne,2013,8(12):1-20.
[23]KIMYJ,JANGMG,NOHHY,etal.MolecularcharacterizationoftwoglutathioneperoxidasegenesofPanaxginsengandtheirexpressionanalysisagainstenvironmentalstresses[J].Gene,2014,535(1):33-41.
[24]ROXASVP,LODHISA,GARRETTDK,etal.StresstoleranceintransgenictobaccoseedlingsthatoverexpressglutathioneStransferase/glutathioneperoxidase[J].PlantCellPhysiol,2000,41(11):1229-1234.
[25]CHENSR,VAGHCHHIPAWALAZ,LIW,etal.TomatophospholipidhydroperoxideglutathioneperoxidaseinhibitscelldeathinducedbyBaxandoxidativestressesinyeastandplants[J].PlantPhysiol,2004,135(3):1630-1641.
[26]陳璐.黄瓜细菌性角斑病菌和多主棒孢菌PCR检测技术的建立[D].北京:中国农业科学院,2014.
[27]周立敬,周宜君,高飞,等.拟南芥谷胱甘肽过氧化物酶的生物信息学分析[J].中央民族大学学报(自然科学版),2010,19(2):11-17.
