程序性坏死在髁突软骨退变中的作用
2021-04-28何峰叶涛马原军杨祖阁李天乐仝昕于世宾
何峰 叶涛 马原军 杨祖阁 李天乐 仝昕 于世宾
颞下颌关节紊乱病(temporomandibular disorders, TMD)的人群发病率高达20%~40%,颞下颌关节骨关节炎(temporomandibular joint osteoarthritis, TMJ OA)是其重症形式[1]。关节软骨退变是OA最典型的病理特征之一[2]。 软骨细胞死亡是关节软骨退变中的核心事件,但其确切发病机制尚未完全阐明。目前公认的细胞死亡类型主要有“凋亡”、“自噬”和“坏死”三种[3],在细胞凋亡、自噬进程中不存在细胞内外大规模的物质交流,一般不引起或仅有轻微的周围组织反应;而坏死发生时,细胞器肿胀、细胞膜完整性严重破坏、细胞及其内容物崩解进入周围组织[4-5]。目前程序性坏死(Necroptosis)是研究最多的坏死途径,其发生机制是由肿瘤坏死因子α(tumor necrosis factor α, TNF-α)作用于细胞膜上的肿瘤坏死因子受体启动,在细胞内由受体相互作用蛋白激酶1(receptor-interacting protein kinase 1, RIPK1)和RIPK3传递死亡信号,募集并磷酸化混合系激酶区域样蛋白(mixed lineage kinase domain-like protein, MLKL)形成坏死小体,最终导致细胞死亡、细胞膜破裂[6-7]。细胞膜破裂所释放的内容物将作为损伤相关的分子模式(damage associated molecular patterns, DAMPs),如高迁移率族蛋白1(high mobility group protein B1, HMGB1)等。DAMPs可以在软骨或关节腔内以自分泌或旁分泌的方式诱导周围细胞分泌TNF-α、基质金属蛋白酶(matrix metalloproteinases, MMPs)等促炎/降解因子[8-9],进一步加重软骨细胞死亡及软骨基质降解。但截至目前Necroptosis在TMJ OA中的作用未见报道,本研究应用本实验室建立的髁突软骨退变动物模型,探究软骨细胞Necroptosis在TMJ髁突软骨退变中的作用。
1 材料与方法
1.1 实验动物分组及模型建立
6 周龄雌性SD大鼠48 只(第四军医大学动物中心提供),随机分为Con、E2、UAC和U+E2组,每组12 只。按照报道的方法[10],UAC、U+E2组通过在左侧上、下前牙分别粘接套筒冠,形成不良修复体,从而造成单侧前牙反;Con、E2组实施同样的操作,但最终不粘接不良修复体。 E2、 U+E2组每日上午8:00~9:00腹腔内注射17β-雌二醇(ab120657, E2, Abcam, 英国)80 μg; Con、UAC组注射相同体积的生理盐水。
1.2 取材及组织块的处理
3 周后处死, 将每组中6 只大鼠的双侧TMJ于4%多聚甲醛中固定24 h,脱钙后石蜡包埋切片;另6 只的双侧TMJ于-80 ℃冻存,用于Western blot检测。
1.3 HE染色
石蜡切片常规HE染色,光学显微镜下采集图像,通过Leica Q-win软件测量中带从软骨表面到骨软骨交界处的距离。
1.4 番红O-固绿染色
石蜡切片常规脱蜡至水,1%固绿染色2 min, 1%醋酸酒精漂洗10 s; 1%番红O染色5 min, 95%酒精漂洗15 s; 二甲苯透明,封片。采集图像后每个样本随机选取5 个高倍视野(×100),计算番红O着色面积百分比。
1.5 免疫组化染色
石蜡切片常规脱蜡至水,参照免疫组化试剂盒说明书中描述的SABC法进行免疫组化染色。一抗信息如下:RIPK3抗体(1 ∶100, Abcam, ab62344)、p-MLKL抗体(1 ∶200, Affinity, AF7420)、HMGB1抗体(1 ∶200, Abcam, ab18256)、TNF-α抗体(1 ∶800, Affinity, AF7014)。采集图像后,在×100视野下的软骨中带随机选取3 个300 dpi×300 dpi且覆盖全部肥大层的区域,计算阳性细胞率。
1.6 Western blot
利用Tripure裂解液提取髁突软骨蛋白,BCA法蛋白定量。常规蛋白电泳,转膜。非特异性蛋白封闭15 min后,一抗孵育, 4 ℃过夜。一抗信息如下:RIPK3抗体(1 ∶500, Abcam, ab62344)、p-MLKL抗体(1 ∶1000, Affinity, AF7420)、β-actin抗体(1 ∶2000, Cell Signaling Technology, 4970S)、TNF-α抗体(1 ∶1000, Affinity, AF7014)、HMGB1抗体(1 ∶1000, Abcam, ab18256)、MMP13抗体(1 ∶1000, Abcam, ab39012)、ADAMTS5抗体(1 ∶250, Abcam, ab41037)。二抗孵育后常规ECL发光,然后在Chemi-Doc XRS+WB发光成像系统下显影。图像采集后运用Image Lab 5.2.1软件进行分析。
1.7 统计学分析

2 结 果
2.1 E2补充或/和UAC刺激可导致髁突软骨退变
图 1A显示Con和E2组各层细胞层次分明,肥大层细胞排列紧密;UAC和U+E2组各层细胞排列轻度紊乱,肥大层细胞稀疏。E2、UAC及U+E2组髁突软骨中带厚度均低于Con组(P<0.01);与E2组相比,U+E2组软骨中带厚度变薄(P<0.05)(图 1B)。
图 1C显示,在Con组中番红O染色阳性的蛋白聚糖均匀、规则地分布于软骨肥大层,且与固绿着色的纤维层、增殖层及软骨下骨分界清晰;而E2、UAC及U+E2着色、分布不均匀。与Con相比,E2、UAC及U+E2组番红O染色阳性面积比显著降低(P<0.01);且与E2、UAC组相比,U+E2组蛋白聚糖在全层软骨中所占面积比更小(P< 0.01)(图 1D)。
2.2 Necroptosis关键分子的表达与软骨退变程度相关
免疫组化染色结果显示RIPK3、p-MLKL阳性细胞主要分布于软骨肥大层(图 2A)。E2、UAC及U+E2组RIPK3、p-MLKL阳性细胞率显著高于Con组(P<0.01);且U+E2组阳性细胞率显著高于E2组(RIPK3:P<0.01; p-MLKL:P<0.05)(图 2B)。
图 2C显示:E2、UAC及U+E2组RIPK3、MLKL、p-MLKL蛋白表达量显著高于Con组(P<0.01);且U+E2组蛋白表达量显著高于E2组(P<0.01)(图 2C、2D)。
2.3 Necroptosis相关DAMPs分子和促炎/降解因子的表达与软骨退变程度相关
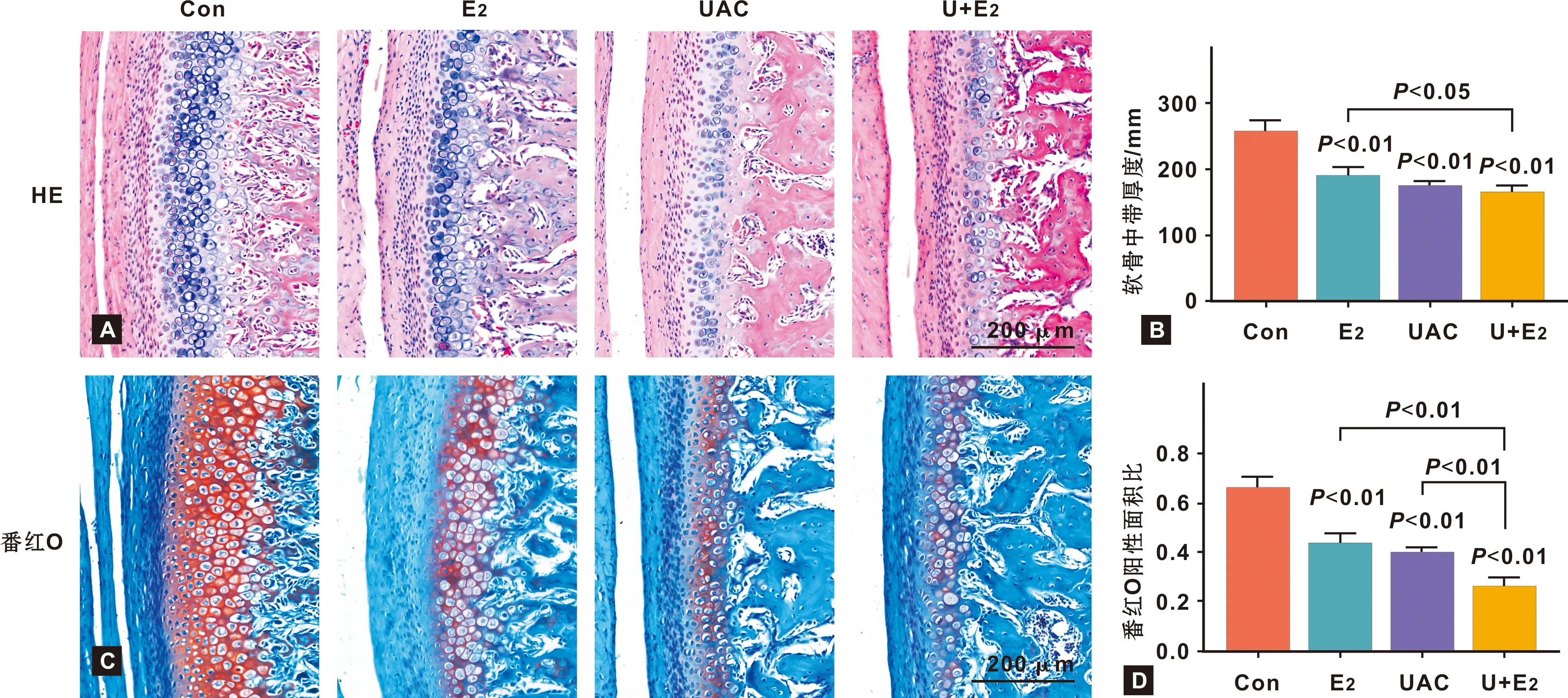
图 1 大鼠TMJ HE和番红O-固绿染色

图 2 髁突软骨中RIPK3和p-MLKL的蛋白表达
如图 3A所示,HMGB1、TNF-α阳性细胞主要分布于软骨肥大层。E2、UAC及U+E2组HMGB1、TNF-α阳性细胞率均显著高于Con组(P<0.01);且U+E2组阳性细胞率均显著高于E2组(P<0.05)(图 3B)。
如图 3C、3D结果所示,E2组HMGB1、TNF-α蛋白表达量均显著高于Con组(P<0.01,P<0.05);UAC组HMGB1、TNF-α、MMP13和ADAMTS5蛋白表达量均显著高于Con组(P<0.01);U+E2组HMGB1、TNF-α、MMP13和ADAMTS5蛋白表达量均显著高于Con组和E2组(P<0.01);且U+E2组HMGB1、MMP13蛋白表达量显著高于UAC组(P<0.01)。

图 3 髁突软骨中HMGB1、TNF-α、MMP13和ADAMTS5的蛋白表达
3 讨 论
TMD是一类口腔常见疾病,主要表现为颌面部疼痛、关节杂音和下颌运动受限,严重影响患者的生活质量。咬合紊乱是TMD一个重要致病因素,据此我们构建了单侧前牙反(UAC)模型[11],该模型创伤小、易操作且能够很好地模拟临床;同时,大量研究表明TMD好发于中青年女性[12-14],提示雌激素在TMD/TMJ OA的发病进程中发挥着重要作用。本文在构建E2、UAC和UAC+E2模型3 周后,E2、UAC组即出现软骨厚度显著变薄,软骨基质中蛋白多糖明显减少;相比较于E2组、UAC组,UAC+E2软骨厚度更薄,蛋白多糖含量更少,因此E2、UAC和UAC+E2模型能够快速有效地导致髁突软骨不同程度的退变。
Necroptosis发生后细胞膜破裂所释放的细胞内容物中存在大量对周围组织有害的物质,其中近年来研究最多的就是DAMPs。DAMPs指机体自身细胞死亡所释放的内源性危险信号分子,目前软骨中研究较多的有高迁移率族蛋白(HMGBs)、晚期糖基化终产物(AGEs)、警报素(Alarmins)等[8,15]。Hamada 等[16]证实OA患者的滑液中存在大量的HMGB1,国内龙星教授课题组的研究也发现TMJ OA患者的关节盘及滑膜组织中的HMGB1表达显著升高[17]。亦有研究证实HMGB1可以直接作用于细胞膜上Toll样受体(Toll-like receptors, TLRs)和趋化因子受体(Chemokine receptors, CXCRs)等,进而启动细胞内信号转导引发促炎效应[4,18-19]。相关类似的研究表明Necroptosis发生后软骨细胞所释放的HMGB1等关键DAMPs可能在软骨内或关节腔内以自分泌或旁分泌的方式诱导周围细胞分泌TNF-α、IL1β、IL8、MMPs、ADAMTs等促炎/降解因子,进一步诱发软骨细胞Necroptosis和软骨基质降解,形成恶性循环,不断促进OA软骨退变的发展[4,8-9]。本研究发现E2、UAC和U+E2组退变髁突软骨中Necroptosis关键分子RIPK3、p-MLKL阳性细胞率和蛋白表达量均显著升高,且表达水平与软骨退变程度相关,这提示Necroptosis参与了髁突软骨的退变进程。E2、UAC及U+E2组退变髁突软骨中HMGB1、TNF-α、MMP13和ADAMTS5等蛋白表达的升高,以及相关蛋白表达量与软骨退变相关,提示髁突软骨退变进程中,软骨细胞Necroptosis发生后细胞破裂所释放的DAMPs水平上升,这些DAMPs可能作用于周围正常的软骨细胞,刺激TNF-α等炎性/降解因子的分泌,从而诱发进一步的软骨退变。综上Necroptosis参与了髁突软骨的退变进程,其相关分子可能成为今后TMD/TMJ OA治疗的新靶点。
