超级增强子长链非编码RNA LINC01232在大肠癌组织中的表达及其对癌细胞生物学行为的影响*
2021-04-28陈缓缓郑钧予江盼严枫南京医科大学附属肿瘤医院江苏省肿瘤医院江苏省肿瘤防治研究所检验科南京210009
陈缓缓,郑钧予,江盼,严枫(南京医科大学附属肿瘤医院&江苏省肿瘤医院&江苏省肿瘤防治研究所检验科,南京210009)
大肠癌是最常见的恶性肿瘤之一,其发病率和死亡率每年呈不断上升趋势[1-2]。早期诊断和有效治疗可以在一定程度上提高患者的生存率,因此,尽早发现肿瘤生物标志物和治疗靶点对大肠癌的诊断和治疗有着重要的意义。
长链非编码RNA(LncRNA)是一种转录本大于200 nt,且不具有编码蛋白质能力的RNA[3]。超级增强子长链非编码RNA(SE-LncRNA)是一类由超级增强子区域转录或与其相互作用的LncRNA[4-5]。研究表明,SE-LncRNA在肿瘤的发生、发展过程中发挥重要的作用[6]。有学者通过基因芯片在大肠癌组织中筛选差异表达的SE-LncRNA,结果发现LINC01232呈异常高表达,且证实其在胰腺癌和食管鳞状细胞癌中呈高表达,并可通过多种不同机制调节癌症的发生、发展[7-8]。然而,目前关于LINC01232在大肠癌中的表达和作用的研究国内尚未见报道。本研究旨在探讨和分析LINC01232在大肠癌组织中的表达水平及其对大肠癌细胞增殖、侵袭和迁移等生物学行为的影响。
1 材料和方法
1.1标本采集 收集2017年10月至2019年12月南京医科大学附属肿瘤医院就诊的大肠癌患者经外科手术切除的35对癌组织及相应的癌旁组织(距离病灶边界>2 cm,无癌细胞),随机抽取4对进行基因芯片分析,另外31对进行临床及实验分析。纳入标准:(1)经病理组织学确诊为大肠癌,并无其他癌症病史;(2)无任何放化疗、生物免疫剂等治疗史;(3)无任何肠炎症病史;(4)临床资料完整。排除标准:(1)非首次确诊患者;(2)围手术期发生严重的并发症。其中31例患者中,男16例,女15例,年龄(58±12)岁,TNM分期Ⅰ~Ⅱ期17例,Ⅲ~Ⅳ期14例。本研究通过南京医科大学医学伦理委员会批准[批准号:南医大伦审(2019)843号],患者及家属知情同意。
1.2细胞系、主要试剂及仪器 大肠癌细胞系HCT-116和HT-29购自中国科学院细胞库。McCoy5A′培养基、胰蛋白酶、磷酸盐缓冲液(PBS)、CCK-8检测试剂均购自江苏凯基生物公司,胎牛血清、Opti-MEM培养基购自美国Gibco公司, TRIzol试剂购自美国Life technologies公司,Quick Amp标记试剂盒(Agilent p/n 5190-0442)、安捷伦基因表达杂交试剂盒(Agilent p/n 5188-5242)购自美国Agilent Technologies公司,Hiscript®ⅢRT SuperMix for qPCR(+gDNA wiper)逆转录试剂和ChamQ Universal SYBR®qPCR Master Mix试剂购自南京诺唯赞生物公司,Lipofectamine RNAiMAX购自美国Invitrogen公司,LINC01232 Smarter Silence和阴性对照negative control试剂购自广州锐博生物公司,TM9SF2兔多克隆抗体(ab121227)和GAPDH兔单克隆抗体(ab9485)购自美国Abcam公司。Transwell小室购自美国Corning公司,SpectraMax i3x多功能酶联仪购自美国Molecular Devices公司,QuantStudio 6实时荧光定量PCR仪购自美国Applied biosystems公司,NanoDrop 1000超微量分光光度计(美国NanoDrop公司)。
1.3方法
1.3.1基因芯片生物信息学分析 基因芯片分析包含4对大肠癌组织及对应的癌旁组织。采用TRIzol试剂提取组织总RNA,用NanoDrop 1000超微量分光光度计检测总RNA的浓度和纯度,取吸光度(A260/280 nm)值在1.8~2.0之间,A260/230 nm值>2.0的RNA样本,置于-80 ℃保存。使用Quick Amp标记试剂盒(Agilent p/n 5190-0442)将RNA转录成Cy3标记的cDNA,按照安捷伦基因表达杂交试剂盒(Agilent p/n 5188-5242)说明书对cDNA进行杂交,通过安捷伦特征提取软件(v11.0.1.1)获取阵列图像,并经GeneSpring GX v12.1软件包(Agilent Technologies)分析和标准化,最后通过P<0.05且Fold Change>2筛选差异表达的SE-LncRNA,其中超级增强子相关信息来源dbSUPER数据库。
1.3.2RT-qPCR检测 将75 mg大肠癌组织及癌旁组织快速研磨成匀浆,每个样本加入700 μL TRIzol试剂提取总RNA,按照逆转录试剂盒Hiscript®Ⅲ RT SuperMix for qPCR(+gDNA wiper)说明书操作将RNA逆转录为cDNA。LINC01232上游引物序列:5′-AAAACCTTGAAATCCCTTAATACCA-3′,下游引物序列:5′-CCTTACCCGTGGAATTCACATATA-3′[7];TM9SF2上游引物序列:5′-CCTCCAAGAAAAGGGATGCTGC-3′,下游引物序列:5′-ACAGGACCACAGCACACGTCAT-3′[8];GAPDH上游引物序列:5′-ATGGGTGTGAACCATGAGAA-3′,下游引物序列:5′-GTGCTAAGCAGTTGGTGGTG-3′[9]。按照ChamQ Universal SYBR®qPCR Master Mix说明书进行RT-qPCR扩增,总反应体系为10 μL,分别为上、下游引物各0.5 μL,SYBR 5 μL,cDNA 4 μL。循环参数:95 ℃ 预变性30 s;95 ℃ 10 s,60 ℃ 15 s,共40个循环。每个样本设置3个复孔,反应结束后对熔解曲线和扩增曲线进行分析,获得Ct值,并采用2-ΔΔCt法对LINC01232的表达量进行分析。
1.3.3细胞培养 使用McCoy5A′培养基(含10%胎牛血清,80 U/mL青霉素,0.08 mg/mL链霉素),在37 ℃、5% CO2、饱和湿度的条件下培养大肠癌细胞系HCT-1116和HT-29,光学显微镜下观察细胞的生长状态,取对数生长期细胞进行后续试验。
1.3.4细胞转染 将生长状态良好的大肠癌细胞系HCT-116和HT-29接种于6孔细胞培养板,当细胞密度达70%时,进行细胞转染。设置NC组(转染negative control)和si-LINC01232组(转染LINC01232 Smarter Silence),每组取2个Ep管,每管加入125 μL Opti-MEM培养液,其中1管加入5 μL Lipofectamine RNAiMAX,室温温育5 min,另1管加入浓度为20 μmol/L,体积为2.5 μL negative control或LINC01232 Smarter Silence,后将2管液体混合,室温温育20 min,于37 ℃、5% CO2条件下继续培养。转染12 h后,收集细胞并采用RT-qPCR检测NC组和si-LINC01232组LINC01232的表达水平,评估其转染效率。LINC01232 Smarter Silence的靶序列:(1)GCCTGCTCCTACATCCCACA;(2)CTGCAGTAACGCAGCCACTA;(3)TGCGGGCCACCACTTCATTT;(4)CCCACATTTACCACTATCA;(5)CAAGAGTGCTGGATCTAAA;(6)GACACGTCATCTAGAATAA。
1.3.5CCK-8试验 将转染24 h后的上述细胞接种于96孔细胞培养板中,每孔约3×103个细胞,每组设置6个复孔,37 ℃、5%CO2条件下继续培养细胞,在0、24、48、72、96 h时,弃去上清液,每孔加入100 μL培养基和10 μL CCK-8试剂,置于培养箱继续培养2 h,采用SpectraMax i3x酶联仪检测450 nm处的吸光度(A)值,实验重复3次。
1.3.6细胞克隆形成试验 细胞转染24 h后,用2.5 g/L胰蛋白酶消化细胞并制备成单细胞悬液,将1×103个细胞接种到6孔细胞培养板中,置于37 ℃、5% CO2的培养箱继续培养1周,形成肉眼可见克隆细胞群落后,终止培养,用PBS洗涤细胞2次,4%多聚甲醛室温下固定30 min,1 g/L结晶紫染液染色30 min,将对照组克隆形成率设置为100%,实验组克隆形成率=(实验组克隆数/对照组克隆数)×100%。
1.3.7Transwell试验 取上述转染24 h后的细胞,300×g离心5 min,收集细胞。将600 μL含20%胎牛血清的培养基加入24孔细胞培养板中,置于Transwell小室中,将200 μL含有1×105个细胞的无血清培养基加至小室中,在37 ℃、5% CO2条件下继续培养48 h,经4%多聚甲醛室温下固定40 min,1 g/L结晶紫染液染色30 min,流水清洗后置于倒置显微镜下进行观察分析,随机选择3个视野进行细胞计数。
1.3.8western blot 将上述6孔细胞培养板中的细胞用冰冷的PBS洗涤3次后,300×g离心5 min,收集细胞,每孔加入100 μL RIPA裂解液,置于冰上裂解30 min,4 ℃、12 000×g离心10 min,收集上清液,采用BCA试剂盒测定蛋白质浓度,加入Loading buffer煮沸5 min,取40 μg总蛋白质进行SDS-PAGE电泳(70 V 30 min,110 V 90 min),使用转膜仪将蛋白质转移至PVDF膜上,用50 g/L脱脂奶粉室温封闭2 h,将PVDF膜分别与TM9SF2兔多克隆抗体(1∶1 000稀释)及GAPDH兔单克隆抗体(1∶2 500稀释)4 ℃温育过夜,使用荧光标记的羊抗兔IgG二抗(1∶5 000稀释)室温温育1 h,采用双色红外成像系统避光扫描拍照,并记录蛋白质条带灰度值,以目标蛋白灰度值/对应内参灰度值作为该组的目标蛋白相对表达量,再将对照组设置为1进行标准化,则实验组蛋白质表达量=(实验组蛋白质相对表达量/对照组蛋白质相对表达量)。

2 结果
2.1基因芯片分析结果 通过基因芯片分析,共获得23个差异表达的SE-LncRNA(Fold Change>2,P<0.05),其中15个上调,8个下调。见表1。LINC01232在癌组织中显著高表达(Fold Change=2.656 9,P=0.025 8),故而本研究选择LINC01232进行下一步的实验验证,其超级增强子分布为chr13:100136209:100160564。
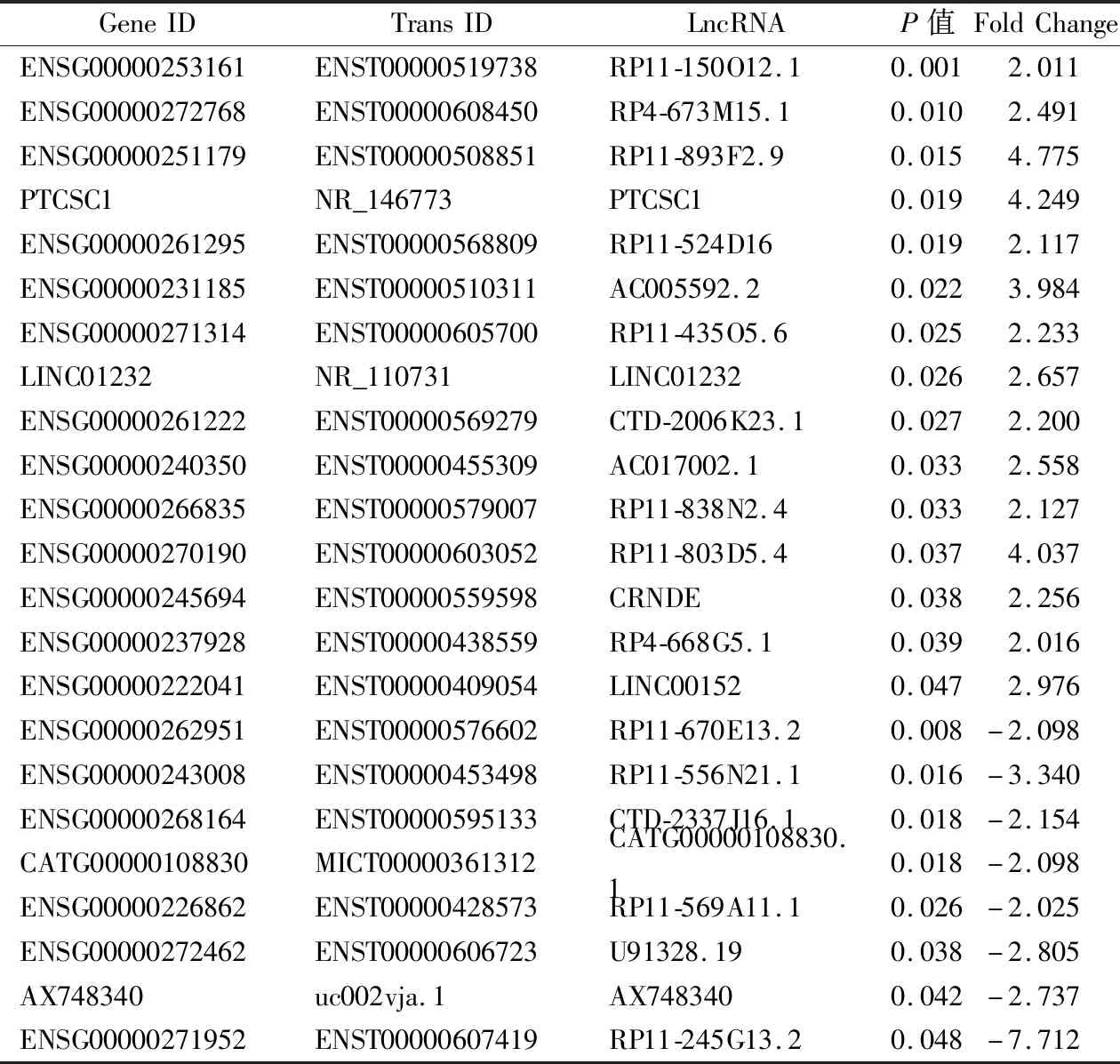
表1 大肠癌中差异表达的SE-LncRNA
2.2LINC01232在大肠癌组织中的表达 RT-qPCR结果显示,在31对大肠癌组织中LINC01232的表达水平(2.015±2.865)明显高于癌旁组织(1.000±2.036),差异具有统计学意义(t=2.388,P=0.023)。
2.3LINC01232表达与大肠癌患者临床病理参数的关系 以LINC01232在31对大肠癌组织表达量的中位数(1.481)为界值,将患者分为“高表达”和“低表达”组,分析其与临床病理参数的关系,结果显示,LINC01232与TNM临床分期(χ2=5.427,P=0.020)和远处转移(χ2=4.663,P=0.031)有关,而与年龄、性别、淋巴转移无明显相关性(P>0.05)。见表2。

表2 大肠癌组织中LINC01232的表达与患者临床病理参数的关系
2.4ROC曲线分析 结果显示,LINC01232筛查大肠癌的ROC曲线下面积(AUCROC)为0.680(95%CI:0.544~0.807,P<0.05),当cut-off值为0.001 4时,敏感性和特异性分别为53.13%、78.13%。见图1。
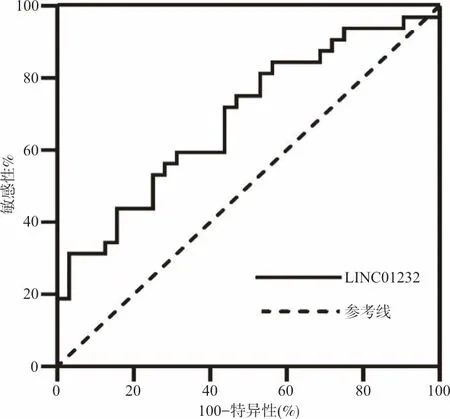
图1 LINC01232的ROC曲线分析
2.5细胞转染效率检测结果 RT-qPCR结果显示,在HCT-116细胞中,si-LINC01232组的LINC01232的表达水平(0.488±0.034)较NC组(1.000±0.250)明显降低,差异具有统计学意义(t=3.513,P=0.025);在HT-29细胞中,si-LINC01232组的LINC01232的表达水平(0.510±0.064)较NC组(1.000±0.150)亦明显降低,差异具有统计学意义(t=3.176,P=0.034)。
2.6下调LINC01232对大肠癌细胞增殖、克隆形成率的影响 CCK-8试验检测结果显示,在HCT-116中,si-LINC01232细胞组在72 h的增殖能力显著低于NC组,差异具有统计学意义(1.197±0.015 vs 1.407±0.051,t=6.793,P=0.002);在HT-29细胞中,si-LINC01232细胞组在72 h的增殖能力亦显著低于NC组,差异具有统计学意义(0.891±0.066 vs 1.162±0.051,t=5.671,P=0.005)。见图2A、2B。细胞克隆结果显示,在HCT-116细胞中,si-LINC01232组的细胞克隆形成率较NC组显著降低,差异具有统计学意义[(59.000±3.610)% vs(100.000±5.210)%,t=11.520,P<0.001];在HT-29细胞中,si-LINC01232组的细胞克隆形成率亦较NC组明显降低,差异具有统计学意义[(52.000±3.210)% vs(100.000±8.801)%,t=9.731,P<0.001]。见图2C、2D。

注:A、B,CCK-8试验检测下调LINC01232对细胞增殖的影响;C、D,细胞克隆试验检测下调LINC01232对细胞克隆形成率的影响;*,P<0.05。
2.7下调LINC01232对大肠癌细胞迁移、侵袭的影响 迁移试验结果显示,在HCT-116细胞中,与NC组比较,si-LINC01232组迁移的细胞数量显著降低[(220.000±19.294)个vs(110.000±9.591)个,t=8.521,P<0.001),在HT-29细胞中,si-LINC01232组迁移的细胞数量亦显著降低[(117.000±9.592)个vs(79.000±3.610)个,t=8.310,P=0.001];侵袭试验结果显示, 在HCT-116细胞中,与NC组比较,si-LINC01232组侵袭的细胞数量显著降低[(283.000±16.166)个vs(173.000±12.858)个,t=7.736,P=0.002],在HT-29细胞中,si-LINC01232组侵袭的细胞数量亦显著降低[(123.000±6.429)个vs (47.000±3.511)个,t=14.310,P<0.001]。见图3。
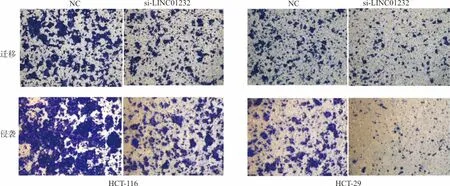
图3 LINC01232对细胞侵袭和迁移的影响(×100)
2.8LINC01232通过调节TM9SF2的表达水平促进大肠癌的发生 通过对UCSC网站分析,显示TM9SF2为LINC01232的临近基因。TCGA数据库分析表明,在大肠癌组织中,TM9SF2与LINC01232的表达呈正相关(r=0.38,P<0.01)。RT-qPCR结果进一步证实了TM9SF2与LINC01232在31对大肠癌组织的表达量呈正相关(r=0.51,P<0.01)。在大肠癌细胞中,RT-qPCR结果表明,TM9SF2mRNA水平在LINC01232 下调后降低,在HCT-116中结果为(1.000±0.250 vs 0.557±0.090,t=2.889,P=0.044),在HT-29中结果为(1.000±0.170 vs 0.643±0.040,t=3.028,P=0.039)。见图4A。western blot结果显示,TM9SF2蛋白水平亦在LINC01232下调后降低,在HCT-116中结果为(1.000±0.050 vs 0.560±0.040,t=11.900,P<0.001),在HT-29中结果为(1.000±0.150 vs 0.433±0.065,t=6.003,P=0.004)。见图4B。

注:A,RT-qPCR检测下调LINC01232对TM9SF2 mRNA表达水平的影响;B,western blot检测下调LINC01232对TM9SF2蛋白表达水平的影响;*,P<0.05。
3 讨论
SE-LncRNA由超级增强子区域转录而来,且与多种疾病,尤其与癌症密切相关。许多恶性肿瘤都伴随着SE-LncRNA表达水平的显著变化[10-11]。本研究采用基因芯片技术在大肠癌中筛选出了异常高表达的LINC01232。为验证基因芯片的结果,本研究继续收集31对大肠癌组织并检测LINC01232的表达水平,证实了LINC01232在大肠癌组织中的表达量显著高于癌旁组织。本研究进一步分析了LINC01232表达与大肠癌患者临床病理参数的相关性,结果发现LINC01232与TNM临床分期及远处转移存在显著的正相关性,表明LINC01232可作为大肠癌是否发生远处转移的潜在标志物。由于本研究收集的是2017年10月至2019年12月期间首次入院患者的组织标本,预后及疗效观察期较短,LINC01232的预后相关性分析有待于进一步验证。有文献报道SE-LncRNA可通过调节细胞周期、增殖、侵袭和迁移等生物学行为来影响肿瘤的发生、发展。在本研究中,下调LINC01232抑制大肠癌细胞的增殖、侵袭和迁移,说明LINC01232是通过促进细胞的增殖、侵袭和迁移等生物学行为调节大肠癌的发生和发展。
研究表明,LINC01232可通过竞争性结合microRNA-654-3p,促进食管鳞状细胞癌的发展[7];在胰腺癌中,LINC01232通过抑制泛素介导的HNRNPA2B1降解,从而激活A-Raf诱导的MAPK/ERK信号通路,促进胰腺癌的转移[12]。但LINC01232在大肠癌中的作用机制仍没有被学者研究过。通过顺式作用调控临近基因的表达是SE-LncRNA发挥功能的重要机制之一[13]。UCSC网站分析显示TM9SF2为LINC01232的临近基因,且TM9SF2已经被证实可通过调节CCNA2、CCNB2和AURKA等癌基因的表达促进大肠癌的发生、发展,在大肠癌中起促癌作用[14]。为了证实LINC01232是否通过调控临近基因TM9SF2的表达以促进大肠癌的发展,本研究首先通过TCGA数据库分析得出TM9SF2与LINC01232在组织中的表达呈正相关,其次,RT-qPCR进一步在31对大肠癌组织中证实了这一结果。同样地,在大肠癌细胞系HCT-116和HT-29中,TM9SF2mRNA和蛋白质水平在LINC01232下调后降低。以上结果与Li等[8]在胰腺癌研究机制结果一致,表明LINC01232可以通过调节TM9SF2的表达促进大肠癌细胞的增殖和侵袭。
综上所述,本研究发现LINC01232在大肠癌组织的表达水平显著高于癌旁组织,且与临床TNM分期、远处转移密切相关。LINC01232对大肠癌诊断的敏感性为53.13%,特异性为78.13%。在HCT-116和HT-29细胞中,下调LINC01232可以抑制细胞的增殖、侵袭和迁移。LINC01232可能通过直接调节临近癌基因TM9SF2的表达以促进大肠癌的发生和发展。因此,有关LINC01232调节TM9SF2的具体机制、大肠癌患者血清中的表达水平验证值得进一步深入探讨。
