双歧杆菌联合左卡尼汀对菌群失调腹泻模型大鼠肠道菌群的影响
2021-04-27王重娟周锦妍王崇静梁月琴朱瑜丹王星星李仲昆
王重娟 周锦妍 王崇静 梁月琴 朱瑜丹 王星星 李仲昆


摘 要 目的:研究雙歧杆菌联合左卡尼汀对菌群失调腹泻模型大鼠肠道菌群的影响。方法:将30只SD大鼠随机分为空白对照组、模型组、益生菌组(双歧杆菌三联活菌肠溶胶囊70 mg/mL)、左卡尼汀组(左卡尼汀注射液50 mg/mL)和左卡尼汀+益生菌组(左卡尼汀注射液50 mg/mL+双歧杆菌三联活菌肠溶胶囊70 mg/mL)。除空白对照组外,其余各组大鼠均连续灌胃50 mg/mL克林霉素磷酸酯(2 mL/只,每天1次,连续4天)以建立菌群失调腹泻模型。实验第5天起进入恢复期,各给药组大鼠开始灌胃相应药物,空白对照组和模型组大鼠灌胃等体积生理盐水;灌胃体积均为1 mL/只,每天1次,连续给药7天。实验期间观察各组大鼠的一般情况;收集造模期结束时正常对照组和模型组大鼠的粪便以及恢复期末次给药后各组大鼠的粪便,分别进行肠道菌群基因组DNA提取与聚合酶链式反应扩增、文库构建和高通量测序,并对处理后的有效数据进行操作分类单元聚类、物种注释以及肠道菌群的Alpha和Beta多样性分析。结果:造模期结束时,与空白对照组比较,模型组大鼠开始出现1级和2级粪便,肠道菌群的多样性、丰富度以及肠道中厚壁菌门/拟杆菌门比值和乳杆菌属、双歧杆菌属和阿克曼氏菌属等益生菌的丰度均显著降低(P<0.05),而肠球菌属等致病菌的丰度显著升高(P<0.05)。恢复期结束时,与模型组比较,益生菌组、左卡尼汀组和左卡尼汀+益生菌组大鼠的活动量和粪便的形态、颜色恢复至正常,肠道菌群的多样性和丰富度差异均无统计学意义(P>0.05),但其肠道中乳杆菌属的丰度有一定提高,且左卡尼汀+益生菌组大鼠肠道中阿克曼氏菌属的丰度显著升高(P<0.05)。结论:双歧杆菌联合左卡尼汀虽对提高菌群失调腹泻模型大鼠肠道菌群的多样性和丰富度无显著效果,但能在一定程度上增加其肠道中益生菌的丰度。
关键词 肠道菌群;益生菌;左卡尼汀;双歧杆菌;高通量测序;多样性
中图分类号 R963;R372 文献标志码 A 文章编号 1001-0408(2021)06-0682-09
ABSTRACT OBJECTIVE: To study the effects of Bifidobacterium combined with L-carnitine on intestinal flora of dysbacteriosis diarrhea model rats. METHODS: Totally 30 SD rats were randomly divided into blank control group, model group, probiotics group (Bifidobacterium triple viable enteric coated capsules 70 mg/mL), L-carnitine group (L-carnitine injection 50 mg/mL) and L-carnitine+probiotics group (L-carnitine injection 50 mg/mL+Bifidobacterium triple viable enteric coated capsules 70 mg/mL). Except for blank control group, the rats in other groups were given 50 mg/mL clindamycin phosphate intragastrically (2 mL/rat, once a day, for 4 consecutive days) to establish the model of dysbacteriosis diarrhea. On the 5th day of the experiment, the rats in administration groups were given corresponding drugs intragastrically, blank control group and model group were given equal volume of normal saline intragastrically; with the dosage volume of 1 mL/rat, once a day, for consecutive 7 days. The general situation of rats in each group was observed during the experiment. The feces of normal control group and model group at the end of the modeling and the feces of the rats in administration group after the last administration were collected for genomic DNA extraction, polymerase chain reaction amplification, library construction and high-throughput sequencing. After processing, the effective data were analyzed by operational taxonomic unitsclustering and species annotation, as well as Alpha and Beta diversity of intestinal flora. RESULTS: At the end of the modeling, compared with blank control group, grade 1 feces and grade 2 feces were found in model group. The diversity and richness of intestinal flora, the ratio of Firmicutes/Bacteroidetes and the abundance of probiotics such as Lactobacillus, Bifidobacterium and Ackermann were significantly decreased (P<0.05), while the abundance of pathogenic bacteria such as Enterococcus was significantly increased (P<0.05). At the end of the recovery period, compared with model group, the activity, fecal morphology and color of rats in probiotics group, L-carnitine group and L-carnitine+probiotics group returned to normal, and the diversity and richness of intestinal flora had no significant difference (P>0.05). However, the abundance of Lactobacillus in intestinal tract was increased to a certain extent, and the abundance of Ackermann in intestinal tract of rats in L-carnitine+probiotics group was significantly increased (P<0.05). CONCLUSIONS: Although Bifidobacterium combined with L-carnitine have no significant effect on improving the diversity and richness of intestinal flora in dysbacteriosis diarrhea model rats, it could increase the abundance of probiotics to a certain extent.
根据磁珠法土壤和粪便基因组DNA提取试剂盒说明书方法提取粪便样本中肠道菌群的基因组DNA,利用琼脂糖凝胶电泳检测DNA的纯度和浓度后,用无菌水稀释DNA至1 ng/?L。以稀释后的DNA为模板进行PCR扩增。16S V4区引物序列为515F:5′-GTGCCAGCMGCCGCGGTAA-3′;806R:5′-GGACTACHVG- GGTWTCTAAT-3′。反應体系含Phusion Master Mix(2×)15 ?L,上、下游引物(2 ?mol/L)各3 ?L,DNA模板(1 ng/?L)10 ?L,无菌水 2 ?L。扩增条件为98 ℃预变性1 min;98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,共30个循环;再以72 ℃延伸5 min结束反应。使用2%琼脂糖胶电泳(电压80 V、电泳时间40 min)纯化PCR产物。使用GeneJET胶回收试剂盒割胶回收主带大小在400~450 bp之间的目标条带。上述DNA提取与PCR扩增均由北京诺禾致源生物信息有限公司完成。
2.4 大鼠肠道菌群基因组文库构建与高通量测序
根据TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒方法进行文库的构建,将构建好的文库经过Qubit定量和文库检测。Qubit数值≥30者,使用测序系统进行测序。上述文库构建与高通量测序均由北京诺禾致源生物信息有限公司完成。
2.5 大鼠肠道菌群基因组测序数据处理与分析
2.5.1 原始数据处理 因测序得到的原始数据(Raw tags)中还存在一定比例的干扰数据,为了使信息分析的结果更加准确、可靠,首先将Raw tags从碱基数达到3的第1个低质量碱基位点截断,进一步过滤掉其中连续高质量碱基长度小于tags长度75%的数据,再与物种注释数据库(https://github.com/torognes/vsearch/)进行比对,检测并去除嵌合体序列,从而得到最终的有效数据(Effective tags)。
2.5.2 可操作分类单元聚类和物种注释 利用Uparse v7.0.1001软件对所有样本的全部有效数据进行聚类,以97%的一致性将序列聚类成为可操作分类单元(OTUs),以OTUs中出现频数最高的序列作为代表对OTUs进行物种注释[8]。根据物种注释结果,分别统计在门、属水平丰度排名前10的物种。
2.5.3 样本DNA测序质量评估及肠道菌群的Alpha多样性分析 使用R 2.15.3软件绘制稀释曲线、等级聚类曲线、物种累积箱形图和分组OTUs韦恩图,以评价测序的深度、物种丰富度、样本量是否足够以及各组OTUs组成情况。使用Qiime 1.9.1软件进行样本的Alpha多样性分析,计算香农指数(Shannon指数)、Chao1指数、ACE指数和样品文库覆盖率(Goods coverage)。其中,Shannon指数反映样品中微生物的多样性,其值越大,说明菌群多样性越高;Chao1和ACE指数反映群落中OTUs的数目,是生态学中估计物种总数的常用指数,其值越大,说明菌群丰富度越高;Goods coverage反映测序结果是否可代表样本中微生物的真实情况,其值越大(最大值为1),说明样本中序列被测出的概率越高[9]。
2.5.4 肠道菌群的Beta多样性分析 用Qiime 1.9.1软件计算Unifrac距离、构建UPGMA(Unweighted pair- group method with arithmetic mean)样本聚类树,使用 R 2.15.3软件绘制无度量多维标定(Non-metric multi-dimensional scaling,NMDS)图[10]。
2.6 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 造模情况
3.1.1 造模期大鼠的一般情况观察结果 造模期内,各组大鼠均较活泼、反应敏捷,毛发光亮,饮食正常。但从实验第3天起,模型组大鼠开始出现1级成形、软粪便和2级稀烂、不成形粪便,而空白对照组大鼠的粪便在整个实验期内均为0级硬粪便。空白对照组和模型组大鼠体质量的增长值分别为(13.50±2.59)、(13.00±5.02) g,二者比较差异无统计学意义(P>0.05)。
3.1.2 造模期粪便样本DNA测序质量评估及肠道菌群的Alpha多样性分析结果 稀释曲线结果显示,当序列接近60 000时,再增加序列数量后很少产生新的OTUs,表明试验测序深度足够[11]。等级聚类曲线结果显示,从水平方向看,空白对照组在横轴上物种等级的跨度显著大于模型组,表明空白对照组大鼠肠道菌群的丰富度高于模型组。物种累积箱形图结果显示,当样本数量不断增加至空白对照组和模型组样本量之和时,很少有新的物种出现,表明样本数量足够[12]。通过空白对照组和模型组样本聚类得到的分组OTUs韦恩图看,两组样本(12份)有580个共有的OTUs,其中空白对照组有112个特征OTUs,而模型组只有63个特征OTUs,表明空白对照组大鼠肠道菌群的物种丰富度高于模型组。造模期DNA测序质量评估及肠道菌群的Alpha多样性分析结果见图1。
模型组大鼠Shannon指数显著低于空白对照组(P<0.01),说明空白对照组大鼠肠道菌群的多样性显著高于模型组。模型组大鼠Chao1、ACE指数虽低于空白对照组,但差异无统计学意义(P>0.05)。空白对照组和模型组大鼠的Goods coverage均为0.99,这进一步表明两个组的测序深度足够,样品中序列未被检测到的可能性较低。造模期两组大鼠肠道菌群的Alpha多样性指数统计结果见表1。
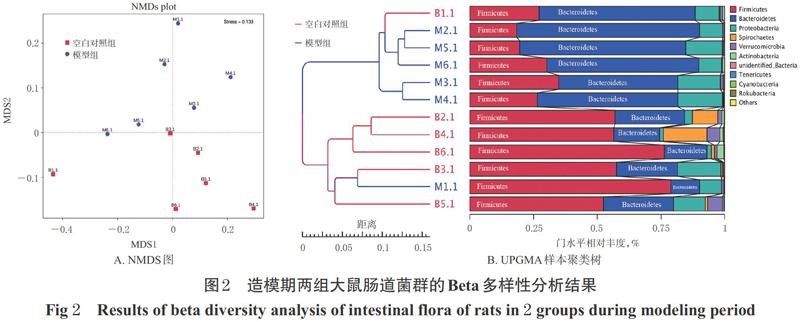
3.1.3 造模期大鼠肠道菌群的Beta多样性分析结果NMDS分析结果显示,空白对照组和模型组大鼠肠道中菌群分为2群,并分布在不同区域,表明两组大鼠肠道菌群存在明显差异。UPGMA样本聚类分析结果显示,两组大鼠肠道中细菌组成的相似度聚类可分成2类,模型組除有1只大鼠与空白对照组归为同类外,其余均为不同类,表明空白对照组大鼠的肠道菌群整体与模型组不同。造模期大鼠肠道菌群的Beta多样性分析结果见图2。
3.1.4 造模期大鼠肠道菌群结构组成分析结果 在门水平上,空白对照组和模型组大鼠的优势菌门均为厚壁菌门和拟杆菌门,但与空白对照组比较,模型组大鼠肠道中厚壁菌门丰度显著降低(P<0.05),拟杆菌门丰度显著升高(P<0.05),厚壁菌门/拟杆菌门(F/B)比值分别为1.87和0.67。在属水平上,空白对照组大鼠的优势菌属为拟杆菌属和乳杆菌属,而模型组大鼠的优势菌属为拟杆菌属和Romboutsia。空白对照组大鼠肠道中乳杆菌属、双歧杆菌属(因排序不在前10,限于篇幅结果未详细展示)以及考拉杆菌属、阿克曼氏菌属的丰度均显著高于模型组(P<0.05),而拟杆菌属、肠球菌属和粪芽孢菌属(因排序不在前10,限于篇幅结果未详细展示)的丰度均显著低于模型组(P<0.05)。造模期两组大鼠肠道菌群(丰度排名前10位)结构组成分析结果见表2(表中数值为0.00±0.00的表示其对应菌株的丰度<0.005)。
3.2 益生菌联合左卡尼汀对模型大鼠肠道菌群的影响
3.2.1 恢复期大鼠的一般情况观察结果 恢复期(实验第5~11天),空白对照组大鼠较活泼、反应敏捷,毛发光亮,饮食正常,其粪便均为褐色、成形的0级粪便。模型组大鼠虽反应尚可,但活动量较空白对照组明显减少,且持续出现不成形的1级和2级粪便,体质量增长较慢。益生菌组、左卡尼汀组和左卡尼汀+益生菌组大鼠的活动量以及粪便的形态和颜色均逐渐恢复至正常,且体质量增长未见减慢。在实验第11天,空白对照组、模型组、益生菌组、左卡尼汀组和左卡尼汀+益生菌组大鼠的体质量增长值分别为(40.17±13.57)、(35.67±8.82)、(47.17±22.23)、(41.50±20.11)、(41.83±8.84) g,其中益生菌组大鼠体质量增长值显著高于模型组(P<0.05)。实验周期内各组大鼠体质量增长情况见图3。
3.2.2 恢复期样本DNA测序质量评估及肠道菌群的Alpha多样性分析结果 稀释曲线结果显示,当序列接近60 000时,即使再增加序列也很少产生新的OTUs,表明试验测序深度足够[11]。等级聚类曲线结果显示,从水平方向看,各组在横轴上物种等级的跨度大小为空白对照组>模型组>益生菌组>左卡尼汀+益生菌组>左卡尼汀组,说明益生菌、左卡尼汀和左卡尼汀+益生菌组均不能提高大鼠肠道菌群的丰富度。物种累积箱形图结果显示,当样本量不断增加至5组样本量之和时,很少有新的物种出现,表明5组样本量足够[11]。通过各组聚类得到的分组OTUs韦恩图看,5组样本共有416个共有的OTUs,空白对照组、模型组、益生菌组、左卡尼汀组和左卡尼汀+益生菌组分别有33、21、33、19、8个特征OTUs,说明益生菌能够增加模型大鼠的特征OTUs。恢复期大鼠粪便样本DNA测序质量评估及肠道菌群的Alpha多样性分析结果见图4。
从Goods coverage来看,各组大鼠的Goods coverage均达到了1.00,表明恢复期各组样本的测序深度均足够。从Shannon指数来看,各给药组大鼠的Shannon指数虽均低于空白对照组,但只有左卡尼汀+益生菌组差异具有统计学意义(P<0.01),表明仅左卡尼汀+益生菌组大鼠肠道菌群多样性较空白对照组显著降低。同时,模型组和各药物组大鼠Chao1、ACE指数均低于空白对照组(P<0.05或P<0.01),且益生菌、左卡尼汀和左卡尼汀+益生菌均未表现出提升模型大鼠Shannon、Chao1和ACE指数的趋势(P>0.05)。以上结果表明,益生菌、左卡尼汀和左卡尼汀+益生菌给药后均不能提高腹泻模型大鼠肠道菌群的多样性和丰富度。恢复期各组大鼠肠道菌群的Alpha多样性指数统计结果见表3。
3.2.3 恢复期大鼠肠道菌群的Beta多样性分析结果NMDS分析结果显示,仅空白对照组大鼠的物种信息与其余各组无重叠部分,说明空白对照组与其余各组大鼠的肠道菌群构成差异较大;而模型组、益生菌组、左卡尼汀组、左卡尼汀+益生菌组大鼠之间肠道菌群构成差异相对较小,说明益生菌、左卡尼汀、左卡尼汀+益生菌均不能显著改变模型大鼠的肠道菌群。UPGMA样本聚类分析结果显示,只有空白对照组各样本在UPGMA聚类树中的距离较为相近,被单独聚为一类,而其余组各样本间均存在重叠部分。上述结果说明,除空白对照组外,其余各组大鼠肠道菌群的构成无明显差异,这进一步证实了“3.2.2”项下结论。恢复期各组大鼠肠道菌群的Beta多样性分析结果见图5。
3.2.4 恢复期大鼠肠道菌群结构组成分析结果 在门水平上,空白对照组、模型组、益生菌组、左卡尼汀组和左卡尼汀+益生菌组大鼠的F/B比值分别为0.58、0.39、0.45、0.28、0.30;与空白对照组比较,模型组大鼠肠道中厚壁菌门、无壁菌门的丰度均显著降低(P<0.05),朊细菌门的丰度显著升高(P<0.05);与模型组比较,益生菌组大鼠的F/B比值显著升高、朊细菌门以及左卡尼汀组大鼠肠道中疣微菌门的丰度均显著降低(P<0.05),左卡尼汀+益生菌组大鼠肠道中朊细菌门丰度显著降低(P<0.05)。在属水平上,与空白对照组比较,模型组大鼠肠道中拟杆菌属的丰度显著升高(P<0.05),阿克曼氏菌属、乳杆菌属的丰度均显著降低(P<0.05);与模型组比较,左卡尼汀+益生菌组大鼠肠道中阿克曼氏菌属的丰度显著升高(P<0.05),且益生菌组、左卡尼汀组和左卡尼汀+益生菌组大鼠肠道中乳杆菌属的丰度均有不同程度的提高。恢复期各组大鼠肠道菌群(丰度排名前10位)结构组成分析结果见表4(表中数据为0.00±0.00的表示对应菌株的丰度<0.005)。
4 讨论
人体肠道内庞大的菌群大致可以分为3类:一类是共生菌,主要是专性厌氧菌,包括乳杆菌、双歧杆菌以及部分梭菌类和革兰氏阳性球菌(如粪链球菌、乳球菌)等,其参与了食物的消化过程并促进肠道的蠕动,同时具有增强机体免疫力、抑制致病菌生长等功能;另一类是条件致病菌,如大肠埃希菌和肠球菌等,其在正常情况下对人体有益,但在某些因素(如长期使用广谱抗生素、肠道动力异常)的作用下其大量繁殖后也会对机体产生危害;还有一类是致病菌,如艰难梭菌、金黄色葡萄球菌等,这类细菌在正常人体肠道内含量较少[7,12]。正常情况下,人体肠道内的细菌相互拮抗、相互协同,在质和量上形成一种动态平衡,但长期使用抗生素会导致敏感菌的生长被抑制,致病菌借机大量繁殖而导致肠道菌群的紊乱[13]。
目前许多研究采用抗生素建立肠道菌群失调动物模型,如郭佳裕等[14]通过灌胃盐酸林可霉素(120 mg/d,连续灌胃7天)成功建立了肠道菌群紊乱小鼠模型;再如李娜等[15]通过灌胃头孢曲松钠溶液(0.02 mL/g,头孢曲松质量浓度为0.6 g/mL,连续灌胃10天)成功建立了小鼠肠道菌群失调模型。但不同类型的抗生素、不同的给药剂量和给药时间都会影响造模效果。本研究通过灌胃克林霉素磷酸酯(50 mg/mL)的方法來建立了大鼠肠道菌群失调模型。张文娣[7]的研究结果显示,50 mg/mL的克林霉素磷酸酯可导致大鼠肠道菌群失调,但停药一段时间后可在一定程度上恢复,提示在该剂量下不会引起大鼠肠道菌难以逆转的失调情况。本研究结果显示,在造模期结束时,模型组大鼠肠道菌群的多样性和丰富度显著低于空白对照组,该结果与文献[16]报道相一致;在菌群结构方面,模型组大鼠肠道中F/B比值较空白对照组显著下降(F/B比值是反应肠道菌群紊乱的重要指标[12]),同时乳杆菌属、双歧杆菌属、阿克曼氏菌属等益生菌的丰度也显著下降,而肠球菌属等致病菌的丰度显著升高,且UPGMA聚类分析也将空白对照组和模型组样本聚为2类。以上研究结果均提示,本研究中肠道菌群紊乱大鼠模型复制成功。
益生菌是临床上常用的治疗新生儿腹泻和母乳喂养不耐受的制剂,常用的益生菌包括双歧杆菌、嗜酸乳杆菌、地衣芽孢杆菌等[17-18]。姜琳等[19]的研究显示,合用双歧杆菌乳酸菌片可有效预防小儿抗生素相关腹泻;伍静等[20]的研究表明,口服乳酸菌和双歧杆菌能够上调肠道菌群失衡模型小鼠肠道中乳酸菌和双歧杆菌的数量,调节和修复其肠道菌群的平衡状态。但是由于益生菌为活菌制剂,其生物活性易受外部环境的影响,且其进入人体或动物消化道后,受到胃酸和胆盐等的影响,最终能到达肠道并定植发挥作用的活菌数量极少,有时并不能发挥益生效果[5]。在本研究中,当恢复期结束时,笔者发现灌胃益生菌后不能提高模型大鼠肠道菌群的丰富度和多样性,但是能提高其F/B比值。相关研究显示,抗生素可导致腹泻模型小鼠肠道中F/B比值显著下降,提示灌胃益生菌可改善菌群失调腹泻模型大鼠的肠道菌群紊乱情况[21]。此外,乳杆菌属是常见的益生菌,其能够治疗或辅助治疗新生儿腹泻及胃肠道等疾病[22]。在本研究中,益生菌组大鼠肠道中乳杆菌属的丰度较模型组有一定升高。可见,灌胃益生菌后,其可通过改变菌群结构、增加肠道内益生菌丰度来改善模型大鼠的腹泻情况。
左卡尼汀又名左旋肉毒碱,是一种由氨基酸生物合成的季铵化合物,在能量代谢尤其是脂肪酸的分解代谢中起着重要作用;同时,其还具有抗氧化、维持体内细胞膜稳定以及促进蛋白质合成等活性[23]。此外,左卡尼汀是肠道菌群产生三甲胺的重要来源[24]。本研究结果显示,联合使用益生菌和左卡尼汀虽不能提高菌群失调腹泻模型大鼠肠道菌群的丰富度、多样性以及F/B比值,但能够在一定程度上提高其肠道中阿克曼氏菌属和乳杆菌属等益生菌的丰度。多项研究表明,阿克曼氏菌对肠道炎症、肥胖、糖尿病等疾病具有改善作用,能够降低炎症因子水平、诱导肠道菌群重塑、在维持肠道稳态中具有重要作用,有望被开发为生物治疗剂和下一代益生菌制剂[25-26]。
综上所述,本研究通过采用克林霉素磷酸酯灌胃的方式成功建立了菌群失调腹泻大鼠模型,初步证明了益生菌联合左卡尼汀对模型大鼠肠道菌群的多样性和丰富度无显著恢复作用,但能在一定程度上提高其肠道益生菌的丰度。本研究为临床联合使用左卡尼汀和益生菌提供了一定的参考,但要确认该作用及具体机制还需扩大样本量进行更深入的研究。
参考文献
[ 1 ] MATAMOROS S,GRAS-LEGUEN C,LE VACON F, et al. Development of intestinal microbiota in infants and its impact on health[J]. Trends Microbiol,2013,21(4):167-173.
[ 2 ] 岳宏宇,丛春莉,李艳梅.肠道微生态与肠道疾病关系的研究进展[J].中国真菌学杂志,2020,15(4):240-243.
[ 3 ] THE HC,FLOREZ DE,SESSIONS P,et al. Assessing gut microbiota perturbations during the early phase of infectious diarrhea in Vietnamese children[J]. Gut Microbes,2017,9(1):38-54.
[ 4 ] 祖婷,王军,闫俊梅,等.高通量测序技术分析喂养不耐受早产儿肠道菌群的动态变化[J].儿科药学杂志,2019,25(8):1-4.
[ 5 ] 阿热爱·巴合提,武瑞赟,肖梦圆,等.益生菌的生理功能及作用机理研究进展[J]. 食品与发酵工业,2020,46(22):270-275.
[ 6 ] 杨乔焕,游楚明,陈小岸,等.左卡尼汀在早产儿中的临床应用研究[J].中国实用医药,2019,14(10):3-5.
[ 7 ] 张文娣.抗生素相关性腹泻模型的构建[D].广州:南方医科大学,2015.
[ 8 ] 王瑾,冉倩,王琳,等.基于16S rRNA技术分析黄连酒蒸前后对正常及2型糖尿病大鼠肠道微生物的影响[J].中国实验方剂学杂志,2019,25(22):92-102.
[ 9 ] 徐晓飞.香菇多糖的免疫调节机理研究[D].广州:华南理工大学,2014.
[10] NOVAL RM,BURTON OT,WISE P,et al. A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis[J]. J Allergy Clin Immunol,2013,131(1):201-212.
[11] 韩聪,姜月华,李伟,等.基于16S rDNA测序技术探索黄芪-丹参药对干预自发性高血压大鼠肠道菌群的机制[J].中华中医药杂志,2019,34(5):2233-2237.
[12] 吳小平,贺杰.重视肠道菌群失调与肠外疾病关系的研究[J].国际消化病杂志,2012,32(1):1-3.
[13] 缪志敏,赖泳.肠道菌群在药源性肝损伤中的作用及其保肝机制的研究进展[J].沈阳药科大学学报,2020,37(9):847-851.
[14] 郭佳裕,孟娟,杜锦辉.甘草泻心汤对抗生素诱导肠道菌群失调小鼠肠道主要菌群及sIgA的影响[J].中国微生态学杂志,2019,31(11):1246-1249.
[15] 李娜,赵玉民,陈正元,等.抗生素诱导肠道菌群失调对肠黏膜屏障和肝脏功能的动态影响[J].动物营养学报,2019,31(3):1278-1287.
[16] HUI H,WU Y,ZHENG T,et al. Bacterial characteristics in intestinal contents of antibiotic-associated diarrhea mice treated with Qiweibaizhu powder[J]. Med Sci Monit,2020,13(26):e921771.
[17] 高璐,于锋,王坚.益生菌制剂在慢性肝脏疾病中的应用进展[J].中国药房,2016,27(3):426-429.
[18] SHARIF S,MEADER N,ODDIE SJ,et al. Probiotics to prevent necrotising enterocolitis in very preterm or very low birth weight infants[J]. Cochrane Database Syst Rev,2020,15(10):CD005496.
[19] 姜琳,苏艳琦,郎会利,等.益生菌预防小儿抗生素相关性腹泻的疗效探讨[J].中国现代药物应用,2018,12(6):153-154.
[20] 伍静,苏春萍,王显超,等.乳酸菌和双歧杆菌制剂对小鼠肠道菌群失调模型的调节作用[J].科学技术与工程,2013,13(16):4497-4500.
[21] 贺美玲,王纯洁,贾知锋,等.乳酸链球菌素对腹泻小鼠盲肠菌群结构及脂代谢的影响[J].动物营养学报,2018,30(7):2782-2790.
[22] 赖本聪.复方嗜酸乳杆菌片联合蒙脱石散治疗小儿腹泻临床疗效观察[J].中国处方药,2020,18(1):73-74.
[23] HR?BJARTSSON A. What are the main methodological problems in the estimation of placebo effects[J]. J Clin Epidemiol,2002,55(5):430-435.
[24] 张玲玲,邓平.左卡尼汀的肠道菌群代谢和心血管疾病风险的相关性研究进展[J].中国临床研究,2015,28(5):670-672.
[25] VAN HERREWEGHEN F,DE PAEPE K,MARZORATI M,et al. Mucin as a functional niche is a more important driver of in vitro gut microbiota composition and functionality than supplementation of Akkermansia muciniphila[J].Appl Environ Microb,2020,84(4):e02467-20.
[26] HANNINEN A,TOIVONEN R,POYSTI S,et al. Akkermansia muciniphila induces gut microbiota remodelling and controls islet autoimmunity in NOD mice[J]. GUT,2018,67(8):1445-1453.
(收稿日期:2020-09-30 修回日期:2020-12-31)
(编辑:林 静)
