ALPL在BMMSCs调控血管内皮细胞管腔形成中的作用研究
2021-04-27董加一赵疆东陈骥刘文佳李德华
董加一 赵疆东 陈骥 刘文佳 李德华
低碱性磷酸酯酶症(hypophosphatasia,HPP),是一种由ALPL基因突变导致机体骨骼和牙齿发育不全的遗传性疾病,HPP发病率较高,约为十万分之一,其临床表现主要为骨量大量丧失,骨小梁密度下降且排列紊乱,重者出现软骨病或佝偻病等。研究报道,ALPL基因突变造成编码TNSALP功能缺失,促使骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs)成脂分化明显增加,成骨分化显著降低[1-2],这与HPP的相关病理性骨发育异常密切相关。
大量研究证实在在骨缺损愈合中,BMMSCs可诱导血管内皮细胞增殖、迁移和管腔形成从而促进骨内血管新生[3-5]。骨作为一种高度血管化的组织,血管新生和内皮细胞来源的信号分子在调控骨重建与再生过程中同样发挥重要作用[6]。最近在人和鼠科动物长骨干骺端与骨膜下发现一种特殊的毛细血管,其高表达CD31和EMCN,命名为H型微血管(CD31hiEMCNhi)[7-9]。已有研究证实骨质疏松小鼠模型和骨质疏松及骨量欠佳病人H型血管数量明显减少[10-12]。以上说明,这种特殊的H型血管在调节骨发育、维持骨骼动态平衡中发挥重要作用,且与骨相关疾病密切相关。但ALPL基因突变是否会影响BMMSCs对内皮细胞的诱导目前尚未有研究报道,本实验深入探究BMMSCs中ALPL基因对内皮细胞管腔形成的影响,旨在进一步探索ALPL基因功能,期待找到一种推动硬组织内血管新生的方法以解决HPP患者骨缺损问题。
1 材料与方法
1.1 主要材料、试剂和仪器
α- MEM、谷氨酰胺(Gibco,美国);ECM培养基(ScienCell, 美国); 胎牛血清(浙江天杭生物科技股份有限公司); 100 U/mL青霉素、链霉素(Invitrogen, Cadsbad, 美国);倒置相差显微镜(OLYMPUS,日本);酶标仪(BIO-TEC,美国);细胞培养箱(Thermo, 美国);YJ-875型超净工作台(苏州净化设备有限公司);冰冻切片机(Leica, 德国);激光共聚焦显微镜(Nikon,日本);ALP染色试剂盒(上海碧云天生物技术有限公司);磷酸钙转染试剂盒(Promega, 美国);ALPL(abcam, 美国)、CD31(R&D SYSTEMS, 美国)、EMCN(Santa Cruz Biotechnology,美国)、GAPDH(上海翊圣生物科技有限公司)、二抗(Jacson, 美国)、Hoechst(Med ChemExpress, 美国); Matrigel胶、24 孔transwell(Corning, 美国); ALPL基因敲除(ALPL+/-)小鼠(Jackson, 美国)。
1.2 细胞的分离和培养
1.2.1 细胞培养 内皮细胞ECs和人骨髓间充质干细胞(第四军医大学组织工程中心提供),分别在含10%血清、青霉素和链霉素的ECM培养基和α- MEM培养液,37 ℃、5% CO2孵箱中常规培养,换液2 d/次,当细胞达到70%~80%后用0.25%胰酶消化,以1 ∶3比例传代。
1.2.2 BMMSCs的分离和培养 取5 周龄雌性C57BL/6小鼠2 只,脱颈处死后用75%的乙醇浸泡5 min,无菌条件下分别剥离小鼠的股骨、胫骨,减去干骺端后,用注射器吸取含20%血清的α- MEM反复冲洗骨髓腔,收集冲洗液于离心管中进行吹打后,将细胞悬液接种于培养皿中。72 h后首次换液,以后换液2 d/次,当贴壁细胞达到90%后用0.25%胰酶消化,按1 ∶2比例传代。
1.3 病毒的包装
分别取包装质粒PSPAX、PMD2G及目的质粒Sh-ALPL(第四军医大学组中工程中心提供),并按照磷酸钙转染试剂盒说明书转染293T细胞,转染6 h后换为完全培养基,继续培养48 h后收取病毒液。
1.4 ALPL基因调控骨内血管形成
1.4.1 hBMMSCs的慢病毒转染及鉴定 取生长良好的第三代h-BMMSCs,以1×105/mL的密度接种于6 孔板中,常规培养至细胞达到80%时,将细胞随机分为2 组(对照组,Sh-ALPL)。Sh-ALPL组加入1 mL已提取的病毒液,转染8 h后换为完全培养基。处理72 h后,分别提取两组细胞蛋白,Western-Blot法检测两组细胞中ALPL蛋白表达水平。然后再分别将两组细胞经PBS清洗后用4%多聚甲醛固定20 min,加入适量BCIP/NBT染色工作液,室温下避光孵育30 min,去除染色液并终止染色反应后,观察并拍照。
1.4.2 免疫荧光检测骨内H型血管数量变化 从ALPL+/-小鼠和野生型(WT)小鼠股骨取材,用4%的多聚甲醛于4 ℃冰箱内固定6 h,PBS清洗3 次后在4 ℃冰箱中静置脱钙72 h。脱钙完成后30%蔗糖脱水,OCT包埋后切片,每张切片的厚度为30 μm。 PBS彻底清洗包埋剂后山羊血清封闭30 min,再一抗以1 ∶100稀释后,4 ℃孵育过夜,次日以1 ∶200稀释荧光二抗,避光室温孵育75 min后PBS清洗3 遍,Hoechst染核15 min后甘油封片,免疫荧光显微镜观察H型血管数量。
1.4.3 管腔形成实验 采用24 孔的共培养模型,分别接种健康和HPP患者BMMSCs(Nor-hBMMSCs和HPP-hBMMSCs)、WT-mBMMSCs、ALPL+/-mBMMSCs于上室中,下层每孔铺200 μL Matrigel胶,37 ℃孵育30 min后,将ECs以1×105的密度接种于基质胶上培养3 h后在倒置显微镜下观察ECs管腔形成情况并拍照。
1.5 统计学分析
采用SPSS 19.0对数据进行统计分析,组间比较用One-way ANOVA,检验水准α=0.05。 *为P<0.05, *为P<0.01, *为P<0.001。
2 结 果
2.1 细胞的培养和形态学观察
h-BMMSCs(第四军医大学组织工程中心提供)培养并传至第三代,细胞增殖迅速,呈长梭形,大部分区域形成细胞团簇,并且相互融合,呈旋涡状盘旋排列(图1)。原代培养m-BMMSCs 3d,倒置显微镜下细胞胞体明显增大并开始分裂,细胞呈成纤维细胞样生长(图1)。ECs第5代细胞(第四军医大学组织工程中心提供),细胞增殖迅速,呈扁平多角形或梭型,细胞间相互连接,边界清楚,胞浆丰富(图1)。

图1 细胞的形态学观察(×100)
2.2 转染效率的鉴定结果
慢病毒浸染法下调hBMMSCs中ALPL 表达,48 h后Western-Blot检测结果显示,下调组ALPL表达水平显著低于对照组(图2);另外ALP染色结果显示,相较于对照组Sh-ALPL组的染色结果明显减弱(图2)。以上结果证实,通过慢病毒浸染可有效调控h-BMMSCs中ALPL表达。
2.3 ALPL 在hBMMSCs中调控ECs管腔形成
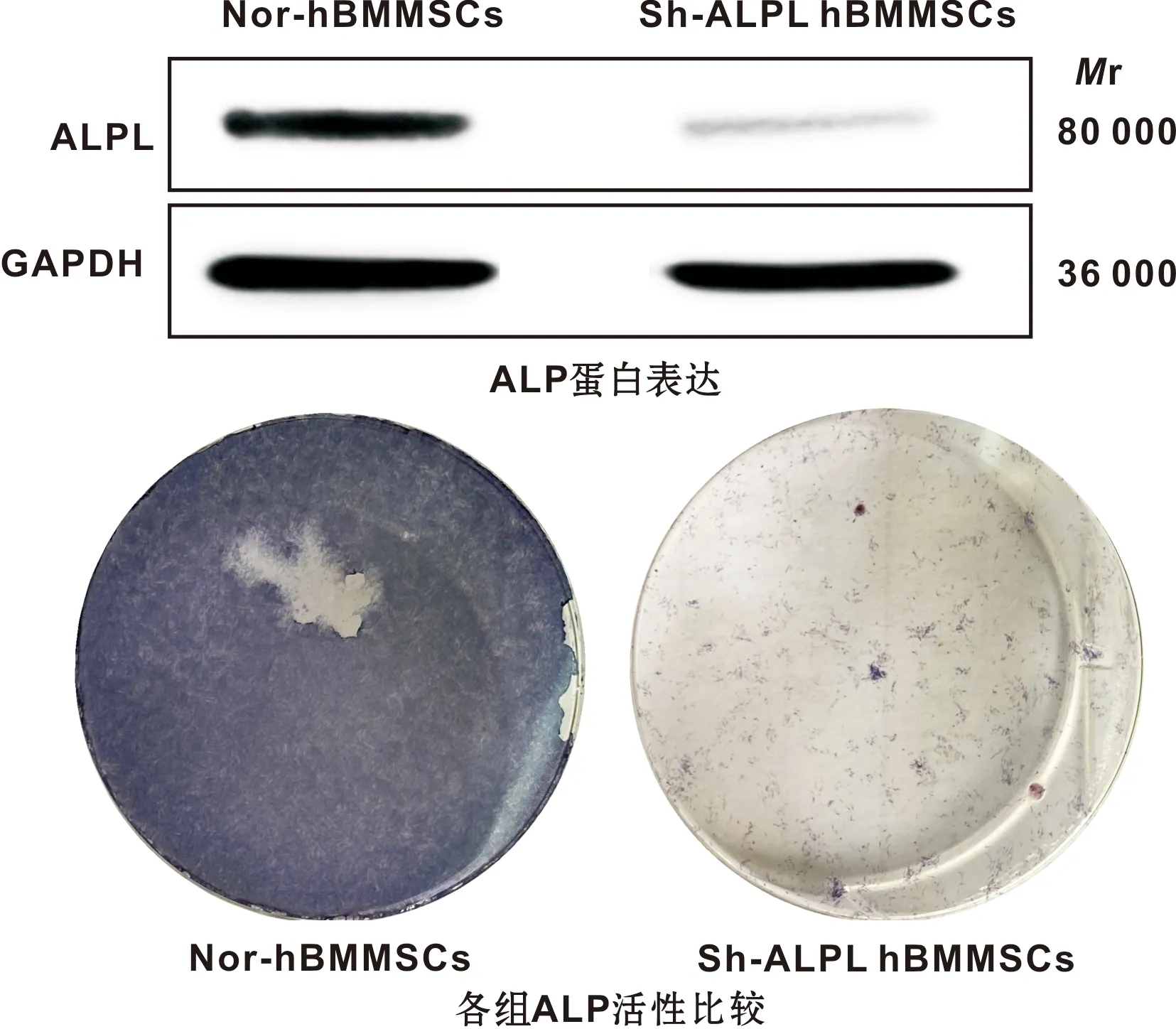
图2 ALPL转染效率鉴定结果
首先将Nor-hBMMSCs 和HPP-hBMMSCs与ECs共培养3 h,发现与ECs组相比,两者均可促进ECs的管腔形成能力,但是HPP组效果明显低于Nor组,尤其体现在管腔分支数和分支长度方面(图3)。随后,我们将WT-mBMMSCs 和ALPL+/-mBMMSCs与ECs共培养,同样发现ALPL敲除组促进ECs管腔形成能力较WT组显著下降(图4)。

图3 Nor-hBMMSCs、HPP-hBMMSCs调控ECs成管腔能力比较(×100,n=3)
为进一步证实该现象,在Nor-hBMMSCs中下调ALPL表达,观察其对ECs管腔形成的影响,发现下调ALPL组的ECs成管腔能力较Nor组明显下降,且各组均有统计学意义(P<0.05)(图5)。以上结果均表明ALPL基因在BMMSCs调控血管内皮细胞管腔形成中发挥重要作用。
最后,在ALPL敲除小鼠中进一步观察ALPL对骨内H型血管的影响。体内免疫荧光染色结果显示H型血管标记物CD31和EMCN分子在野生型小鼠股骨干骺端生长板附近高表达,相反在ALPL+/-小鼠中CD31hiEMCNhi的表达量要明显低于野生型小鼠,提示ALPL参与调控骨内H型血管化程度(图6)。
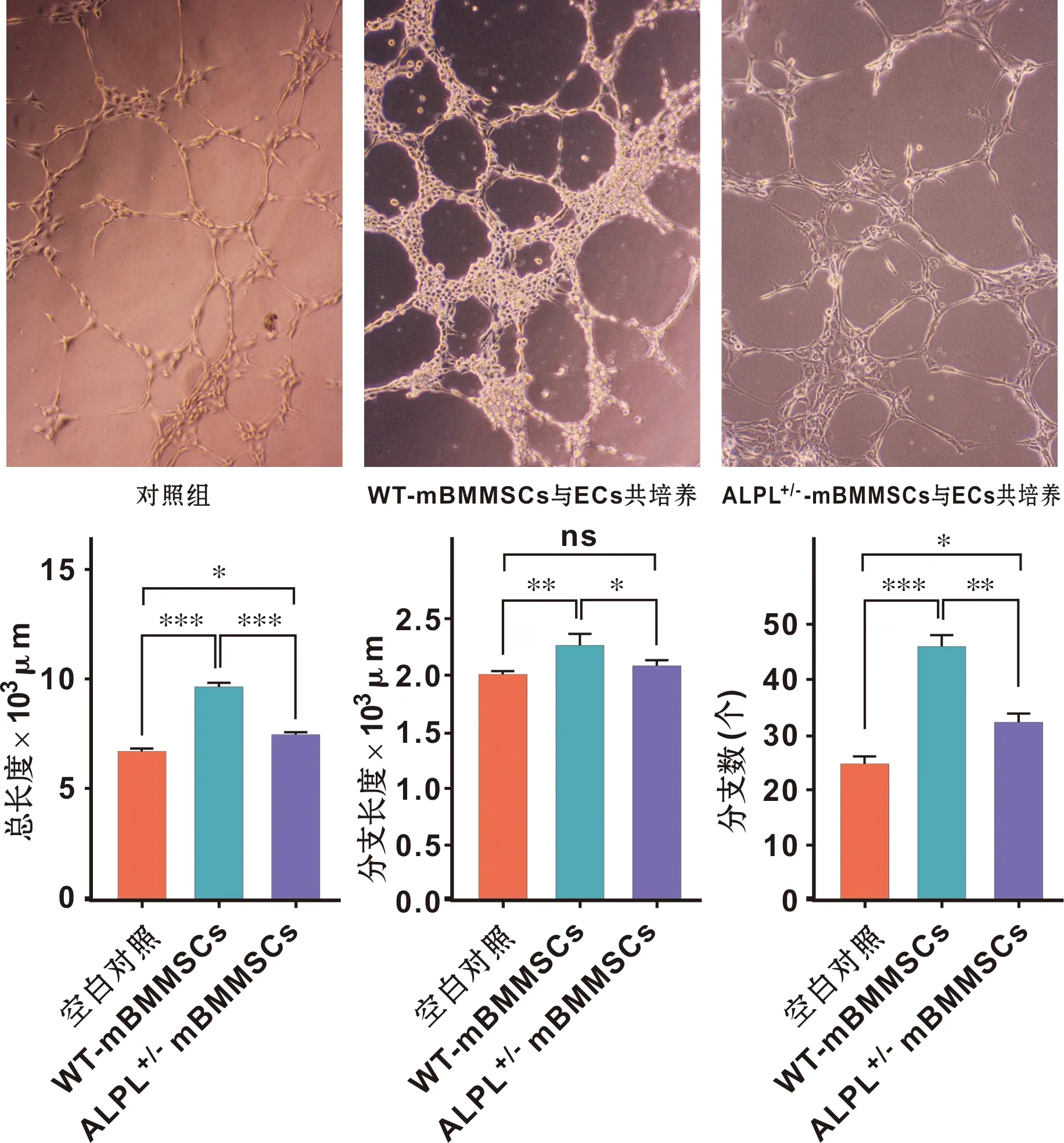
图4 WT-mBMMSCs、ALPL+/- mBMMSCs调控ECs成管腔能力比较(×100,n=3)

图5 Nor-hBMMSCs、Sh-ALPL hBMMSCs调控ECs成管腔能力比较(×100,n=3)

图6 WT与ALPL+/-小鼠股骨H型血管的变化比较(免疫荧光染色, ×100)
3 讨 论
HPP是一种以骨骼和牙齿等硬组织矿化不良为特征的单基因遗传性疾病,典型的症状表现为病理性骨折,骨早衰及骨质疏松等。骨科X线检查可见骨小梁大量丧失且排列紊乱,其病理变化的主要原因在于由ALPL编码的TNSALP功能异常,导致其未能形成高度难溶的羟基磷灰石(HA)结晶,最终无法实现牙、骨等硬组织矿化与再矿化[13-14]。另外已有体外研究显示,ALPL基因缺陷造成骨髓间充质干细胞(BMMSCs)分化异常[1-2],提示TNSALP蛋白不只在生物矿化过程中发挥关键作用,还可以影响BMMSCs生物学行为,造成骨骼生长发育异常。
骨持续性改建的动态过程中,血管新生作为骨愈合的先决条件为骨组织提供必要营养、氧气、生长因子和激素[15-16],在此过程中BMMSCs参与骨形成和内皮细胞(ECs)参与的血管化之间相互耦联以实现骨修复再生。最新研究显示,生理环境中,H型血管通过产生血管内皮生长因子(VEGF-α)、血小板衍生生长因子(PDGF-BB)、低氧诱导转录因子(HIF-1α)等积极地指导骨内血管和骨形成[7,17-18]。
HPP疾病微环境下,骨质量下降是否诱发骨内H型血管发生改性值得进行探讨。本文发现ALPL基因缺陷影响HPP患者和ALPL敲除小鼠BMMSCs对血管内皮细胞管腔形成的调控作用。另外本研究发现ALPL敲除小鼠中骨内 H型血管的数量减少。我们实验结果揭示ALPL可能在骨髓间充质干细胞调控骨内血管新生方面具有潜在作用,进一步为认识HPP病理性骨缺损提供新的方向。尽管本研究证实ALPL在调控内皮细胞管腔形成中发挥作用,但是其潜在的作用方式尚需在后续工作中进行探讨。
