FTO、MC4R、SH2B1与肥胖T2DM的关联及基因间交互作用研究
2021-04-23连明珠
耿 力,连明珠,赵 莹,陈 琰*
(吉林大学第二医院 1.血管外科;2.内分泌科,吉林 长春130041)
2型糖尿病(T2DM)是由遗传和环境因素引起的复杂疾病。目前,全球有4.63亿糖尿病患者,到2045年糖尿病的发病人数将增加到7亿[1]。在中国,糖尿病的发病率为10.9%,在超重和肥胖人群中,该值甚至更高[2]。有研究显示糖尿病和肥胖症可以独立遗传亦可共同遗传,甚或糖尿病是引起肥胖的病因[3]。肥胖者体内的非酯化脂肪酸、细胞因子、促炎性标志物等水平的升高与胰岛素抵抗发生发展相关,这些因素可导致T2DM的发生[4]。因此,阐明糖尿病的发病机制非常重要。
自1980年以来,肥胖症的发病率在全世界范围内急剧增加[5]。欧洲人群的全基因组关联研究(GWAS)已鉴定出多达200个与肥胖相关的基因或染色体区域[6]。在大脑神经元中表达FTO,MC4R和SH2B1影响中枢神经系统调节肥胖[7-8]。与白种人相比,在中国人中脂肪易于在腹部积聚,导致腹部肥胖,这与T2DM密切相关。在香港地区,台湾地区和新加坡的中国人中,FTO变异(rs8050136和rs9939609)与肥胖和BMI之间存在显著关联[9]。FTO rs8050136,FTO rs9939609和MC4R rs17782313与中国人群的BMI和肥胖可能存在显著相关性[10]。SH2B1和FTO在肥胖调节中可能发挥作用,这反过来影响了中国人群的T2DM风险[9]。肥胖与FTO,MC4R和SH2B1的关系以及这些基因对中国T2DM患者肥胖的作用尚不清楚。本研究旨在调查居住在中国东北地区的T2DM人群中FTO rs9939609,MC4R rs17782313,MC4R rs12970134和SH2B1 rs7498665与肥胖的关系。
1 材料与方法
1.1 材料
收集2015年12月—2018年3月于吉林大学第二医院内分泌科确诊的2型糖尿病患者共954例。入组标准:①年龄18-65岁;②符合WHO 1999年2型糖尿病诊断分型标准[11]。排除标准:①糖尿病酮症、高渗性昏迷等急性并发症;②肝肾功能不全、心肺功能不全等;③其他急性感染性疾病及应激反应;④1型糖尿病、妊娠糖尿病及其他特殊类型糖尿病等。根据BMI和腰围分为非肥胖T2DM组(18.5 kg/m2≤BMI<24.0 kg/m2且男性腰围<90 cm,女性腰围<85 cm)和肥胖T2DM组(BMI≥28.0 kg/m2或男性腰围≥90 cm,女性腰围≥85 cm);同期体检中心健康人群1070例作为正常对照NC组。本研究经吉林大学第二医院伦理委员会审核批准,均选自中国北方地区的常住汉族居民,彼此之间无血缘关系,且签署知情同意书。
1.2 方法
1.2.1血液基因组DNA提取 收集所有受试者肘静脉抗凝血4 mL,用CWBIO公司生产的Blood Genomic DNA mini kit提取基组DNA备用。
1.2.2临床指标 所有受试者均测量身高、体质量、腰围、计算体质量指数(BMI)=体质量(kg)/身高(m)2。禁食8-12小时,清晨留取空腹静脉血,测定空腹血糖(FBG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、糖化血红蛋白(HbA1c)、空腹胰岛素(FINS)等,并计算胰岛素抵抗指数(HOMA-IR)=(空腹血糖mmol/L×空腹胰岛素mIU/L)/22.5。
1.2.3SNP检测分析 选取FTO rs9939609、MC4R rs17782313、MC4R rs12970134、SH2B1 rs7498665四个研究热点的SNP进行研究,SNP检测分析委托北京华大基因科技有限公司进行SnapShot分型检测。
1.2.4统计学方法 应用SNPStats (http://bioinfo.iconcologia.net/SNPStats)进行LD检验及单体型分析,GMDR(version 0.9,http://sourceforge.net/projects/gmdr/)软件用于分析基因与基因之间的交互作用。采用SPSS 22.0软件进行统计学分析。所有统计学检验均为双侧检验,P<0.05为差异具有显著性。
2 结果
2.1 一般资料及血液生化指标比较
结果见表1。肥胖T2DM组患者的TG、TC、LDL-C、FINS及HOMA-IR均显著高于非肥胖T2DM组患者(P<0.05),而其高密度脂蛋白水平则低于非肥胖T2DM组患者(P<0.05)。未发现两组患者的性别、年龄、FPG及HbA1c差异具有统计学意义(P>0.05)。
2.2 两组间各基因型及等位基因频率分布的比较
FTO rs9939609 TA基因型、AA基因型及A等位基因在肥胖T2DM组的频率显著高于非肥胖T2DM组(P<0.001)。MC4R rs17782313 C等位基因、MC4R rs12970134 GA及AA基因型、A等位基因在肥胖T2DM组的频率显著高于非肥胖T2DM组。SH2B1 rs7498665 G等位基因在肥胖T2DM组的频率显著高于T2DM组,差异具有统计学意义(P<0.05)(表2)。
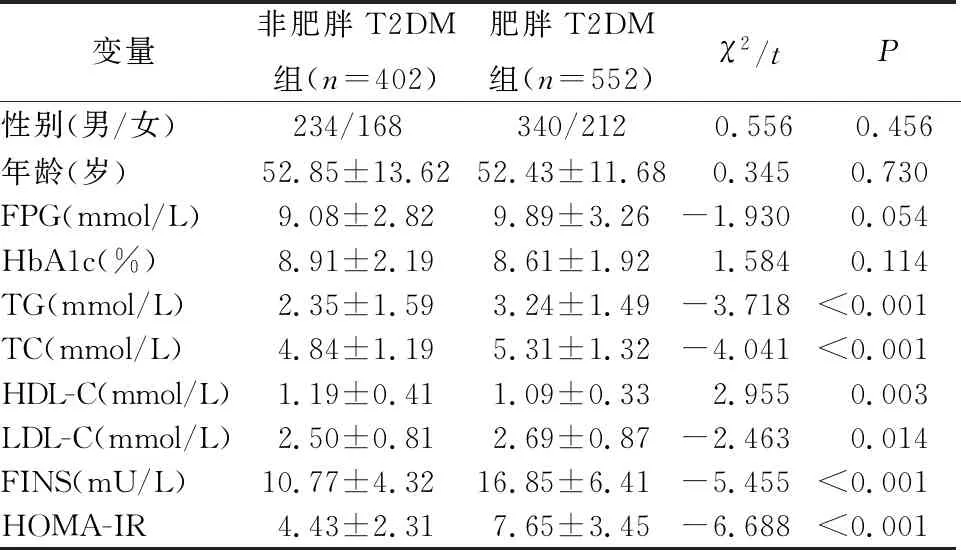
表1 非肥胖与肥胖T2DM患者一般资料及血液生化指标的比较
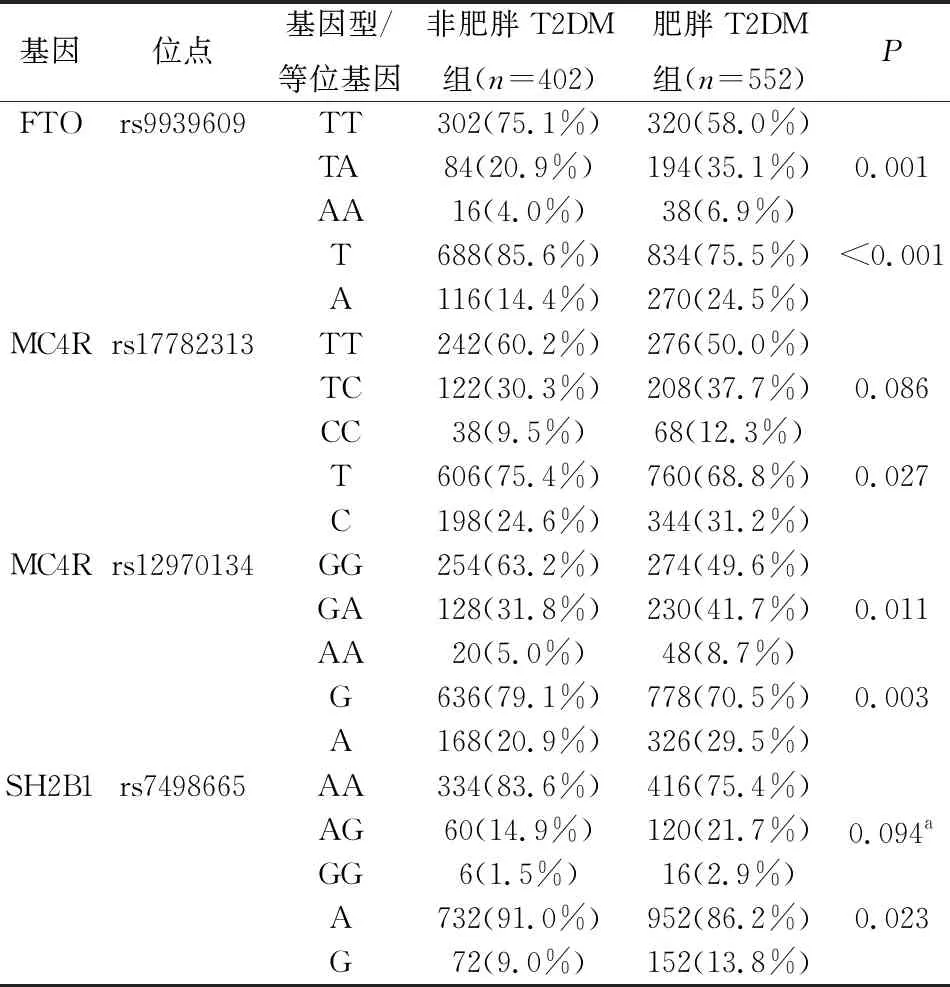
表2 非肥胖与肥胖T2DM组各基因型及等位基因频率分布的比较
2.3 基因变异与肥胖关联的单因素及多因素logistic回归分析
调整了性别、年龄及各项血液生化指标后,多因素logistic回归分析结果显示:在糖尿病患者中,FTO rs9939609 TA+AA基因型(OR=2.20,95%CI=1.43-3.37)、MC4R rs17782313 TC+CC基因型(OR=1.60,95%CI=1.07-2.39)、MC4R rs12970134 GA+AA基因型(OR=1.76,95%CI=1.18-2.63)、SH2B1 rs7498665 AG+GG基因型(OR=1.80,95%CI=1.08-2.99)与肥胖相关(P<0.05)(表3)。

表3 基因变异与肥胖关联的单因素及多因素logistic回归分析
2.4 各SNPs之间基因-基因交互作用
将各位点按照共显性模型赋值。通过 GMDR 软件进行基因-基因交互作用分析,选择交叉验证一致性及测试平衡准确度均较高的模型作为最佳模型。结果显示:四个模型的sign检验均具有统计学意义(P<0.05),其中四阶交互作用模型(rs9939609-rs17782313-rs12970134- rs7498665)其交叉验证一致性为10/10,测试平衡准确度最高,为最佳模型(表4)。其基因-基因交互作用图如图1所示。
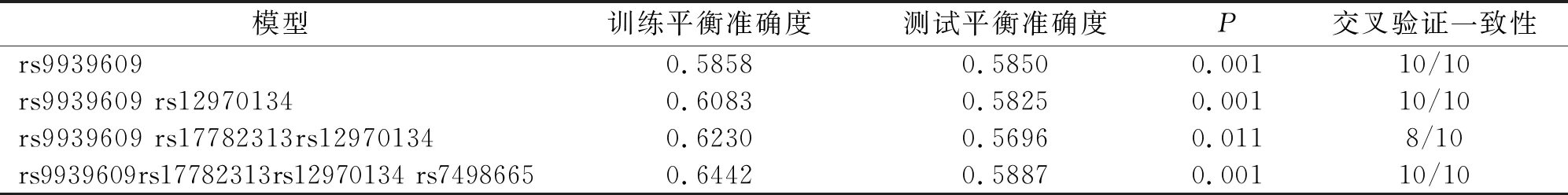
表4 MDR法分析各位点间的交互作用模型
3 讨论
流行病学资料显示,中国超重与肥胖人群的糖尿病患病率分别达12.8%和18.5%;另外,在糖尿病患者中超重和肥胖比例分别高达41%、24.3%,腹型肥胖[腰围≥90 cm(男)或≥85 cm(女)]患者占45.4%[12-13]。近年来遗传因素在疾病发展中的作用得到重视。本研究结果显示,调整了性别、年龄及各项血液生化指标后,多因素logistic回归分析结果显示:在糖尿病患者中,FTO rs9939609 TA+AA基因型(OR=2.20,95%CI=1.43-3.37)、MC4R rs17782313 TC+CC基因型(OR=1.60,95%CI=1.07-2.39)、MC4R rs12970134 GA+AA基因型(OR=1.76,95%CI=1.18-2.63)、SH2B1 rs7498665 AG+GG基因型(OR=1.80,95%CI=1.08-2.99)与肥胖相关(P<0.05)。SH2B1(rs7498665)、Near GNPDA2(rs10938397)、MTCH2(rs10838738)、Near MC4R(rs12970134)与肥胖相关性在许多研究中得到证实[14-16]。新的研究表明SH2B1也可影响非体重依赖的胰岛素的敏感性而增加T2DM发生风险[17]。Near GNPDA2(rs10938397)也在亚洲人群中研究表明增加了T2DM发生风险,依赖或者不依赖BMI[18]。在中国的研究也发现在调整了BMI 后MC4R(rs12970134)与T2DM发生相关[19]。
在这项研究中,比较了非肥胖T2DM组和肥胖T2DM组的人口统计学特征和血液生化指标;糖尿病患者组和健康对照组在FTO rs9939609,MC4R rs17782313,MC4R rs12970134或SH2B1 rs7498665的基因型或等位基因分布上没有差异。FTO rs9939609 TA基因型,FTO rs9939609 AA基因型和FTO rs9939609 A等位基因,MC4R rs17782313 C等位基因,MC4R rs12970134 GA基因型,MC4R rs12970134 AA基因型,A等位基因在肥胖T2DM组比非肥胖T2DM组中的高。T2DM患者与肥胖相关的基因型为FTO rs9939609 TA,FTO rs99396-09 AA,MC4R rs17782313 TC,MC4R rs17782313 CC,MC4R rs12970134 GA+AA和SH2B1 rs7498-665 AG+GG。这些SNPs还观察到了风险等位基因的组合作用。这些结果表明,FTO rs9939609,MC4R rs17782313,MC4R rs12970134和SH2B1 rs7498665可能在遗传上使中国东北地区的T2DM患者容易患肥胖症。
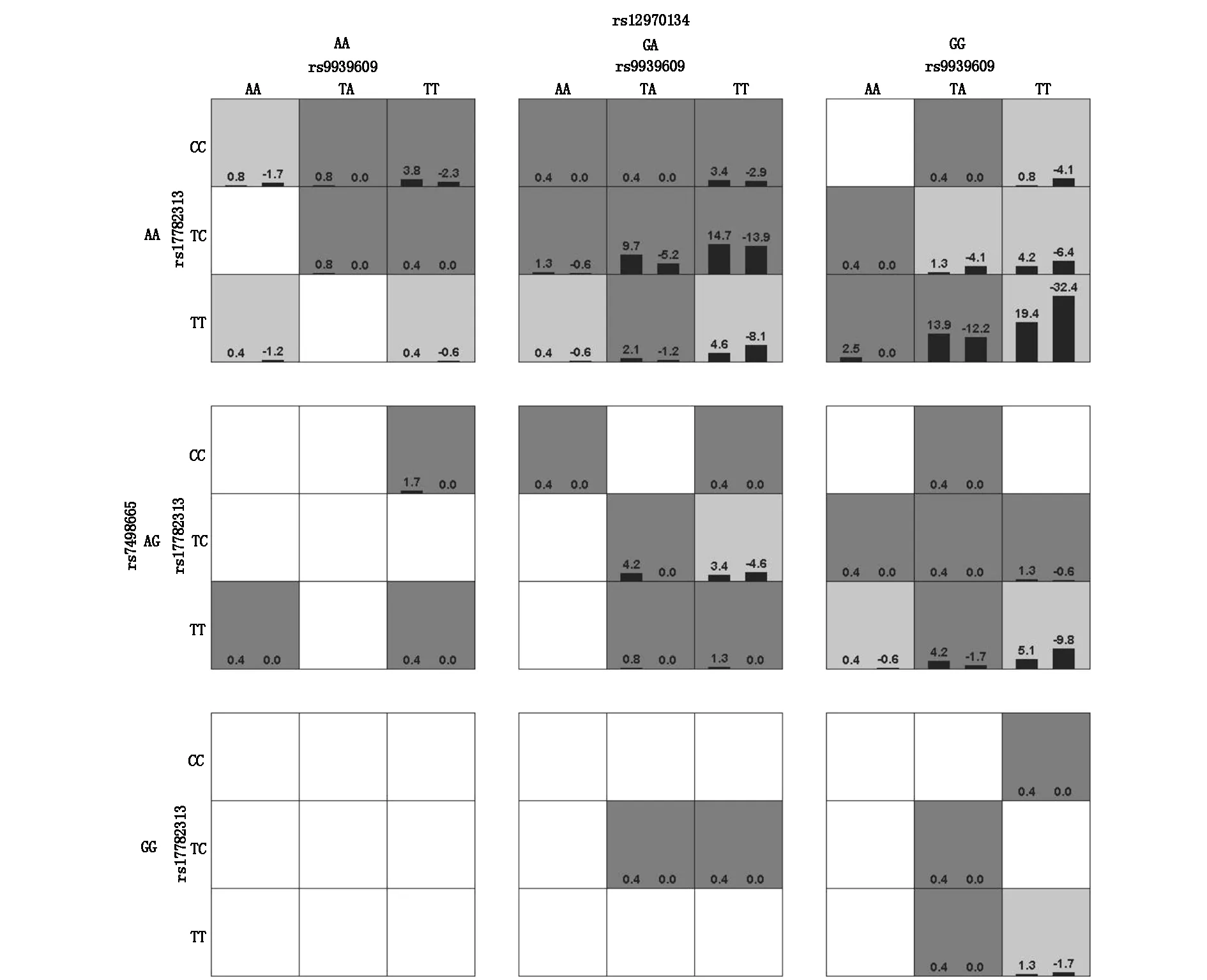
图1 基因-基因交互作用图
与非肥胖型T2DM患者相比,肥胖型T2DM患者的BMI和腰围较高,TG,TC,LDL-C,FINS和HOMA-IR较高,而HDL-C较低。这些发现与以前的报道[4]一致,肥胖与T2DM患者的脂质状况和胰岛素敏感性较差有关。在FTO rs9939609,MC4R rs17782313,MC4R rs12970134或SH2B1 rs7498665的基因型或等位基因的分布方面,糖尿病患者组与健康对照组之间没有发现差异,这与Huang等人的观察结果一致[10],但没有Maggie等人报道的观察结果[9]。研究之间的差异可能是由于研究人群之间的地理差异所致。本文的结果表明FTO rs9939609,MC4R rs17782313,MC4R rs12970134和SH2B1 rs7498665可能与中国东北地区的T2DM患者没有直接关系。
肥胖T2DM组中FTO rs9939609 TA和AA基因型,A等位基因,MC4R rs17782313 C等位基因,MC4R rs12970134 GA和AA基因型,A等位基因和SH2B1 rs7498665 G等位基因的频率高于非肥胖T2DM组。FTO rs9939609 TA+AA基因型,MC4R rs17782313 TC+CC基因型,MC4R rs12970134 GA+AA基因型和SH2B1 rs7498665 AG+GG基因型与T2DM患者的肥胖症相关。这些结果与以前的观察结果一致,即FTO变体(rs8050136和rs9939609)和MC4R rs17782313与肥胖症和BMI升高有关[20-21],SH2B1和FTO在肥胖的调节中发挥作用[9],先前的研究还显示,中国人群中的MC4R(rs12970134)与T2DM相关[22]。SH2B1(rs7498665)和MC4R附近(rs12970134)在许多人中也与肥胖相关[23]。关于中国亚组中FTO变异与肥胖和BMI的关系,本文的观察结果与Li等和Al-Attar等报道的观察结果之间的差异可能反映了调查特定亚群[24]。结果发现在亚洲人中,靠近MC4R(rs12970134)和靠近GNPDA2(rs10938397)的SH2B1(rs7498665),增加了T2DM的风险[25]。通过GMDR软件进行基因-基因交互作用分析,选择交叉验证一致性及测试平衡准确度均较高的模型作为最佳模型。结果显示:四个模型的sign检验均具有统计学意义(P<0.05),其中四阶交互作用模型(rs9939609-rs17782313-rs12970134- rs7498665),其交叉验证一致性为10/10,测试平衡准确度最高,为最佳模型。提示在肥胖T2DM发病过程中,rs9939609-rs17782313-rs12970134- rs7498665间可能存在交互作用。
总之,FTO rs9939609,MC4R rs17782313,MC4R rs12970134和SH2B1 rs7498665与糖尿病无关。肥胖T2DM患者的FTO rs9939609,MC4R rs17782313,MC4R rs12970134和SH2B1 rs7498665风险基因型和等位基因的频率较高。这些SNP的危险基因型和等位基因与T2DM患者的肥胖有关,同时这些SNP可能单独或交互作用使居住在中国东北的T2DM患者更易肥胖。
