电针治疗脊髓损伤动物实验研究进展*
2021-04-22孙忠人卢英琦胡其回尹洪娜
孙忠人,卢英琦,胡其回,张 淼,尹洪娜△
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨150001)
脊髓损伤(spinal cord injury,SCI)是世界范围内常见的具有高度致死性和致残性的中枢神经系统疾病[1],包括原发性机械损伤和由复杂病理生理改变介导的继发性损伤。据统计,每年SCI全球发病人数高达25~50万[2]。目前SCI主要治疗方法包括手术、药物、激素治疗、行为治疗、物理治疗等[3-6],但由于这些疗法存在潜在并发症以及本病复杂的病理生理学特点,使越来越多脊髓损伤患者开始选择针灸等替代疗法[7]。
SCI分子和生化改变与水肿、缺血、细胞凋亡、微循环障碍、胶质瘢痕形成、炎症反应等密切相关[8-9],对损伤后的微环境造成严重的后果,而这对中枢神经系统再生过程至关重要。既往临床研究表明,电针作为针灸特色疗法的一种,在对脊髓损伤及其并发症治疗中,包括运动障碍、神经性疼痛、痉挛、脊髓空洞症等,疗效显著,有助于患者远期神经和功能恢复[10-13],为临床应用提供了循证依据。日前,业内在探讨电针对脊髓损伤潜在分子机制的影响方面,争论激烈,各种假说林立纷繁,动物实验系验证其具体发病机理的关键锁钥。现通过对电针治疗脊髓损伤动物实验研究文献总结分析,探求电针疗法作用靶点,为临床诊治、选穴提供稳固依据,并对电针治疗SCI的机制研究进行展望。
1 资料与方法
1.1 检索方式 选用近5年中国知识资源总库(中国知网,CNKI)、万方数据、维普网及 PubMed、Web of Science中发表的有关单纯电针为主要治疗方案治疗脊髓损伤动物模型方面的实验研究文献。在检查筛选时,采用主题词和自由词结合的检索方式。中文检索词分别为“脊髓损伤”“截瘫”“电针”“电针疗法”“动物模型”“实验研究”等,英文检索词为“spinal cord injury”“paraplegia”“electroacupuncture”“animal model”“experimental study”等。
1.2 纳入标准 ①文献发表年限为2016年6月1日至2021年4月1日;②研究类型为动物实验研究文献,文种限中文、英文;③干预措施为单纯电针的治疗方式为主疗法。
1.3 排除标准 ①个人经验总结、研究进展、文献综述、临床实验的文献;②全文不完整文献;③没有采用电针治疗或存在2种以上干预措施的文献;④硕博士学位论文及会议论文;⑤无具体观察指标;⑥重复发表的临床研究,纳入文献质量较高的1篇;⑦采用功能性核磁共振、正电子发射计算机断层显像(PET)的方法观察针刺治疗脊髓损伤动物模型效应的文献。
1.4 文献筛选结果 根据上述检索词检索后共得到相关文献422篇,剔除不相干和重复文献139篇后,依据纳排标准对剩余文献进行详细阅读总结后,共纳入23篇相关文献,其中中文17篇,英文6篇。
2 结果
经研究结果统计显示,电针治疗SCI动物实验研究腧穴配伍频率最高的为大椎-命门及夹脊穴,出现频次前两位的分别为大椎、夹脊穴。针刺干预SCI作用机制主要为抑制炎症反应、改善微循环、抑制细胞凋亡、促进髓鞘再生作用等方面。结果见表1。
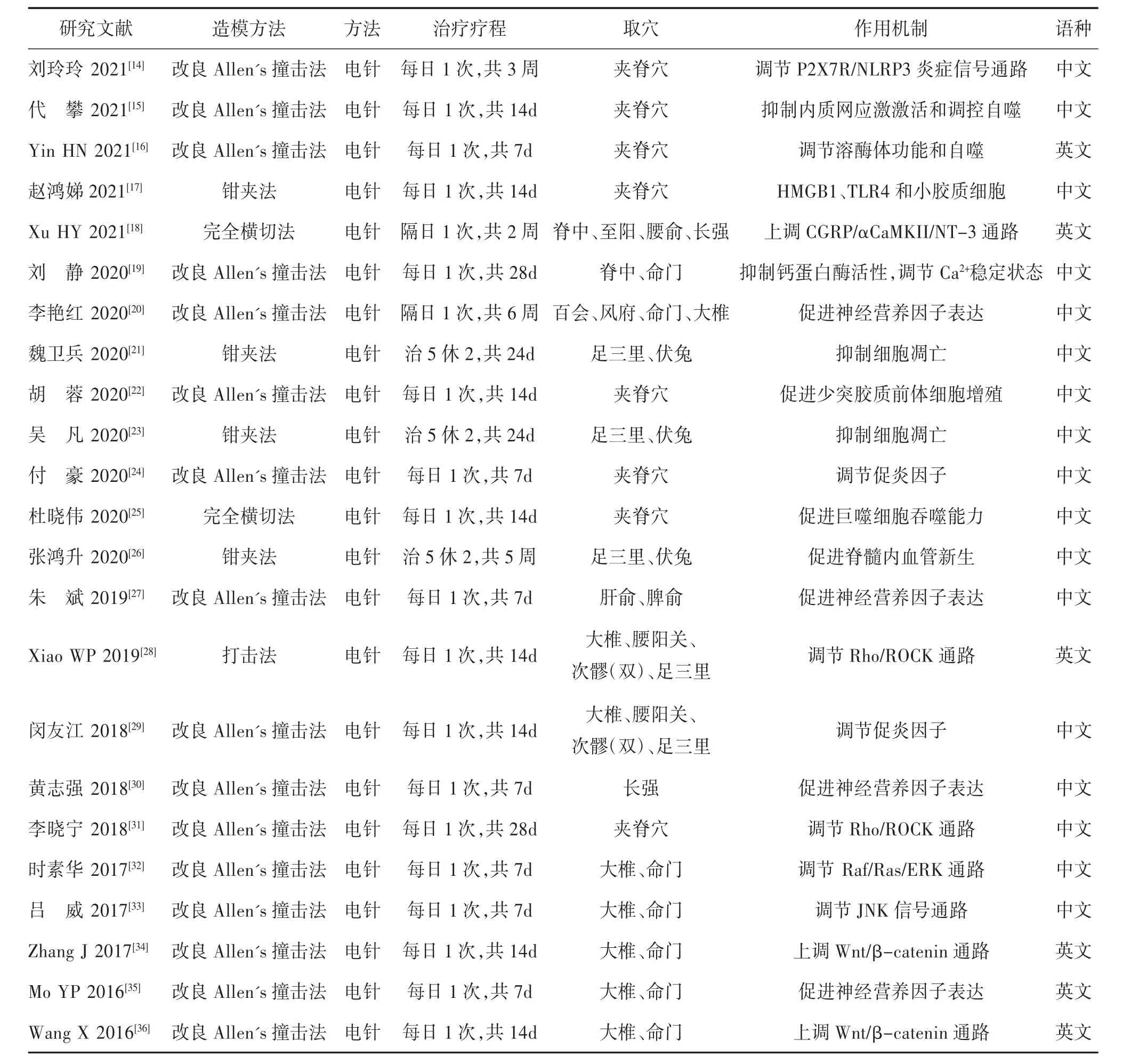
表1 针灸治疗SCI的动物实验研究汇总
3 电针治疗脊髓损伤作用机制
3.1 电针抑制炎症反应 SCI中的炎症反应具有双向保护和损伤作用,波及到神经与免疫两大系统[37],受微环境局部轴突再生和损伤神经元修复限制、血-脊髓屏障破坏、外周血白细胞与先天免疫细胞(小胶质和星形胶质细胞)共同作用,在数小时内上调TNF-α、IL-1β、IL-6 等促炎因子浓度,这些介质对中枢神经系统细胞产生细胞毒作用,导致小胶质细胞和巨噬细胞脱髓鞘和神经元丢失[38-39]。电针夹脊穴可以调控嘌呤受体P2X7(P2X7R)和核苷酸结合寡聚化结域样受体蛋白3(NLRP3)炎症小体表达,进而阻断炎症因子IL-1β和IL-18释放[14],调节高迁移率族蛋白B1(HMGB1)、Toll样受体 4(TLR4)水平[17],下调 Caspase-1、IL-1β、IL-18 表达[24]。NLRP3 炎症小体作为一种胞浆蛋白复合物,在神经元、小胶质细胞和星形胶质细胞中均有表达[40],抑制NLRP3激活可控制神经炎症,减轻线粒体功能障碍,P2X7R是激活NLRP3最有效的因子之一,同时与Caspase-1、IL-1释放密切关联[41],阻断P2X7R-NLRP3炎症信号通路,为脊髓继发性损伤恢复提供治疗新靶点。HMGB1在SCI后从坏死细胞被动释放,血清和胞浆浓度明显上升,并通过晚期糖基化终末产物受体-核因子κB(RAGE-NF-κB)信号通路,将小胶质细胞极化为促炎表型[42],引起下游炎性因子释放。TLR4作为Toll样受体中与HMGB1最密切因子,会诱导NF-κB和环氧化酶-2(COX-2)水平上调[43],抑制 HMGB1/TLR4可发挥抗炎、保护神经功效。电针大椎、腰阳关、双侧次髎、足三里可抑制胞浆型磷脂酶A2(c PLA2)、降低前列腺素 E(PGE)含量[29]。c PLA2和 PGE是Nogo/NgR和下游Rho/Rock的前炎症反应因子,可加速促炎反应。
3.2 电针改善微循环,促进营养因子分泌 成年中枢神经系统脊髓损伤后,轴突不可再生,这归因于血管周围功能、结构损伤的互相影响[44],及周围局部环境既缺乏生长促进因子、又包含许多生长抑制因子。即使轴突再生,也很难与正确的突触后神经元链接,进而恢复正常功能。理想的再生环境包含高浓度神经生长因子的存在,这些因子能克服抑制影响,引导轴突到达适当靶点,并对非受损群体无负面影响。神经生长因子家族包括神经生长因子(NGF)、脑源性神经营养因子(BDNF)和神经营养素3(NT-3)3类。均可与原肌球蛋白受体激酶(Trk)受体和泛神经营养素(P75NTR)受体结合[45],激活或上调下游信号通路如磷脂酰肌醇 3-激酶(PI3K)/蛋白激酶 B(AKT)、磷脂酶 C-γ(PLC-γ)、GTP 结合蛋白(RAS)/丝裂原活化蛋白激酶(MAPK)等[46],在神经元存活、轴突生长及突触可塑性中占据重要地位。电针百会、风府、命门、大椎能上调BDNF、NT-3mRNA及蛋白水平[20]。电针肝俞、脾俞可促进SCI后BDNF、NGF和NT-3表达,增强运动功能恢复[27]。电针长强穴可调控NGF和BDNF水平[30]。BDNF与TrkB受体结合对损伤神经元有保护和促生长作用,促进轴突再髓鞘形成[47],并在一定程度上减轻谷氨酸诱导细胞凋亡[48]。NGF能维持和促进神经元存活,并诱导感觉神经元轴突的生长[49]。电针大椎、命门可上调NT-3水平,对脊髓周围环境有保护作用[35]。NT-3与TrkC受体高亲和[50],可防止神经轴突退化,促进神经发育再生。通过电针脊中、至阳、腰俞、长强四穴可激活CGRP/αCaMKII/NT-3信号通路,触发NT-3合成及分泌,增强脊髓内源生长能力,加强轴突再生[18]。
但由于SCI继发损伤会造成大量神经元死亡,仅仅依靠神经营养因子自身表达很难发挥最优效果,需要对神经营养因子进行有效调控。抑制轴突生长髓鞘相关抑制因子(MALs),主要包括轴突生长抑制因子(Nogo)、髓鞘相关糖蛋白(MAG)和少突胶质细胞髓鞘糖蛋白(OMgp)3类[51],其受体NgR含量的增多有助于神经恢复,减轻炎症。电针夹脊穴可促进NgR表达,提高巨噬细胞吞噬能力[25]。此外,电针伏兔、足三里可以上调缺氧诱导因子1α、血管内皮生长因子的mRNA及蛋白的表达,为构建良好的血氧微环境提供依据[26]。
3.3 电针抑制细胞凋亡,增强神经修复 细胞凋亡会造成损伤脊髓功能障碍,探索细胞凋亡特异性分子途径有利于脊髓损伤的治疗和恢复。
3.3.1 调节内质网应激和自噬 内质网应激(ERS)是凋亡关键性途径之一。内质网主要包括粗面和光面两种,参与蛋白质平衡的各个方面,对维持细胞功能和内环境稳态有着不可或缺的作用。若局部出现缺氧缺血、病毒细菌感染、温度变化等生理病理改变,就会导致内质网紊乱、引发ERS的产生[52],过度ERS会启动凋亡程序。
脊髓损伤后,由于局部微环境存在多种应激源,内质网中未折叠蛋白积累诱导未折叠蛋白反应(UPR)的激活(包含ATF6、PERK、IRE1 3类[53])。内质网伴侣分子葡萄糖调节蛋白78(GRP78)是内质网应激的关键标志物,可与UPR结合,阻止错误折叠蛋白的输出。但长时间过度的UPR最终会触发细胞凋亡,启动凋亡信号分子[54],如CHOP、TRAF2和Caspase-12等3个关键途径[55],加速组织损伤速度。正常情况下CHOP表达量很低,但内质网应激后暴露在过量内质网应激下的少突胶质前体细胞促进CHOP含量增多,下调B细胞淋巴瘤2(Bcl-2)基因,上调促凋亡Bax表达[56-57],此外CHOP还可通过抑制细胞周期调节蛋白p21引发细胞死亡[58]。少突胶质前体细胞(OPC)凋亡抑制再髓鞘形成,并扩大受损脊髓面积[59]。TRAF2可经IRE1集聚,激活Caspase-12,进而激活Caspase-9和Caspase-3表达,加速细胞凋亡进程[55]。电针夹脊穴能下调GRP78、Caspase-12、CHOP表达,抑制内质网应激激活[15],并促进OPC增殖,对运动功能恢复提供积极作用[22]。
自噬是细胞分解自身成分的动态平衡过程,可触发受损细胞器和错误折叠蛋白质的自我降解,形成自噬小体,最后被溶酶体酶降解[60]。诱导自噬可保护运动神经元免于变性,缓解SCI后痉挛性瘫痪,是维持中枢神经系统稳态必不可少的过程[61]。其主要标志物LC3-II反映了自噬小体的数量,P62是自噬货物蛋白,增加自噬通量。内质网应激可通过PERK-eIF2α、IRE1-ASK1-JNK和CaMKK-腺苷酸活化蛋白激酶-哺乳动物雷帕霉素靶蛋白3条通路诱导细胞自噬[62]。内质网应激调节是在不同应激条件下通过调节自噬和凋亡来实现细胞稳态平衡的关键过程,内质网自噬(reticulophagy)可通过消除UPR、清除受损内质网、降解蛋白聚体等途径使蛋白正确折叠、促进内环境平衡稳定[52]。研究显示,电针夹脊穴发现电针可以调节溶酶体功能和自噬[16],还可以通过抑制内质网应激并激活自噬[15],清除错误折叠蛋白,维持脊髓损伤局部内环境平衡,延缓凋亡进程。
3.3.2 调节钙蛋白酶活性 钙蛋白酶(calpain)是属于Ca2+依赖性的非溶酶体半胱氨酸蛋白分解酶家族,可通过解阮靶蛋白从而控制细胞重构、分化和凋亡过程[63]。其家族成员互为同工酶,在机体组织内广泛分布的为calpain1和calpain2两种[64],能参与到蛋白水解、自噬、细胞凋亡等生理过程。正常情况下,calpain在胞质内以酶原形式存活,若细胞内钙离子浓度增加,则calpain可通过与Ca2+结合被激活,过量钙蛋白酶表达会引起蛋白沉积、水解蛋白结构细胞表达失衡[65]。SCI后,受损局部受到缺血缺氧刺激,处于稳定状态的Ca2+浓度失调,含量大幅度升高,造成calpain异常表达。钙蛋白酶在细胞凋亡中主要通过对凋亡途径调控,例如导致促凋亡基因Bcl-2/Bax失衡、Caspase-3激活、溶酶体功能紊乱、线粒体功能异常等等,引发脊髓功能丧失,加重病情。calpain裂解后会激活Caspase-3表达,Caspase-3水解又会促进calpain活性,并阻止钙蛋白酶抑制剂的抑制作用,形成双向变化环路[66],进一步促进凋亡。calpain和Caspase-3也存在相似底物,例如细胞骨架、转录因子等,两者形成的通路在细胞凋亡方面有独特复杂作用。活化的calpain还可通过上调钙调神经磷酸酶(CaN)表达激活细胞凋亡[67]。此外,SCI损伤会上调calpain1 mRNA水平,但对 calpain2表达无明显影响[19]。calpastatin为calpain抑制蛋白,可与后者结合抑制活性[68]。研究发现,电针脊中、命门穴可上调calpastatin,抑制calpain1蛋白表达,进而对脊髓损伤和运动功能起到修复和改善的作用[19]。
3.3.3 调节凋亡相关蛋白 Bcl-2家族蛋白是通过线粒体途径调控凋亡的重要蛋白质,它可与凋亡中的死亡受体途径共同作用调节Caspase-3含量,最终决定细胞凋亡与否[69]。其最具代表性的基因为抑制凋亡因子Bcl-2和促凋亡因子Bax等。Bcl-2可在线粒体膜上构建阳离子通道,影响细胞色素C(Cytc)释放,发挥抑制作用,促凋亡因子Bax主要在细胞质内,受凋亡因子诱导时,会破坏线粒体膜的完整性,激活Caspase,加速细胞凋亡进程。两者相反相成,协同调控,维持凋亡中的动态平衡。Bcl-2/Bax竞争性的二聚体化过程决定细胞对凋亡信号敏感性,二者构建成平衡体系,所代表的蛋白比值决定细胞是凋亡还是存活[70]。半胱氨酸蛋白酶(Caspase)家族也是凋亡过程中的重要参与者,目前共发现14种,其中Caspase-3与凋亡关系最为密切,通常Caspase-3以酶原形式在细胞内存活,需要通过转活化和非蛋白酶活化等形式被激活。前者指当刺激发生时,活化的凋亡信号会首先激活上游Caspase启动因子如 Caspase-8、Caspase-9等,引起级联反应,继而启动Caspase-3功能,活化的Caspase-3会造成核酸断裂,凋亡不可逆性发展[71]。后者则指酶原可被非蛋白酶物质如阿特拉津(ATZ)、盐霉素(SAL)等上调 Caspase-3 表达[72]。此外,研究发现Caspase-3与细胞焦亡关系密切,可通过切割gasdermin(GSDM)蛋白参与炎症反应[73]。电针足三里、伏兔有助于降低Caspase-3表达[21],同时还可上调Bcl-2/Bax比值[23],减少细胞凋亡,促进损伤神经修复再生。
3.3.4 调节相关信号通路 Rho/Rock信号通路广泛存在于神经系统中,与突触结构功能改变、神经细胞损伤修复等存在密切联系。Rho/Rock的过度激活会导致肌球蛋白轻链磷酸化中断,继而引发神经生长锥塌陷。研究显示SCI后7 d内,在脊髓白质、灰质及星形胶质细胞和少突胶质细胞中都检测到Rho信号激活[74]。说明Rho信号参与到调控脊髓损伤病理生理的不同方面,包括胶质瘢痕增生、神经细胞凋亡等各个方面。脊髓损伤的修复可以归因于侧支纤维的重构[75],下调Rho/Rock通路表达有助于神经元的恢复。电针大椎、腰阳关、双侧次髎、足三里可以下调Rho/Rock信号通路,进而对髓鞘抑制因子NOGO及其受体NGR、胞浆磷脂酶 A2(CPLA2)等的活性产生影响[28]。ROCK II是 Rho重要的下游效应分子之一,电针夹脊穴可减轻ROCK II表达,减少抑制因子RhoA和MLC含量,促进神经功能恢复[31]。
丝裂原活化蛋白激酶(MAPK)信号通路包括ERK、JNK、p38MAPK等通路,影响到炎症反应、细胞凋亡、轴突再生及缺血再灌注等各个方面[76]。ERK通路可磷酸化转录因子及蛋白激酶底物,调节蛋白合成及基因转录等[77]。JNK是一种促分裂原活化蛋白激酶,又称为c-Jun氨基末端激酶,可与c-Jun结合,参与细胞生长、发育、分化及凋亡。脊髓损伤后会出现局部磷酸化c-Jun氨基末端激酶(p-c-Jun)的大量聚集,加重神经损伤的过程[78]。p38MAPK与应激情况下的炎症表达、细胞重构和细胞凋亡等有关,影响下游基因转录和翻译。电针大椎、命门穴可上调Raf/Ras/ERK信号通路表达[32],降低p-c-Jun的表达,抑制细胞凋亡[33],促进运动功能及神经元的修复。
Wnt/β-catenin信号通路是调节神经元的重要因子,Wnt蛋白是一个信号蛋白大家族,参与脊髓神经元长轴突生长调节。β-catenin是其关键组成部分,被激活时,可以移位到细胞核,与转录因子相互作用,诱导靶基因表达改变,促进神经干细胞分化,并抑制其向星形胶质细胞分化[79]。电针大椎、命门能增强Wnt/β-catenin通路表达,促进细胞向脊神经元分化,增强脊髓损伤后神经元的恢复[34,36]。
4 造模方法选择
良好的动物模型建立是保证实验成功的基础,脊髓损伤大鼠造模方法包括打击法、横切法、钳夹法等。目前临床常用的Allen's撞击法,是在原有方法的基础上进行改进后的动物造模方式,可引起模型脊髓水肿及缺血,与人类脊髓损伤病理生理特点类似,具有重复性,可实施性强的特点[80]。各种方法各有利弊,需要研究者根据实验情况的需求进行相应选择。
5 讨论
当前随着研究技术的进步和治疗手段的发展,对脊髓损伤的认识也得到不断深入。本病现有的治疗手段多样,包括药物治疗、神经营养因子治疗、细胞移植、基因治疗和生物材料移植等,但由于这些手段存在治疗价格昂贵、存在后遗症等问题,使中国传统治疗手段针灸得到越来越多的重视。临床观察、动物研究、综述表明,针灸可以有效治疗脊髓损伤后一系列并发症,包括运动和感觉障碍、疼痛、压疮、痉挛和骨质疏松等。
电针作为针灸治疗方式的一种,兼顾针刺和电流刺激的双重效应,在临床实践中得到广泛应用。根据动物实验和临床研究发现电针治疗SCI机制主要包括:①抗氧化和抗炎;②上调神经营养因子,促进微环境平衡;③抑制神经元凋亡;④调节相关信号通路等几方面,可显著改善脊髓损伤远期神经功能恢复,为患者提供一种风险最小的新型治疗手段。
目前研究电针治疗脊髓损伤的穴位主要以大椎-命门穴、夹脊穴为主。督脉主一身阳气,为“阳脉之海”,若督脉受损则阳气不能四布,气血运行不畅而致气滞血瘀,其循行路线与SCI发病部位密切相关,大椎位于第7颈椎棘突下,胸椎与颈椎交汇处,上撑头部,下连脊骨,有支撑椎体之效。命门为原气之所系,蕴藏先天之气,具有培补肾气、强腰健脊的效用。将电针刺激用于督脉穴,能促使经脉气血运行加速,调整阴阳、扶正祛邪。夹脊穴在脊柱旁开半寸,也可以说从属于督脉和足太阳膀胱经,深层为胸、腰神经的后支,电针夹脊穴可刺激脊神经感觉与运动纤维,并能刺激与脊神经伴行血管,实现对内部环境的基本调节。此外,尚可将足阳明胃经中的足三里、伏兔作为治疗脊髓损伤的代表穴位,取胃经多气多血、束骨而利机关之意,体现了针灸治疗多样性、灵活性的特点,值得临床借鉴。
不过本文尚存在一些不足之处,比如只纳入了单纯电针的动物模型实验,当前电针结合康复训练、电针结合干细胞移植、电针结合药物等治疗方式也越来越受到关注和研究,促进传统理论和研究在现代医学实践中的结合,中西并用共同治疗脊髓损伤,为临床提供有效选择。此外,电针治疗仍存在一些争议,需要指导原则来规范穴位、刺激频率等,未来还需要大规模、多中心的针灸试验方法。研究人员尚需提高科研能力,将传统思维与现代思想相结合,为中医治疗疾病注入新鲜动力,以更有利于中医药的现代化发展。
