基于化学计量学的指纹图谱法鉴别金线莲及其混伪品
2021-04-21彭琴邹福贤许少华张勋徐伟林羽陈抒云许文
彭琴,邹福贤,许少华,张勋,徐伟,林羽,陈抒云* ,许文*
(1.福建中医药大学药学院,福建 福州 350122;2.福建中医药大学生物医药研发中心,福建 福州 350122)
金线莲是兰科开唇兰属植物金线兰[Anoectochilusroxburghii(Wall.) Lindl]的干燥全草,具有清热凉血、祛风利湿之功效,用于治疗肾炎、支气管炎、膀胱炎、糖尿病、风湿性关节炎等[1]。金线莲为新资源食品、珍贵的药食同源植物,主要含有黄酮、多糖、有机酸、挥发性化合物和核苷类等[2-8],具有抗糖尿病、抗氧化、保肝等多重功效[9-13]。
药食同源金线莲由于其价格昂贵,尤其是野生资源和林下仿野生种植,市场价每公斤超过万元[3],课题组承担原福建省食品药品监督管理局金线莲质量标准提升专项,调研发现市场上充斥着存在较多的金线莲混伪品,如长片金线兰、滇越金线兰、丽蕾金线兰、台湾银线兰、血叶兰、斑叶兰和虎耳草等[14],这些混伪品在干燥的状态下的外观与金线莲极其相似,仅凭外观评价往往难以明辨真伪,一定程度上影响金线莲的食用安全。林美珍等[15-16]分别对金线莲与台湾银线兰和斑叶兰的显微结构进行了比较区分;另有研究从多糖和总黄酮的水平比较了金线莲与混伪品[17-19];张铁等[20-21]分别从DNA水平比较区分了金线莲与滇越金线兰和台湾银线兰的区别,Hu等[22]利用ITS2序列对金线莲及其混伪品进行了鉴定;王海阁等[23]选用了16对SSR多态性引物可用于不同品系金线莲与台湾银线兰的鉴别;Li等[24]采用近红外技术对金线莲、斑叶兰和血叶兰进行了鉴别。这些方法对区分金线莲与其混伪品提供了技术手段,促进金线莲与真伪的鉴定的水平,但是依然存在显微鉴别、总黄酮、总多糖等方法专属性不够;近红外法建库样本量大,缺乏全部混伪品的数据库;DNA水平鉴别实验多需要新鲜嫩叶,操作容易受到样品干扰并且在金线莲同属不同种的区分上存在难度,同时以往已有研究鉴别的混伪品相对较少,多集中于斑叶兰、血叶兰和台湾银线兰,样品具有局限性。
现代化学研究表明不同基原金线莲植物的化学成分有差异[25],高效液相色谱(HPLC)指纹图谱是一种建立的化学成分基础上的综合的、可量化的鉴定手段,能够用于中草药整体质量控制的一种技术[26]。吴萍萍等[27]对齿唇兰建立指纹图谱并确定22个共有峰并成功用于银线莲的区分;隆林等[28]对兴仁金线莲进行指纹图谱建立,确定20个共有峰;秦朋[29]对金线莲建立指纹图谱并确定20个共有峰;黄可可[30]对6批次广西金线莲建立指纹图谱,确定7个共有峰;张藏蔓等[31]建立了不同来源金线莲的超高效液相色谱-飞行时间质谱指纹图谱;陈莹[32]建立组培、栽培、野生金线莲HPLC指纹图谱,比较了野生金线莲与台湾银线兰、血叶兰的相似度,这些已有的金线莲指纹图谱,仅仅建立了自身的指纹共有峰,对于多种混伪品的区分不够全面,缺乏化学计量学层面的真伪鉴别,尚未提出差异标志物,并且指纹图谱共有峰的指认较少无法有效用于金线莲的真伪鉴别。因此本研究基于化学计量学的指纹图谱法,对金线莲及其混伪品进行鉴别,为金线莲鉴别和质量控制提供新的手段。
1 材料与方法
1.1 材料与仪器 金线莲样品采自福建省多个金线莲种植基地,其他混伪品于市场上收集,经福建中医药大学药用植物实验室范世明高级实验师及生药教研室黄泽豪教授鉴定,见表1和图1;样本存放于福建中医药大学药学院药用植物标本室。对照品水仙苷(纯度:93.10%,批号:111997-201501)、芦丁(纯度:91.90%,批号:100080-201409)、山柰酚-3-O-芸香糖苷(纯度:90.80%,批号:112007-201602)、异槲皮苷(纯度:92.9%,批号:111809-201403)、槲皮素(纯度:97.30%,批号:100081-200406)、山柰酚(纯度:95.5%,批号:110861-201611)、异鼠李素(纯度:99.90%,批号:110860-201410)均购自中国食品药品检定研究院;紫云英苷(批号:MUST-13022)、槲皮素3,7-二葡萄糖苷(批号:MUST-19023)、异鼠李素-3-O-芸香糖苷-7-O葡萄糖苷(批号:MUST-19072)和异鼠李素-3-O-葡萄糖苷(批号:MUST-19778)均购自成都曼思特生物科技有限公司,纯度均≥98%。
1260型高效液相色谱仪(美国Agilent公司,配置光电二极管阵列检测器);Welch Ultimate XB-C18色谱柱[4.6 mm×250 mm,5 μm,月旭科技(上海)股份有限公司];CPA225D型十万分之一分析天平(德国Sartorius公司);KQ-500DE台式超声波清洗器(昆山市超声仪器有限公司);DFY-500型500克摇摆式高速中药粉碎机(温岭市林大机械有限公司);甲醇、乙醇和乙腈为色谱纯(德国Merck公司);Milli-Q超纯水(美国Millipore公司);其余试剂均为分析纯。

表1 样品信息表

A.金线兰;B.长片金线兰;C.滇越金线兰;D.丽蕾金线兰;E.大花斑叶兰;F.血叶兰;G.台湾银线兰;H.虎耳草图1 金线莲及其混伪品图
1.2 试验方法
1.2.1 对照品溶液制备 精密称取槲皮素3,7-二葡萄糖苷2.46 mg、异鼠李素-3-O-芸香糖苷-7-O葡萄糖苷2.79 mg、芦丁4.94 mg、异槲皮苷6.38 mg、山柰酚-3-O-芸香糖苷1.94 mg、水仙苷4.69 mg、紫云英苷4.48 mg、异鼠李素-3-O-葡萄糖苷4.32 mg、槲皮素5.48 mg、山柰酚5.15 mg和异鼠李素2.09 mg分别到10 mL量瓶中,加入40%甲醇进行溶解并定容,精密吸取上述各对照品母液适量至20 mL量瓶中,加40%甲醇稀释至刻度,摇匀,即得混合对照品溶液,浓度分别为24.6、27.9、24.7、12.76、19.4、93.8、89.6、43.2、10.96、10.3、10.9 μg·mL-1,供指纹峰定性比对使用。
1.2.2 供试品溶液制备 取金线莲及其混伪品干燥全草粉碎,过60目筛,精密称定0.25 g,置具塞三角瓶中,精密加入40%甲醇25 mL,称定,在40 ℃、250 W功率下超声处理15 min,放冷至室温再称量,40%甲醇补足失重,摇匀,0.22 μm滤膜过滤,取续滤液,即得。
1.2.3 色谱条件 采用Welch Ultimate XB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相乙腈(A)-(0.1%甲酸)水(B),梯度洗脱0~22 min,12%A→18%A;22~34 min,18%A→24%A;34~44 min,24%A→30%A;44~52 min,30%A→40%A;52~54 min,40%A→40%A;54~58 min,40%A→12%A;58~60 min,12%A→12%A,流速1.0 mL·min-1,柱温30 ℃,检测波长360 nm,进样量10 μL。
1.3 数据处理 采用中药色谱指纹图谱相似度评价系统(2012版)对样品色谱数据进行相似度评价,并计算各样品的相对峰面积,采用SPSS 20.0统计软件对试验样品色谱数据进行聚类分析和主成分分析,然后使用SIMCA-P14.1软件对金线莲及其混伪品进行OPLS-DA分析。
2 结果与分析
2.1 方法学考察
2.1.1 精密度试验 取同一批(S15)供试品,按“1.2.2”项下方法制备,按“1.2.3”项下色谱条件连续进样6次,以7号峰(水仙苷)为参照峰,测得16个共有峰相对保留时间RSD在0.04%~0.16%,相对峰面积RSD在1.06%~4.49%,表明仪器精密度良好。
2.1.2 重复性试验 取同一批(S15)供试品,按“1.2.2”项下方法制备6份供试品溶液,按“1.2.3”项下色谱条件测定,以7号峰(水仙苷)为参照峰,测得16个共有峰相对保留时间RSD在0.17%~0.52%,相对峰面积RSD在0.82%~4.64%,表明重复性良好。
2.1.3 稳定性试验 取同一批(S15)供试品,按“1.2.2”项下方法制备,按“1.2.3”项下色谱条件于0、3、6、12、18、24 h测定,以7号峰(水仙苷)为参照峰,测得16个共有峰相对保留时间RSD在0.17%~1.02%,相对峰面积RSD在0.76%~4.99%,表明供试品溶液在24 h内稳定。
2.2 指纹图谱的建立
2.2.1 金线莲指纹图谱的建立及共有峰的鉴定 按“1.2.2”项下方法制备17批供试品溶液,按“1.2.3”项下色谱条件测定,得到17批金线莲样品HPLC指纹图谱,见图2。将其全部导入《中药色谱特征图谱相似度评价系统软件》(2012版),设定S15为参照图谱,采用中位数法,时间窗为0.3,多点矫正后生成共有模式图,共确定16个共有色谱峰。通过与对照品图谱对照,指认其中11个色谱峰,即峰2为槲皮素3,7-二葡萄糖苷、峰3为异鼠李素-3-O-芸香糖-7-O-葡萄糖苷、峰4为芦丁、峰5为异槲皮苷、峰6为山柰酚-3-O-芸香糖苷、峰7为水仙苷、峰8为紫云英苷、峰9为异鼠李素-3-O-葡萄糖苷,峰11为槲皮素、峰13为山柰酚、峰14为异鼠李素,以分离度较好、峰面积较大且保留时间适中的7号峰(水仙苷)为参照峰,分别计算17批金线莲的共有指纹峰的相对保留时间和相对峰面积,结果见表2~3。
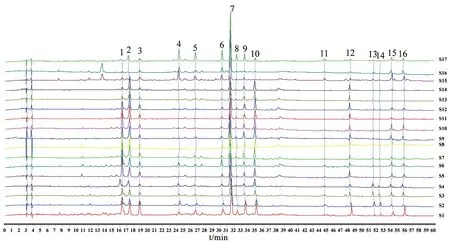
2.槲皮素3,7-二葡萄糖苷;3.异鼠李素-3-O-芸香糖苷-7-O葡萄糖苷;4.芦丁;5.异槲皮苷;6.山柰酚-3-O-芸香糖苷;7.水仙苷;8.紫云英苷;9.异鼠李素-3-O-葡萄糖苷;11.槲皮素;13.山柰酚;14.异鼠李素图2 金线莲的HPLC指纹图谱及其16个共有峰
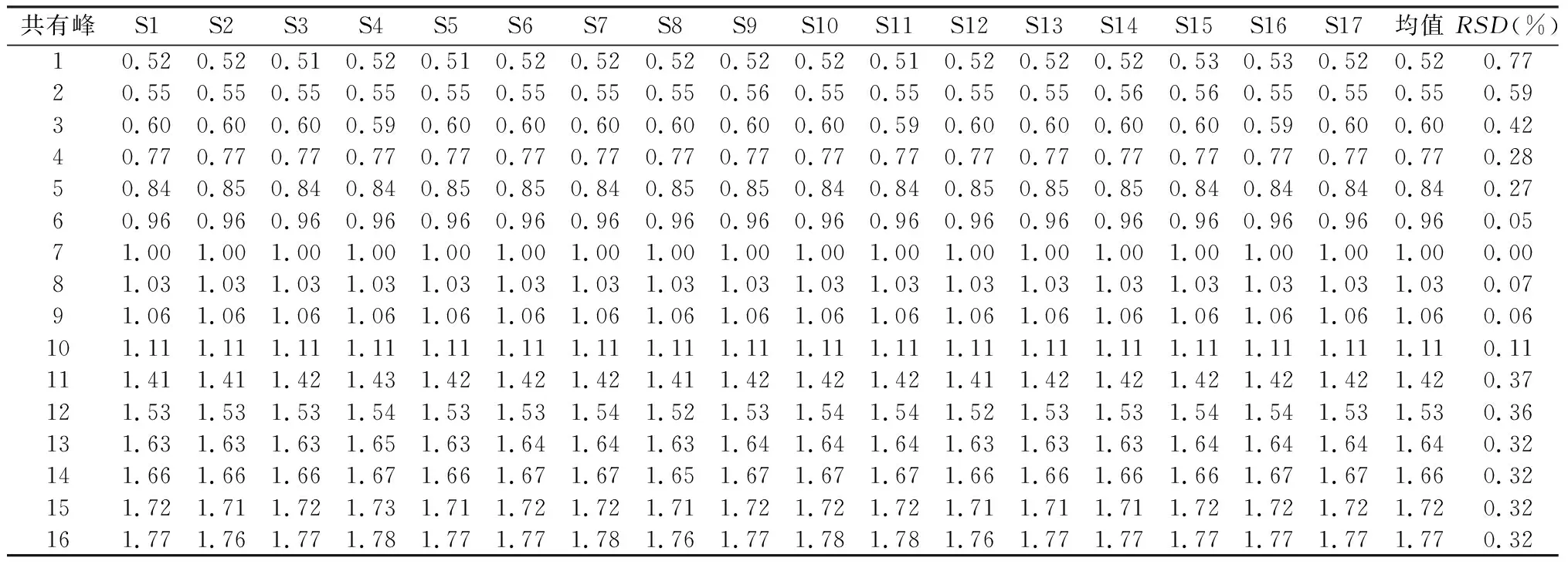
表2 17批金线莲共有峰的相对保留时间
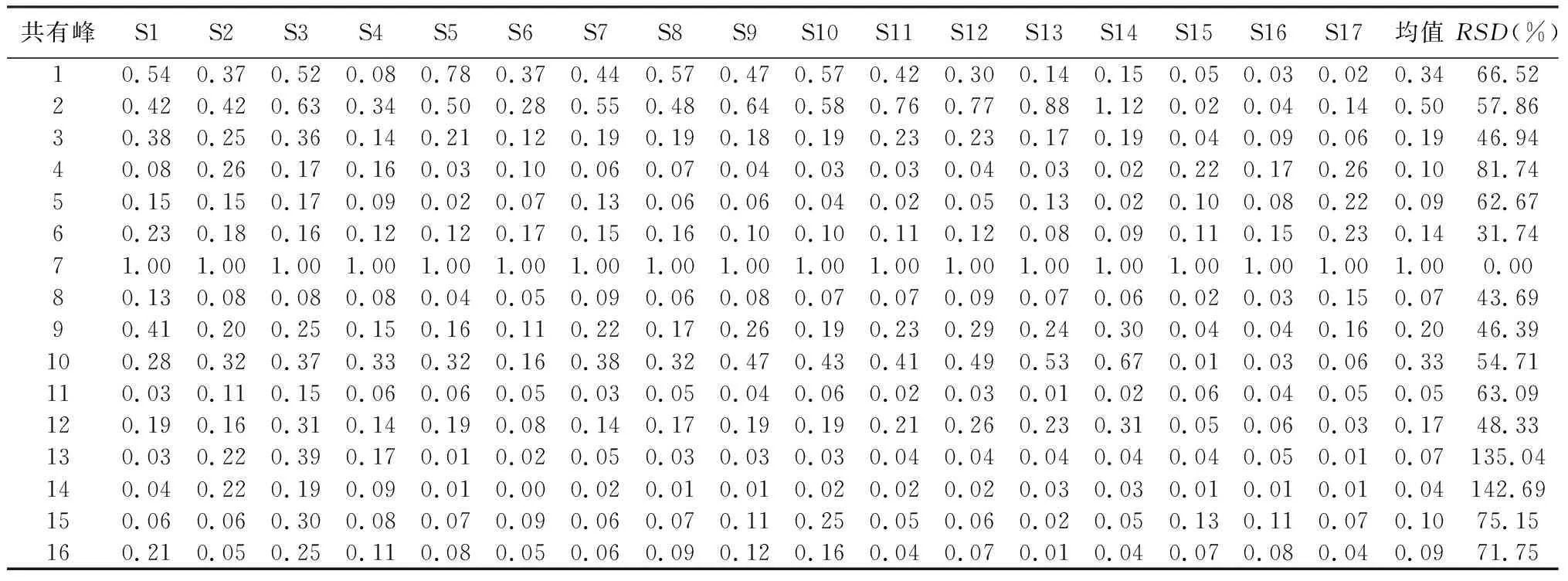
表3 17批金线莲共有峰的相对峰面积
2.2.2 金线莲指纹图谱相似度评价 以17批样品指纹图谱共有模式为对照,计算各批次样品相似度,结果见表4。S14~S17和S9的相似度为在0.851~0.899之间,其余批号相似度均大于0.9。
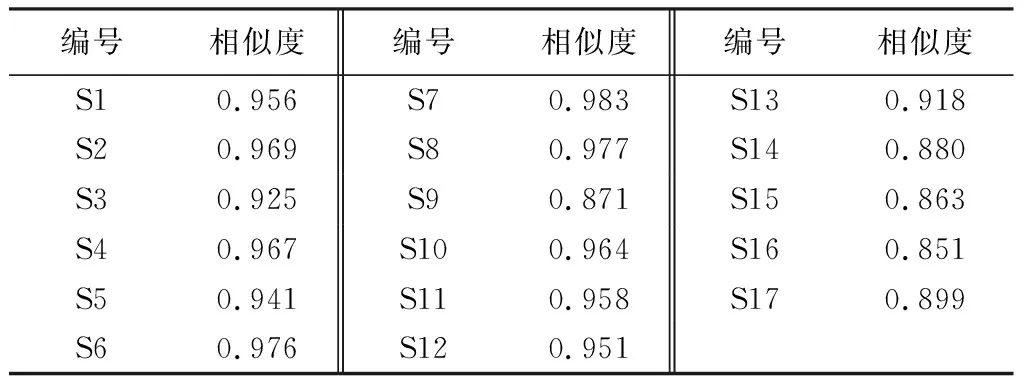
表4 17批金线莲与对照指纹图谱的相似度
2.2.3 指纹图谱识别金线莲混伪品 按“1.2.2”项下方法制备金线莲7种混伪品的供试品溶液,按“1.2.3”项下色谱条件测定,得到相应样品的HPLC图谱,并和17批次金线莲得到的对照指纹图谱一起全部导入《中药色谱特征图谱相似度评价系统软件》(2012版),设定金线莲对照指纹图谱为参照图谱,采用中位数法,时间窗为0.3,进行全峰匹配后计算相似度,结果见表5和图3~4。
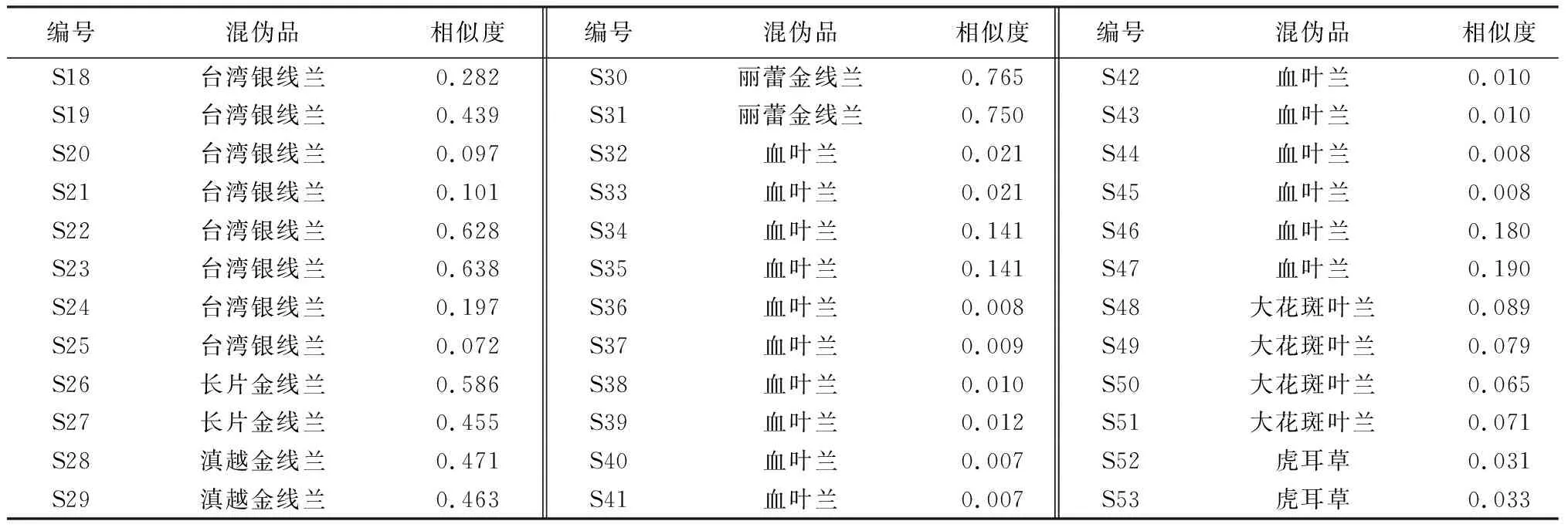
表5 金线莲混伪品的相似度
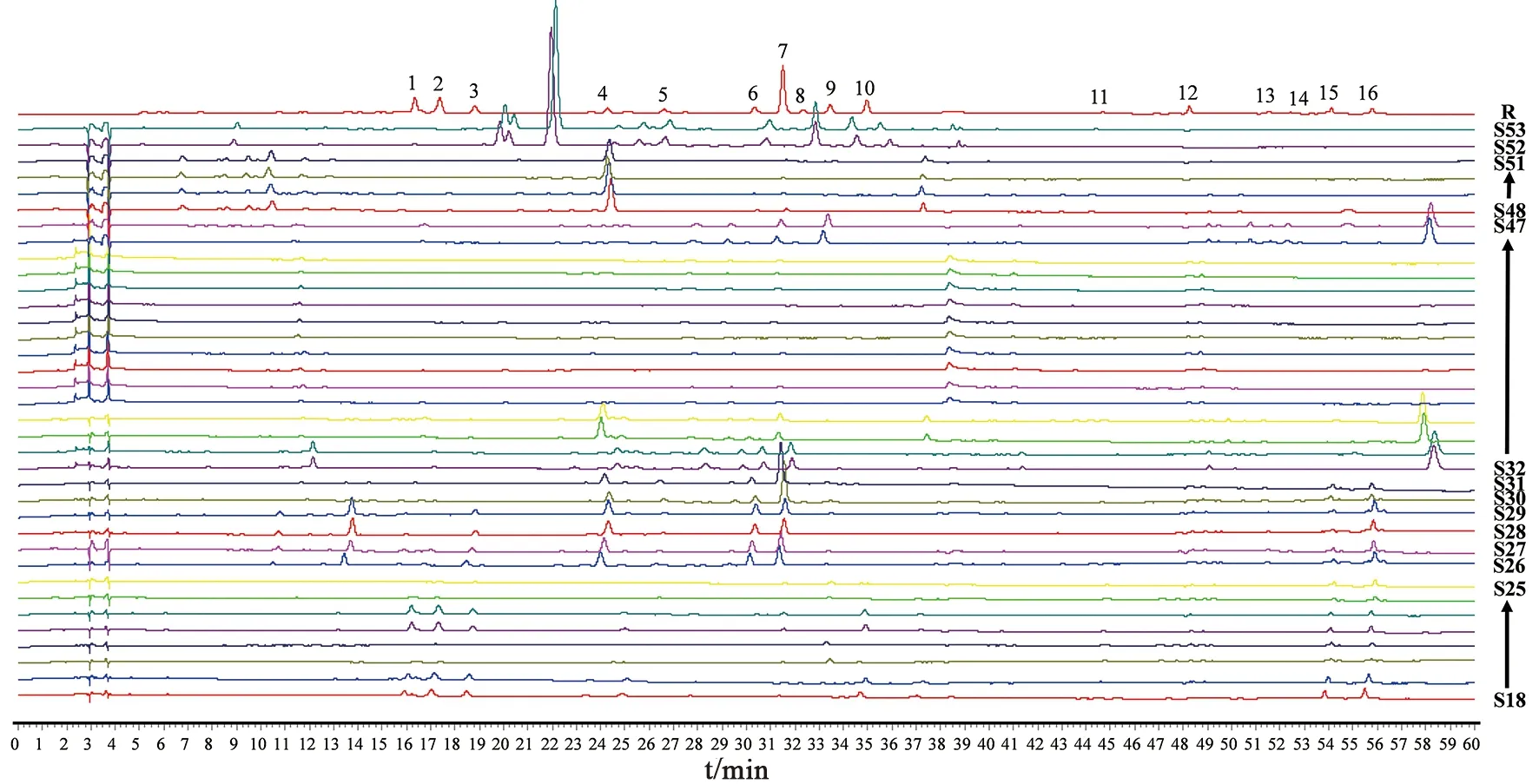
S18~S25.台湾银线兰;S26~S27.长片金线兰;S28~S29.滇越金线兰;S30~S31.丽蕾金线兰;S32~S47.血叶兰;S48~S51.大花斑叶兰;S52~S53.虎耳草图3 金线莲对照指纹图谱与混伪品HPLC图谱
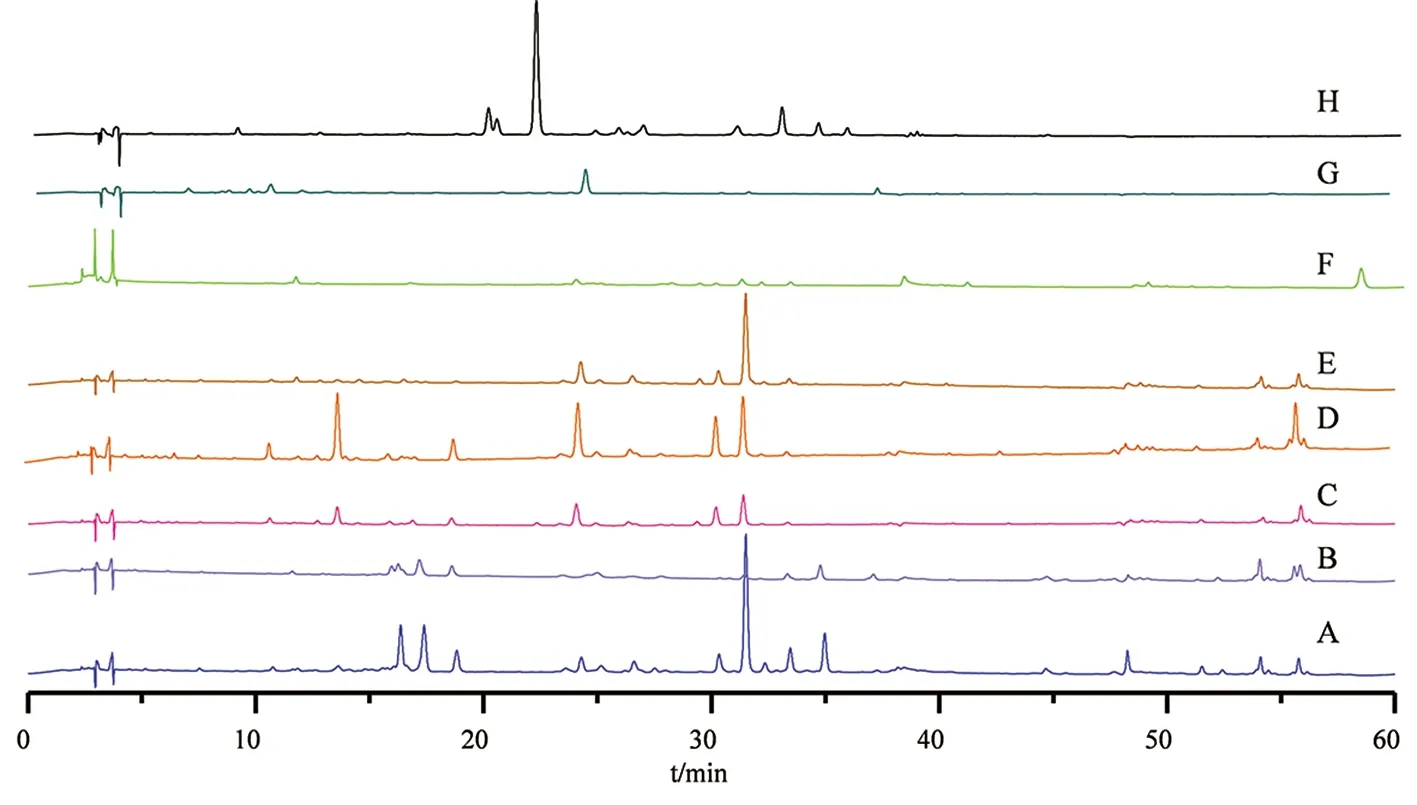
A.金线兰;B.台湾银线兰;C.长片金线兰;D.滇越金线兰;E.丽蕾金线兰;F.血叶兰;G.大花斑叶兰;H.虎耳草图4 金线莲及其伪品对照指纹图谱
2.3 聚类分析 以16个共有峰峰面积为变量,将金线莲及其混伪品的峰面积导入SPSS 20.0软件,选择平方欧式距离为测度进行聚类分析,结果见图5。当分类距离为16时,可分为2类,金线莲聚为一类(S1~S17),混伪品聚为一类(S18~S53)。金线莲17批次中S1和S5~S14聚为一类(距离12),然后与批次S15~S17聚为一类(距离15),最后与批次S2~S4聚为一类(距离16);混伪品中虎耳草(S52~S53)的距离最远,与血叶兰(S32~S47)、台湾银线兰批次(S20、S21、S24、S25)、台湾银线兰批次(S18、S19、S22、S23)聚为一类(距离5),然后和丽蕾金线兰(S30~S31)聚为一类(距离7),进一步与大花斑叶兰(S48~S51)聚为一类(距离8);长片金线兰(S26~S27)和滇越金线兰(S28~S29)聚为一类(距离10)。

图5 金线莲及其混伪品聚类分析树状图
2.4 主成分分析 主成分分析是在尽可能保持原有数据信息的前提下,通过降维处理达到简化指标的计量学方法。将所有样品的16个共有峰峰面积导入SPSS 20.0软件,进行主成分分析,结果见表6~7和图6。由表6可知,提取特征值大于1的3个成分,其方差的累积贡献率为79.82%,表明这3个成分能够代表16个指标在这批样品中大部分的信息。由图6可知,样品被明显分为两类,一类为金线莲,另一类为金线莲的混伪品。载荷的绝对值越大,对主成分的贡献越大,由表7可知,峰7(水仙苷)、峰8(为紫云英苷)、峰9(异鼠李素-3-O-葡萄糖苷)和峰12在主成分1上有较高的载荷(载荷绝对值大于0.9),该结果与相似度评价、聚类分析结果基本一致。
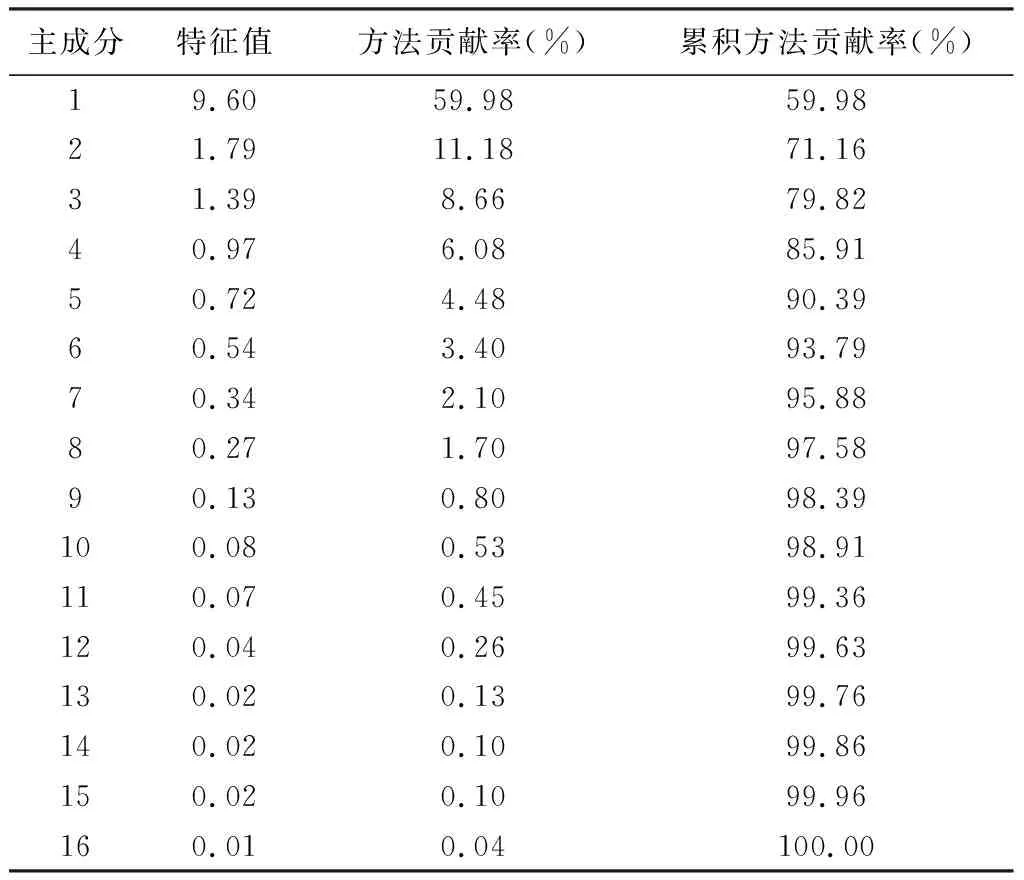
表6 主成分分析特征值与贡献率
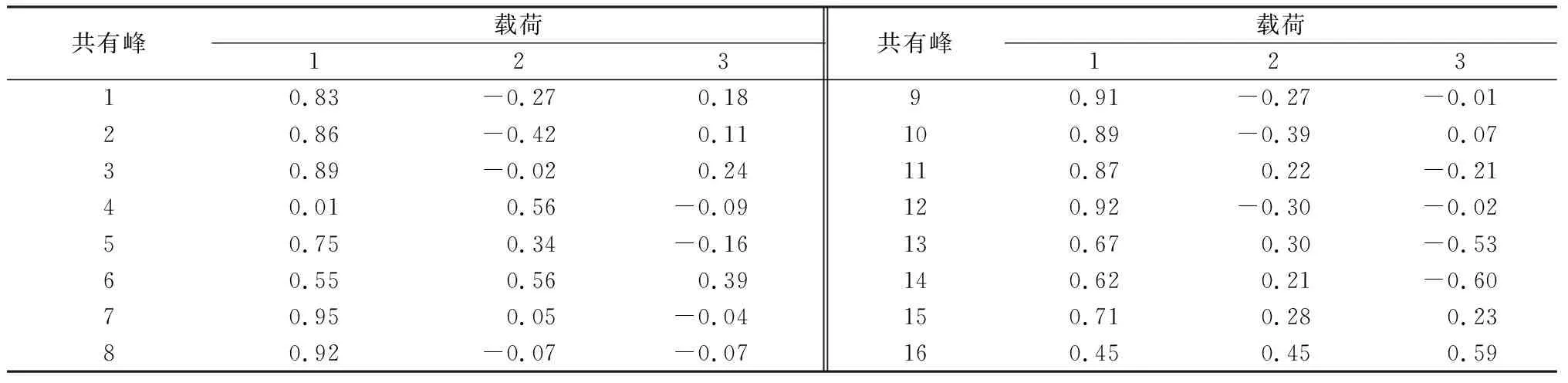
表7 旋转后公共因子载荷矩阵
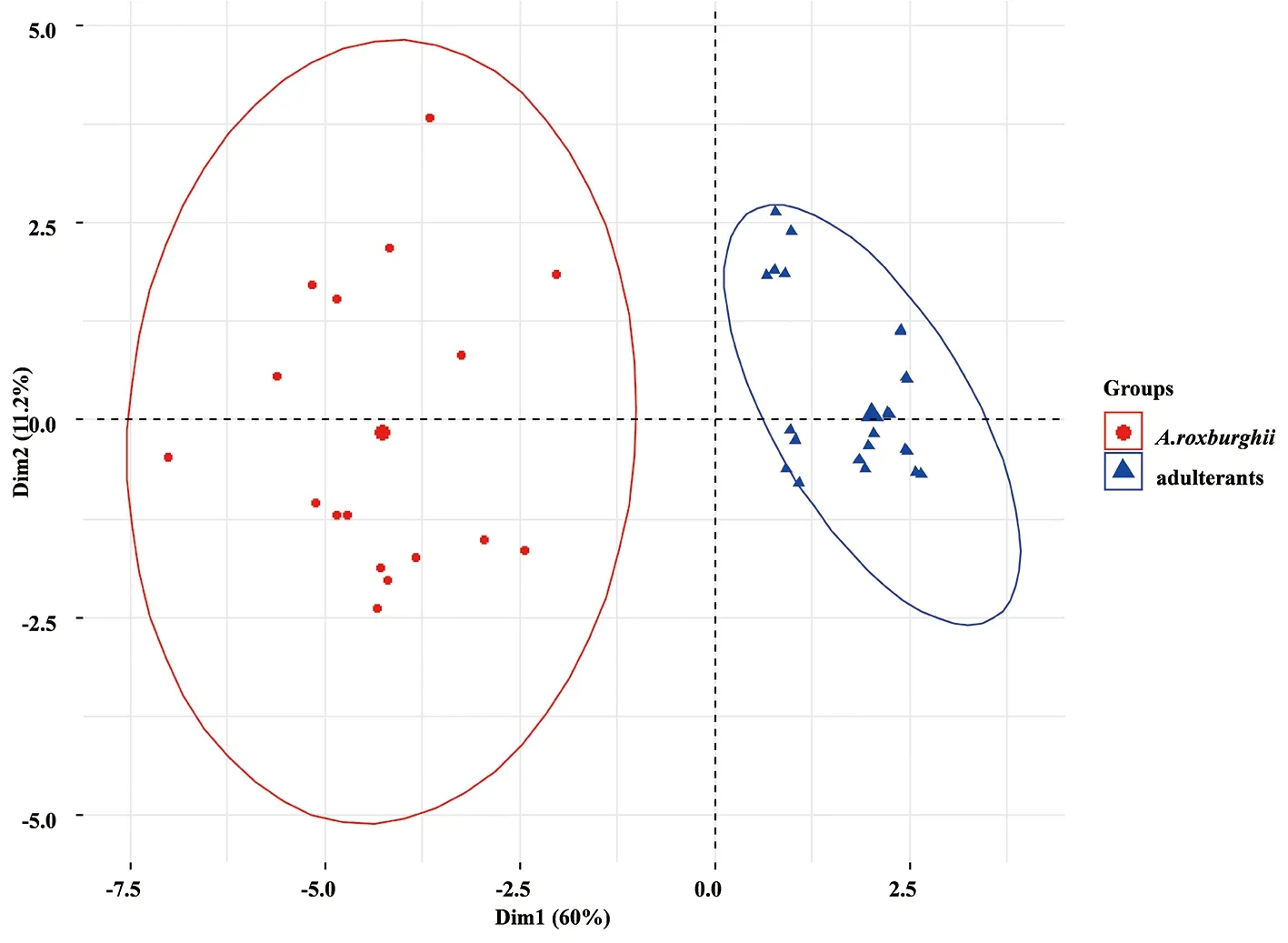
图6 主成分得分图
2.5 OPLS-DA分析 正交偏最小二乘判别分析(orthogonal PLS-DA,OPLS-DA)是一种有监督的判别分析统计方法。将金线莲及其混伪品的16个共有峰峰面积导入SIMCA-P14.1软件,进行OPLS-DA,获得相应模型。

图7 OPLS-DA得分散点图(A)和VIP图(B)
2.6 差异标志物验证 采用HPLC法对所有批次的金线莲及其混伪品进行差异标志物峰7(水仙苷)的含量测定[33],结果见表8、图9。

图8 OPLS-DA模型置换验证图

表8 金线莲与混伪品的水仙苷含量
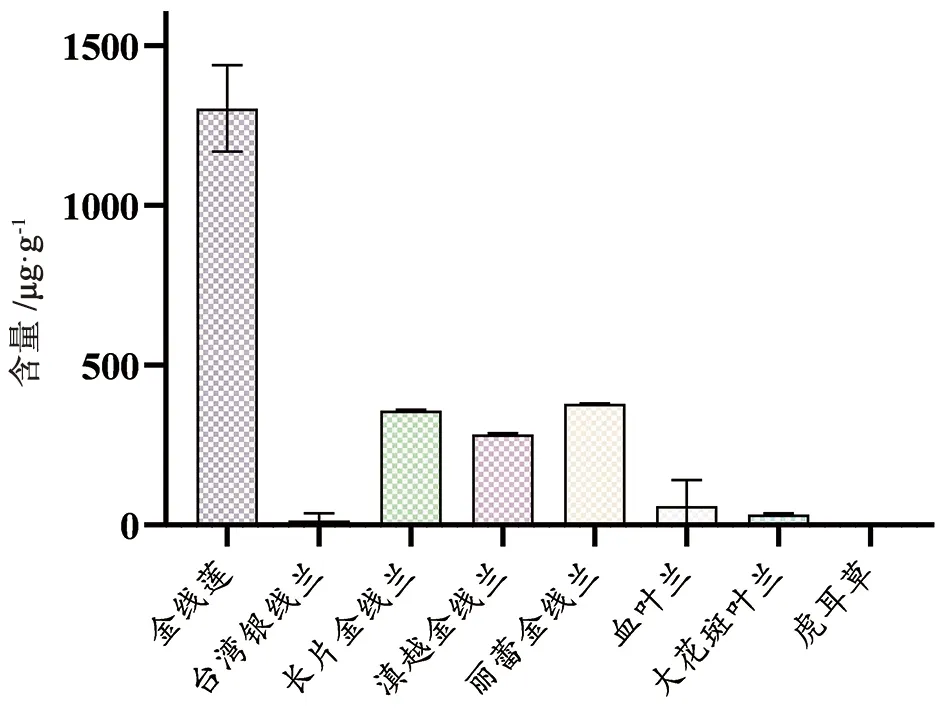
图9 金线莲及其混伪品的差异标志物含量
3 讨论
3.1 指纹图谱条件优化 在金线莲混伪品中,大花斑叶兰[34]和金线莲同属植物齿唇兰[27]及兴仁金线莲[28]的指纹图谱研究已有相关报道,实验前期分别采用相同的液相条件对金线莲和混伪品供试品进行分析,结果部分色谱峰未能较好分离、后期基线漂移严重。因此对其色谱条件进行优化,考察Welch Ultimate XB-C18(4.6 mm×250 mm,5 μm);Welch Ultimate AQ-C18(4.6 mm×100 mm,3 μm);Welch Ultimate Polar-RP(4.6 mm×250 mm,5 μm);Welch Ultimate XB-C18(4.6 mm×150 mm,2.7 μm);Waters XSelect HSS T3(4.6 mm×250 mm,5 μm);Agilent Zorbax SB-C18(4.6 mm×150 mm,5 μm)等6根不同的色谱柱,在相同的液相条件下Welch Ultimate XB-C18色谱柱(4.6 mm×250 mm,5 μm)能够将各目标峰均分离开,且分离度较好,最终优选Welch Ultimate XB-C18(4.6 mm×250 mm,5 μm);流动相通过比较甲醇-水,甲醇-0.1%甲酸水,乙腈-水、乙腈-0.1%甲酸水,结果表明乙腈-0.1%甲酸水最佳;检测波长,经DAD全波长图谱对比,同时考虑基线,发现360 nm下峰容量大,图谱平稳,因为选择检测波长为360 nm。
3.2 金线莲及其混伪品指纹图谱分析 通过比较金线莲混伪品与金线莲对照指纹图谱的相似度发现,所有混伪品的相似度均在0.8以下,其中与金线莲同属植物的台湾银线兰、长片金线兰、滇越金线兰和丽蕾金线兰的相似度在0.072~0.765,其他的混伪品血叶兰、大花斑叶兰和虎耳草的相似度均在0.2以下。通过比较各混伪品与金线莲的16个共有峰发现,台湾银线兰与金线莲的差异主要在台湾银线兰无峰4(芦丁)、峰5(异槲皮苷)、峰6(山柰酚-3-O-芸香糖苷)、峰8(紫云英苷)、峰13(山柰酚)和峰14(异鼠李素);丽蕾金线兰和金线莲的差异主要在其无峰1、峰2(槲皮素3,7-二葡萄糖苷)、峰3(异鼠李素-3-O-芸香糖苷-7-O葡萄糖苷)、峰8(紫云英苷)、峰10、峰11(槲皮素)、峰12、峰13(山柰酚)和峰14(异鼠李素);滇越金线兰和金线莲的差异主要在其无峰1、峰2(槲皮素3,7-二葡萄糖苷)、峰5(异槲皮苷)、峰8(紫云英苷)、峰9(异鼠李素-3-O-葡萄糖苷)、峰10、峰11(槲皮素)、峰12、峰13(山柰酚)和峰14(异鼠李素);长片金线兰和金线莲的差异主要在其无峰5(异槲皮苷)、峰8(紫云英苷)、峰9(异鼠李素-3-O-葡萄糖苷)、峰10、峰11(槲皮素)、峰12、峰13(山柰酚)和峰14(异鼠李素);血叶兰与金线莲相比,血叶兰中仅含有峰6(山柰酚-3-O-芸香糖苷)和峰7(水仙苷),且含量极低,其他14个峰均不含有;大花斑叶兰与金线莲相比,16个共有峰中仅含有峰4(芦丁);虎耳草与金线莲相比,16个共有峰均不含有。
从聚类分析结果可以看出虎耳草科的虎耳草距离最远,与混伪品兰科血叶兰属血叶兰聚成一类,并且这一类中也包括了兰科开唇兰属的台湾银线兰,然后与开唇兰属的丽蕾金线兰(S30~S31)聚为一类(距离7),再与兰科斑叶兰属的大花斑叶兰(S48~S51)聚为一类(距离8),最后与开唇兰属的长片金线兰(S26~S27)和滇越金线兰(S28~S29)聚为一类(距离16),从混伪品的聚类来看,与金线莲比较接近的混伪品为长片金线兰(S26~S27)和滇越金线兰,该结果与相似度的评价结果也互相吻合,同时与以往的指纹图谱研究相比[23,28]血叶兰、台湾银线兰、斑叶兰确实从本次的结果来看确有明显的区分,不同于金线莲。因此指纹图谱的聚类分析结果提示不同基原的混伪品成分与金线莲不一致,食用或药用均建议应予以区分使用
3.3 金线莲及其混伪品的PCA和OPLS-DA分析 经化学计量学聚类分析,分类距离为16时即分为2类,金线莲聚为一类,混伪品聚为一类,与相似度结果基本一致;经化学计量学PCA的分析前3个主成分方差的累积贡献率为79.82%,3个主成分分别为水仙苷、紫云英苷、异鼠李素-3-O-葡萄糖苷;经化学计量学正交偏最小二乘判别分析(OPLS-DA),经VIP统计,筛选出1个差异标志峰,为水仙苷,并对其含量进行测定验证,金线莲中水仙苷含量显著高于其混伪品。17批次金线莲的水仙苷含量在1 098~1 528 μg·g-1,8批次台湾银线莲则仅3批次含有水仙苷,其水仙苷含量在15~50 μg·g-1,长片金线兰的水仙苷含量在356.67~360.41 μg·g-1;滇越金线兰的水仙苷含量在281.29~286.56 μg·g-1;丽蕾金线兰的水仙苷含量在378.75~379.96 μg·g-1;16批次血叶兰中10批未检测到水仙苷,其余6批含量在132~208 μg·g-1;大花斑叶兰水仙苷含量在29.23~36.04 μg·g-1,虎耳草中未检测到水仙苷。
综上,本研究采用HPLC指纹图谱结合相似度评价以及化学计量学的方法对金线莲及其混伪品进行鉴别,并筛选出差异标志物水仙苷,该方法能够较好地区分金线莲的7种混伪品:台湾银线莲、长片金线兰、滇越金线兰、丽蕾金线兰、血叶兰、大花斑叶兰和虎耳草,为金线莲的质量控制提供参考。
