ZBTB20对脂多糖诱导的大鼠心肌细胞的保护作用
2021-04-20曹剑英史慧婷刘雪蒙鄞诚光孔令尧张文远张彦周
曹剑英,史慧婷,刘雪蒙,鄞诚光,孔令尧,张文远,张彦周
郑州大学第一附属医院心血管内科 郑州 450052
脓毒血症是临床上常见的一种全身炎症反应综合征,心脏是脓毒血症损伤的重要器官,心力衰竭是导致脓毒血症患者死亡的重要原因[1]。脂多糖(LPS)被认为是炎症反应和细胞凋亡的始动因子[2]。LPS可刺激心肌炎症因子的产生,包括肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)和IL-6,在脓毒血症中导致心肌炎症损伤[3]。此外,LPS还可通过激活或上调多种应激信号级联反应[如促分裂原活化蛋白激酶和核转录因子-κB(NF-κB)]诱导心肌细胞凋亡,该机制在脓毒血症导致的心肌损伤中起着关键作用[4-6]。然而,目前缺乏特异性治疗脓毒血症心肌损伤的方法。
含锌指和BTB结构域的ZBTB20是POK转录抑制家族的新成员,其含有完整的N端BTB结构域和C端锌指结构域[6]。有研究[7-9]报道,ZBTB20参与多种生物过程,如细胞增殖、转录调节、离子通道装配和染色质重塑等。据报道[7],ZBTB20通过调节上皮生长因子受体的表达促进小鼠再生肝脏中肝细胞的增殖。ZBTB20可以抑制NF-κB抑制蛋白(IκBα)基因转录,控制IκBα蛋白表达,促进Toll样受体触发的先天免疫应答[8]。还有研究[10]发现ZBTB20通过抑制叉头框蛋白1(FoxO1)的转录促进了肝细胞的增殖和细胞周期进程,但其对心肌细胞的作用尚不明确。本研究观察过表达ZBTB20对LPS诱导的原代大鼠心肌细胞活力、凋亡的影响,探讨可能的分子机制。
1 材料与方法
1.1原代大鼠心肌细胞的分离和培养取出生后1~3 d的SD大鼠(SPF级,购自北京华阜康生物公司),颈椎脱臼法处死后消毒,剪开胸腔取出心脏,剪去心房和右心室,将左心室置于D-Hanks液中清洗,用剪刀剪成1~2 mm3的碎块,置于1.25 g/L胰蛋白酶溶液(美国Thermo Fisher Scientific公司)中消化15 min×5次,收集后4次消化液于离心管内,添加含体积分数10%胎牛血清的DMEM-F12培养基(美国Thermo Fisher Scientific公司)终止消化。离心后弃上清液,重悬细胞后,均匀接种于75 mL的培养瓶中90 min(成纤维细胞贴壁,心肌细胞仍悬浮),收集上清液中的细胞,接种于直径10 cm培养皿中,加入5-溴脱氧尿嘧啶核苷抑制成纤维细胞增殖,培养48 h后得到单层贴壁细胞。经α-actin免疫荧光鉴定为心肌细胞后用于后续实验。
1.2过表达ZBTB20腺病毒的构建过表达ZBTB20腺病毒由山东维真公司构建,过程如下:将ZBTB20序列克隆到pShuttle-CMV(美国Qbiogene公司)中,并在细菌BJ5183中与pAdeasy-1载体系统(美国Qbiogene公司)重组。重组质粒转染HEK293细胞,包装成腺病毒。使用氯化铯梯度离心纯化。
1.3心肌细胞分组和处理将1.1中分离的心肌细胞分为对照组(PBS处理12 h)、LPS组(以1 mg/L LPS处理12 h)和ZBTB20组[细胞感染过表达ZBTB20腺病毒(MOI=80)8 h后再用1 mg/L LPS培养12 h]。
1.4对照组和ZBTB20组细胞中ZBTB20蛋白表达的检测采用Western blot法。收集对照组和ZBTB20组细胞,分别加入RIPA裂解液提取细胞总蛋白。通过BCA法检测蛋白浓度。取20 μg 蛋白行聚丙烯酰胺凝胶电泳,电泳后用转膜仪将蛋白转移至PVDF膜上,将膜置于50 g/L脱脂奶粉封闭液中封闭2 h,洗膜,加入ZBTB20抗体(按1∶1 000 稀释,美国Abcam公司)4 ℃ 过夜孵育。TBST洗膜后加入二抗(按1∶3 000稀释,美国Abcam公司)室温孵育1 h。DAB显色。以目的蛋白条带与GAPDH条带灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.53组细胞活性的检测采用MTT法。细胞接种于96孔板。按1.3分组处理后,每孔加入20 μL MTT溶液(上海碧云天生物技术有限公司)。37 ℃孵育4 h,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量光密度(OD)值。以未处理细胞为空白对照。细胞活性=OD处理/OD空白对照×100%。实验重复3次。
1.63组细胞炎症因子水平的检测采用ELISA法。细胞接种于6孔板,培养24 h后分组处理。处理完毕后分别加入100 μL RIPA裂解液置于冰上裂解15 min,收集细胞,按照ELISA试剂盒(美国Biolegend公司)说明书步骤检测3组细胞裂解液中TNF-α、IL-1β和IL-6的含量。实验重复3次。
1.73组细胞中活性氧的检测采用2’,7’- 二氯荧光黄双乙酸盐(DCFH-DA)荧光探针进行活性氧检测。细胞接种于24孔板,培养24 h后分组处理。处理完毕后采用PBS洗涤5 min,每孔加入100 μL含10 μL DCFH-DA探针的培养液,使细胞与 DCFH-DA 探针充分结合,37 ℃避光孵育30 min,每隔3~5 min混匀一次;随后PBS洗涤3次以去除残留的DCFH-DA。显微镜下拍照,采用酶标仪(激发波长540 nm,散发波长590 nm)定量分析荧光强度。实验重复3次。
1.83组细胞凋亡检测采用TUNEL染色试剂盒(美国Millipore公司)进行凋亡检测。细胞接种于24孔板,分组处理后收集细胞,用PBS漂洗3次后用40 g/L多聚甲醛固定,采用TritonX-100通透,再用PBS清洗3 min。加入平衡液室温下孵育10 s 后滴加TdT工作液,37 ℃孵育1 h。加入工作液振荡15 s后孵育10 min,PBS洗3次,吸干液体,滴加抗地高辛荧光工作液,避光孵育约30 min后,PBS 再洗3次,DAPI封片,荧光显微镜下观察并拍照。正常的细胞核可被染为蓝色,而凋亡的细胞核则被染为绿色。每组选择8 个视野(×200),记录凋亡细胞数,计算细胞凋亡率。实验重复3次。
1.93组细胞NF-κB核转位水平检测采用免疫荧光染色法。细胞接种于24孔板,分组处理后以40 g/L多聚甲醛固定,随后PBS洗涤3次,以TritonX-100通透5 min,PBS洗涤3次后用80 g/L羊血清封闭1 h,加入NF-κB抗体(按1∶500稀释,美国Cell Signaling Technology 公司)孵育过夜,第2天37 ℃复温后,PBS洗涤5次,随后加羊抗兔568荧光二抗孵育1 h,PBS洗涤3次。采用DAPI进行核染色和封片,荧光显微镜下拍照。每组细胞计数20个视野(×200),每个视野下计数核转位阳性细胞(红、蓝色重合细胞)数,除以细胞核总数,取平均值,即为NF-κB核转位率。实验重复3次。
1.10统计学处理采用SPSS 23.0进行分析,应用两独立样本t检验比较对照组和ZBTB20组ZBTB20蛋白表达水平的差异,应用单因素方差分析比较3组细胞活性、炎症因子水平、活性氧水平、细胞凋亡率和NF-κB核转位率的差异,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1对照组和ZBTB20组ZBTB20蛋白表达的比较与对照组(0.12±0.06)相比,ZBTB20组细胞ZBTB20蛋白表达水平(0.56±0.07)增高(t=14.951,P<0.001)(图1)。
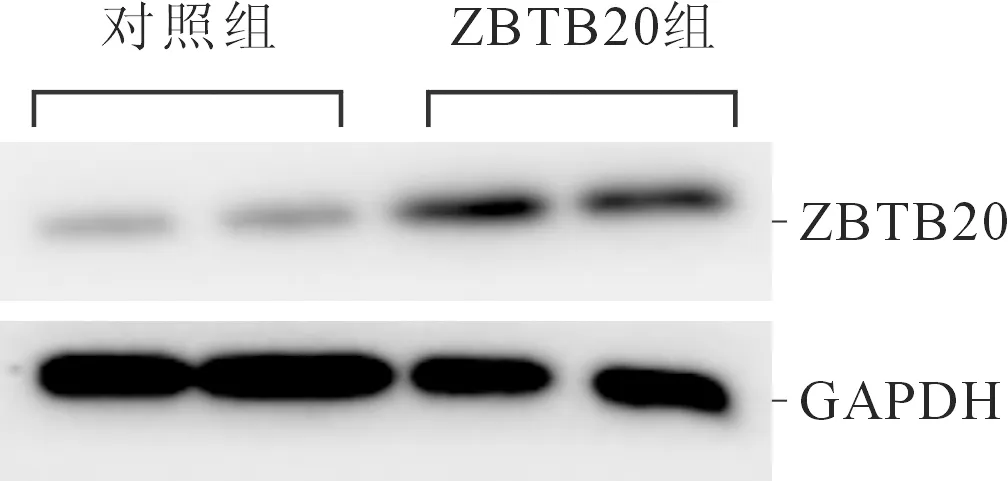
图1 对照组和ZBTB20组ZBTB20蛋白的表达
2.23组心肌细胞活性和炎症因子水平的比较见表1。与对照组比较,LPS组心肌细胞活性降低,炎症因子水平均升高;与LPS组相比,ZBTB20组以上指标均有改善(P<0.05)。
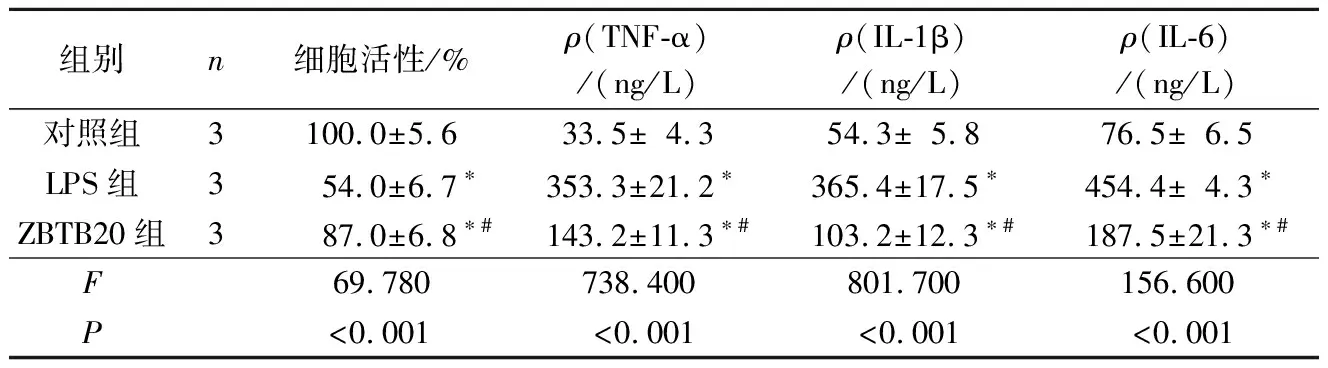
表1 3组心肌细胞活性和炎症因子水平的比较
2.33组心肌细胞活性氧水平、细胞凋亡率和NF-κB核转位率的比较见图2和表2。与对照组比较,LPS组心肌细胞活性氧水平、细胞凋亡率、NF-κB核转位率均升高;与LPS组比较,ZBTB20组以上指标均有改善(P<0.05)。

绿色:凋亡;蓝色:细胞核;红色:NF-κB(箭头表示阳性细胞)
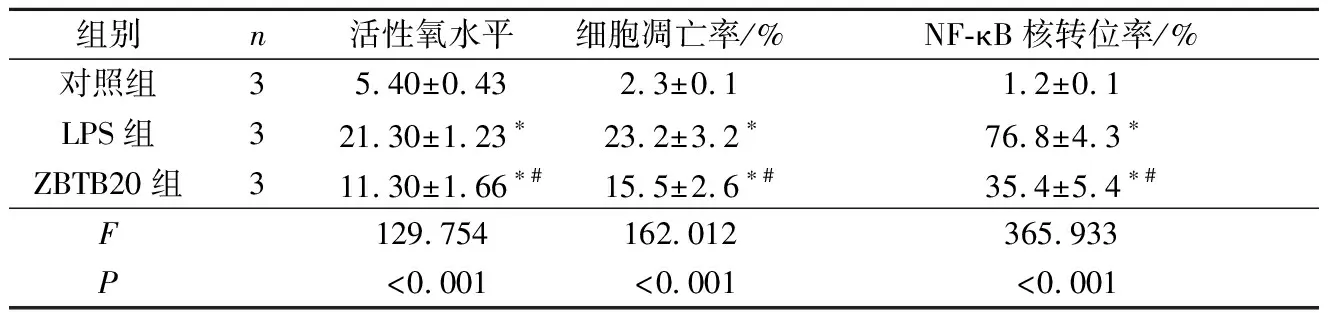
表2 3组心肌细胞活性氧水平、细胞凋亡率和NF-κB核转位率的比较
3 讨论
原代心肌细胞具有收缩特性和电传导特性,且在细胞活性、生理特性上都更接近活体细胞,故本实验选用原代心肌细胞。在制备大鼠原代心肌细胞中作者采用胰蛋白酶短时多次消化获得的细胞,然后应用差速贴壁分离法和化学试剂抑制法分离纯化,从而获得高质量、数量多、损伤小的心肌细胞,为后续实验奠定了良好的基础。
脓毒血症为宿主对感染反应失调引起的致命性器官功能障碍。LPS可诱导脓毒血症休克多器官功能障碍,其中心肌功能障碍是公认的主要表现之一[11]。该研究结果表明,LPS处理后心肌细胞活力部分丧失,但给予ZBTB20预处理可以改善心肌细胞活力,表明ZBTB20可以有效保护心肌细胞免受LPS诱导的细胞毒性作用。
实验[12]表明,LPS可诱导炎症因子如TNF-α、IL-6和IL-1β的释放,进一步引起心肌细胞凋亡和心力衰竭。该研究结果显示,LPS处理后心肌细胞TNF-α、IL-6和IL-1β水平升高,细胞凋亡增多,而ZBTB20可改善上述作用,发挥心肌细胞保护作用,提示ZBTB20预处理的心肌保护作用可能与抗炎特性有关。ZBTB20减弱LPS诱导的心肌细胞炎症反应和减少凋亡的可能机制尚不清楚。已有文献[13-14]证明,在LPS诱导的信号级联反应中,NF-κB基因的转录激活被认为是最关键步骤;NF-κB被激活后,IκBα磷酸化降解,导致NF-κB亚基从细胞质转移到细胞核。此外,还有研究[2]显示,急性炎症和脓毒性心脏功能不全大鼠心脏组织中NF-κB活性增加,并与大鼠死亡率密切相关。因此,作者检测了心肌细胞NF-κB的核转位情况,发现ZBTB20预处理可减弱LPS诱导的NF-κB核转位水平,提示ZBTB20可能通过抑制NF-κB来保护心肌细胞免受LPS刺激损伤。
综上所述,ZBTB20可能通过降低NF-κB的核转位水平改善LPS诱导的心肌细胞损伤。本实验为脓毒血症心肌损伤的治疗提供了新的理论指导方向。