“吉塞拉6号”大樱桃砧木组培快繁技术研究
2021-04-17高小霞童耀宏
高小霞,张 森,童耀宏
(陕西果业集团杨凌种苗科技有限公司,陕西 杨凌 712100)
生产上利用樱桃矮化砧木进行密集栽培可以实现早挂果、早丰产,达到经济效益最大化。目前吉塞拉系列砧木是推广大樱桃矮砧密植不可多得的优良砧木[1-2]。吉塞拉6号樱桃品种是通过杂交选育而得,母本是欧洲酸樱桃,父本是灰毛叶樱桃,1988年引入我国,经过多年的区域与生产试验观察,与大多数甜樱桃嫁接亲和,具有矮化性、早果性、早丰产、耐涝、抗病、土壤适应能力强等优点[3],但因是三倍体杂种不能种子繁殖,通常采取的根孽、压条、扦插等繁殖方式存在繁殖速度慢、生长不一致,不能及时获得大量优质砧木苗满足生产需要,限制了我国樱桃矮砧密植栽培的发展[4]。
利用组培技术可快速大量繁殖生长一致的优质吉塞拉砧木种苗,利于樱桃种苗规模化生产,同时可为未来樱桃脱毒苗木繁育、种质资源保存提供理论依据。目前我国樱桃砧木组织培养研究已取得较好成果,殷丽青等研究发现,吉塞拉6号丛芽的继代培养基为改良MS+6-BA 0.5 mg·L-1+TDZ 0.01 mg·L-1+0.1 mg·L-1NAA+KT 0.5 mg·L-1,最佳生根培养基为1/2MS+NAA 0.2 mg·L-1+IBA 1 mg·L-1,移栽前瓶苗需要进行锻炼[5]。冯社章等研究发现,吉塞拉5号的增殖培养基是MS+6-BA 0.3 mg·L-1+NAA 0.1 mg·L-1,生根最优培养基为1/2MS+IBA 0.3 mg·L-1,移栽前瓶苗需在自然光环境下封闭锻炼并开瓶炼苗[6]。黄文江等研究吉塞拉系列叶片再生体系发现,适宜的叶片再生培养基吉塞拉6号为WPM+6-BA 5 mg·L-1+ IBA 0.5 mg·L-1,吉塞拉5号为WPM+6-BA 7 mg·L-1+IBA 0.3 mg·L-1,再生率最高分别为100%和71.9%[7]。刘庆忠等研究吉塞拉5、6、7号三种砧木组培快繁再生体系发现,三者继代培养基均为MS+ZT 0.1 mg·L-1+6-BA 0.5 mg·L-1,生根培养基均为1/2MS+IBA 0.3 mg·L-1[8]。杨俊霞等研究不同激素浓度组合对大樱桃矮化砧木瓶苗扩繁系数影响发现,吉塞拉5号、6号与7号所用的激素浓度存在差异,吉塞拉5号和6号在各自适宜的培养基上增殖系数可分别达到6.4和5.6[9]。李晓青等研究吉塞拉5号组织培养技术体系时发现,诱导培养基与继代培养基相同,是MS + 6-BA 0.5 g·L-1+NAA 0.2 g·L-1,适宜生根培养基是1/2MS+IBA 0.5 mg·L-1[10]。目前吉塞拉组培研究在取得进展的同时,生产中存在的玻璃化、茎尖坏死、生根率低等问题严重影响种苗生产规模。本研究以吉塞拉6号的当年生新梢为材料,开展组培快繁体系研究,以期为樱桃矮化砧木规模化生产提供理论与实践依据,为推广大樱桃矮砧密植模式奠定基础。
1 材料与方法
1.1 材料
本研究的试验材料为吉塞拉6号,取材时间是4月中旬至5月中旬,在连续3~5 d晴天后取材,选取生长健壮且无病虫害的半木质化枝条,去掉叶片但保留部分叶柄,将枝条剪成2~3 cm的长茎段待用。
1.2 方法
1.2.1 无菌体系的建立 将处理好的茎段用洗洁精清洗2遍后流水冲洗2 h,转移至无菌瓶中,75%酒精处理10~15 s,用无菌水清洗3遍,用质量分数为0.1%的氯化汞杀菌消毒8 min,无菌水清洗6遍,消毒和清洗过程中不断震荡,枝条与溶液充分接触以使消毒与清洗彻底。杀菌消毒完毕后,用无菌滤纸吸干外植体表面水分,剥下叶柄,切除与氯化汞接触的剪口,将长茎段切成1~2 cm带芽茎段,垂直接入培养基中。
1.2.2 培养条件和培养基 初代培养基、继代培养基采用的基本培养基是改良MS,主要改变的是增加四水硝酸钙980 mg·L-1和硫酸钾780 mg·L-1,硝酸钾减半为950 mg·L-1,将EDTA-Fe替换为EDDHA-Fe,含量为150 mg·L-1,其余不变。两种培养基中添加蔗糖30 mg·L-1,琼脂6 g·L-1。生根培养基采用1/2MS,其中是大量减半,其余不变,添加蔗糖20 g·L-1,琼脂6 g·L-1。各培养基的pH均为5.8,在121 ℃条件下高温高压灭菌20 min。在诱导与增殖培养阶段的光照强度为3 000~4 000 Lux,温度为(24±2)℃,光照强度为3 000~4 000 Lux,光周期为白天/黑暗=16 h/8h。在生根阶段除温度变为(22±2) ℃外,其他条件相同。
1.2.3 不同激素配比对外植体诱导分化的影响试验 本试验所用激素为IBA和6-BA,6-BA浓度设置3个处理,分别为0.4、0.6和0.8 mg·L-1;IBA浓度设置3个处理,分别为0.04、0.08和0.1 mg·L-1。本试验共有9个处理,每个重复3次,每个处理60个外植体(每个重复20个外植体)。试验时将处理好的外植体分别接种至初代培养基中,30 d后统计数据。
1.2.4 不同激素配比对吉塞拉6号瓶苗增殖生长的影响 在增殖阶段使用的激素是IBA和6-BA,6-BA浓度设置3个处理,分别为0.6、0.8和1.0 mg·L-1;IBA浓度处理也为3个处理,即0.06、0.1、0.2 mg·L-1,本试验共设9个处理,每个处理重复3次,每个处理60株(每个重复20株)。试验时切下外植体萌发的新芽,垂直接入继代培养基中培养,培养30 d后转瓶并统计增殖系数。
1.2.5 不同生长素配比对吉塞拉6号组培苗生根的影响 在生根培养基仅添加生长素,分别是NAA和IBA,NAA浓度设置4个处理,分别为0、0.6、0.8、1.0 mg·L-1;IBA浓度设置也是4个处理,即0、0.1、0.3、0.5 mg·L-1,本试验共设16个处理,每个重复3次,每个重复20株(每个处理60株)。试验时选取生长健壮一致的植株,切成2 cm的单芽植株,去掉基部叶片,接入各培养基中培养,培养15 d后计数生根情况并计算生根率。
1.2.6 生根瓶苗移栽与驯化试验 瓶苗在生根培养基中生长15 d后便可长出健壮的根系,根数4~5条,根长约1 cm,不经过闭瓶与开瓶炼苗,直接进行移栽驯化。将生根植株从瓶内拿出,洗掉培养基,栽入穴盘中,基质配比为泥炭∶椰糠∶珍珠岩=12∶5∶3,将穴盘转入驯化室的小拱棚内进行驯化,保持小拱棚内温度在24~26 ℃,湿度在90%以上。
2 结果与分析
2.1 不同激素配比对外植体诱导分化的影响
外植体在初代培养基上生长1周后,各个培养基上均有腋芽开始萌动,培养4周后统计各培养基上的腋芽萌发率,结果如表1所示。从表中可以看出改良MS中添加BA 0.6 mg·L-1和IBA 0.1 mg·L-1是吉塞拉6号外植体启动和分化最适宜的初代培养基,诱导萌发率为92.1%。当BA的浓度超过0.6 mg·L-1时,外植体萌发的新芽中出现玻璃化的现象,当IBA低于0.06 mg·L-1时,新芽只有叶片长出。由此说明高浓度的细胞分裂素会引起吉塞拉瓶苗的玻璃化,生长素在吉塞拉6号外植体的诱导分化中起重要作用,可促进茎枝的伸长。
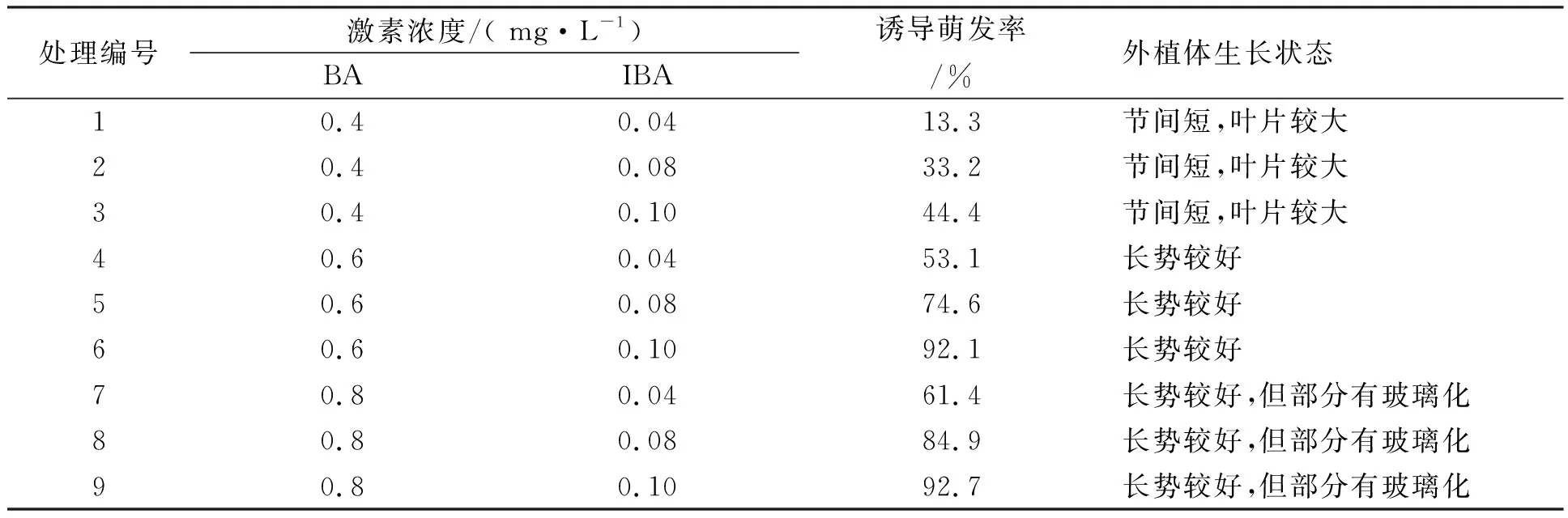
表1 不同激素配比的外植体诱导分化状况

图1 玻璃化的外植体

图2 正常生长的外植体
2.2 不同继代培养基对瓶苗增殖生长的影响
本试验中重点研究BA和IBA对吉塞拉6号组培瓶苗增殖生长的影响,试验结果如表2所示。从表2中可以看出不同浓度BA和IBA组合对吉塞拉6号的增殖生长影响存在明显差异。当BA的浓度达到1 mg·L-1时,瓶苗出现了玻璃化现象;当培养基中BA的浓度为0.8 mg·L-1,增殖系数随着IBA的浓度增加,先升高后下降,植株生长健壮,叶片颜色较深;IBA浓度为0.1 mg·L-1时,繁殖系数最高,为3.62。以上结果说明芽的增殖数量和生长状态取决于BA和IBA的相对比例,试验结果与植物生长调节激素的作用原理一致。在实际的组培苗规模化生产中,需根据生产情况而选择不同的培养基。

表2 不同继代培养基的瓶苗增殖生长状况

图3 玻璃化瓶苗

图4 正常瓶苗
2.3 不同生长素配比对瓶苗生根的影响
植物生长激素中生长素对瓶苗的生根起决定性作用,本试验重点研究IBA和NAA对吉塞拉6号试管苗瓶内生根的影响,结果为(表3)这2种激素均可诱导吉塞拉6号试管苗生根,生根率以及根系的情况并不相同,IBA诱导的根系细长,最高生根率为25.9%;NAA诱导的根系粗壮且短,最高生根率为35.1%。单个激素诱导的植株在10 d后基部膨大,15d后有乳白色根尖冒出,20 d后根系长约1~2 cm。两种激素组合诱导的植株在7 d后基部膨大,10 d后根部有乳白色根尖冒出,15 d后根长约1~2 cm,最高生根率为98.6%,根系粗度适中。综上所述将2种激素组合后的诱导比单个激素诱导效果好,本试验较适宜激素配比为NAA 1 mg·L-1+IBA 0.5 mg·L-1。
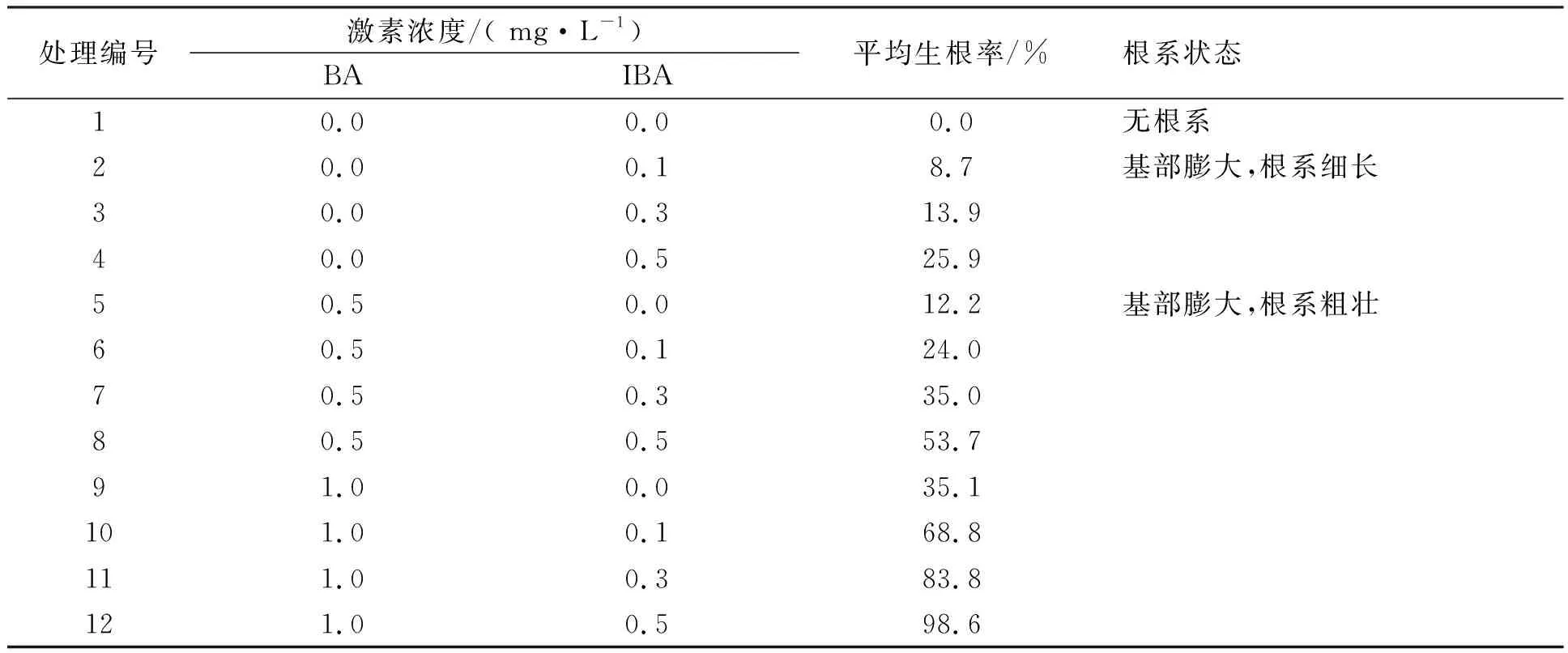
表3 不同生长素配比的瓶苗生根状况

图5 IBA诱导的根系

图6 NAA诱导的根系

图7 激素组合诱导的根系
2.4 生根苗的移栽与驯化
本研究中生根瓶苗的驯化移栽不用进行瓶内炼苗,直接将生根植株洗去培养基,移栽至50孔林木穴盘中,基质中包含泥炭、椰糠和珍珠岩,配比为12∶5∶3(v∶v∶v),1周后根部有新根长出,1个月后移栽成活率达95%以上,此时可将穴盘苗转移至硬化室使其快速生长,加强水肥管理及病虫害防治,3个月后苗高便可长至50 cm以上,可做嫁接的砧木苗用。
3 结论与讨论
本研究结论为适宜吉塞拉6号的初代培养基是改良MS+ 6-BA 0.6 mg·L-1+IBA 0.1 mg·L-1,诱导率为92.5%;继代培养基是改良MS+6-BA 0.8 mg·L-1+IBA 0.1 mg·L-1,增殖系数为5.6;生根培养基是1/2MS+NAA 1 mg·L-1+IBA 0.5 mg·L-1,生根率为98%;生根瓶苗移栽成活率在95%以上。
MS是吉塞拉砧木组织培养中的常用培养基,但在我们实际生产中作为继代基本培养基,容易出现植株茎尖生长点坏死以及玻璃化现象,本试验采用改良MS作为基本培养基后,成功解决了该问题,具体原理需进一步探索研究。高浓度BA会引起吉塞拉瓶苗玻璃化,这与前人研究结果相同[5,9]。我们发现瓶苗生根需使用低浓度IBA和高浓度NAA激素组合,与前人的报道并不一致[5-7,9-10],这可能与组培苗的内源激素、生长状况以及培养基的组分等不同有关;采用这2种激素配比缩短了生根周期,植株根系一致且较短,便于移栽且栽后生长快;生根瓶苗在移栽前进行瓶内炼苗并不利于植株的生长,去除该环节可提高移栽成活率,植株长势更强,与前人报道不同[5-10],这可能与驯化环境与移栽后的管理有关。在实际生产中省略该步骤缩短了生产周期,节省生产成本至70%。本研究利用EDDHA对铁离子有特殊螯合功效,可提高铁盐利用率的功用[11],首次在吉塞拉砧木组织培养中使用EDDHA-螯合铁代替了EDTA螯合铁,促进了植株生长,使用方便。
