三种农药对人神经母瘤细胞SH-SY5Y的联合毒性机制
2021-04-13董燕婕王磊邬元娟范丽霞赵善仓王文博
董燕婕,王磊,邬元娟,范丽霞,赵善仓,王文博
(山东省农业科学院农业质量标准与检测技术研究所/山东省食品质量与安全检测技术重点实验室,山东 济南 250100)
近年来,随着复合农药的大量使用和轮换用药日渐普及,农药残留现象比较突出[1]。农药残留不仅显现在农产品上,土壤和水环境中也有报道。欧洲食品安全风险监测结果显示,30%的样品含有多种农药残留,且最高含有10种以上[2]。Hvězdová等[3]对欧洲中部75个耕地土壤中的53种农药和15种转化物进行了检测,发现51%的土壤检出不低于5种农药。在水生态环境中,农药往往以复合污染物的形式存在,多种农药经常共存于水体中[4]。多种农药组分联合毒性效应可能为协同效应、拮抗效应等,这种联合毒性效应的不确定性对农药的风险评价构成潜在威胁[5]。我国在制定农产品农药残留限量标准时一般仅考虑单一农药的风险,在各类监测项目中对不合格产品的判定也是以某一种农药是否超标作为标准,尚未考虑多种农药同时残留的情况。由于农产品中单个农药的残留水平较低,其能够引起的毒性效应也较低,但在实际联合暴露情形下则可能引起较为明显的联合毒性效应。
基于近几年国家食品及农产品质量安全风险监测和风险评估数据,选取毒死蜱、克百威和联苯菊酯为主要研究对象。毒死蜱主要通过多种作用机制引起肝功能障碍、遗传毒性、神经行为和神经化学变化;主要毒性是由于抑制乙酰胆碱酯酶(AChE)而引起的神经毒性[6]。克百威毒性较高,急性暴露可抑制体内胆碱酯酶活性,导致流泪、流涎、瞳孔缩小、痉挛等,同时还具有生殖毒性、发育毒性、基因毒性、神经毒性等[7]。联苯菊酯为拟除虫菊酯类农药,是一种神经毒剂,通过干扰离子通道、损伤神经系统,从而产生兴奋性神经毒性,出现神经中毒症状[8]。为评估上述3种农药是否影响人类神经系统结构或功能,使用已知具有高表达水平的神经元型nAChRs的人神经母瘤细胞SH-SY5Y[9],研究3种农药单独和联合作用SH-SY5Y细胞后的细胞毒性、凋亡率、活性氧水平、非酶和酶促抗氧化剂水平等指标,对3种农药的联合毒性作用进行评价,以期探明农药残留混合物的联合毒性效应,为食品安全及人体健康风险评估和标准制定提供参考。
1 材料与方法
1.1 试剂与仪器
人神经母瘤细胞SH-SY5Y(本实验室保存);DMEM 高糖培养基、胎牛血清、胰酶购自Gibco公司;CCK-8试剂盒、活性氧检测试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒均购自江苏凯基生物技术股份有限公司;SOD检测试剂盒、MDA检测试剂盒、GSH检测试剂盒、克百威(CAS:1563-66-2,纯度≥98.8%)、毒死蜱(CAS:2921-88-2,纯度≥99.1%)、联苯菊酯(CAS:82657-04-3,纯度≥98.5%)标准品均购自北京坛墨质检股份有限公司。
超净工作台(中国苏州净化SW -CJ-1FD);CO2培养箱(日本SANYO XD-101);荧光倒置显微镜(日本OLYMPUS IX51);台式低速离心机(中国上海医疗器械股份有限公司);流式细胞仪(美国Becton-Dickinson FACSCalibur)。
1.2 细胞培养与染毒
SH-SY5Y细胞用含10%胎牛血清、1.0%青霉素-链霉素的DMEM高糖培养基,于37℃、质量分数5% CO2培养箱中培养至对数生长期。将3种农药原药用二甲基亚砜(DMSO)溶解,配成100 mmol/L的标准储备液,-20℃储存,试验时用无血清培养基稀释至待测浓度。
1.3 细胞毒性检测
1.3.1 细胞存活率检测 采用CCK-8法测定3种农药单独及混合对SH-SY5Y细胞活性的影响[10]。调整对数期细胞密度为5×104个/mL,每孔100μL接种于96孔板中孵育24 h后,弃去培养液,加入含不同浓度克百威、毒死蜱、联苯菊酯农药及其组合的培养液继续培养24、48 h,克百威、毒死蜱、联苯菊酯及其联合组终浓度分别为0.01、0.1、0.5、1、10、100、1 000μg/mL,联合组的克百威、毒死蜱、联苯菊酯比例为1∶1∶1。每孔中加入10μL CCK-8试剂,继续孵育2 h,用酶标仪测定其在450 nm下的吸收值。
1.3.2 细胞凋亡率检测 采用Annexin V-FITC法测定3种农药单独及混合对SH-SY5Y凋亡率的影响[11]。将对数生长期的细胞消化接种到六孔板中,次日待细胞贴壁后,分别加入浓度为10 μg/mL克百威、毒死蜱、联苯菊酯及其组合,联合组克百威、毒死蜱、联苯菊酯比例为1∶1∶1,对照组不添加农药,培养48 h。用0.25%胰酶(不含EDTA)消化收集细胞;用PBS洗涤2次(1 000 r/min离心5 min),收集并调整细胞浓度为5×105个/mL;加入500μL的Binding Buffer悬浮细胞;加入5μL Annexin V-FITC混匀后,加入5μL Propidium Iodide,混匀;室温、避光反应5~15 min;用流式细胞仪检测细胞凋亡情况。
1.3.3 细胞内活性氧(ROS)含量 采用DCFH-DA荧光探针法检测细胞内活性氧含量[12]。将对数生长期的细胞消化接种到六孔板中,次日待细胞贴壁后,分别加入浓度为10μg/mL克百威、毒死蜱、联苯菊酯及其组合,联合组克百威、毒死蜱、联苯菊酯比例为1∶1∶1,对照组不添加农药,培养48 h。用PBS洗涤细胞一次(1 000 r/min离心5 min),收集并调整细胞浓度为1×106个/mL;按照1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10μmol/L,将收集后的细胞悬浮于稀释好的DCFH-DA中,37℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一次,使探针和细胞充分接触;用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA;用流式细胞仪检测(Ex=488 nm;Em=530 nm)细胞内活性氧情况。
1.3.4 细胞氧化应激指标测定 将对数生长期的细胞消化接种到六孔板中,次日待细胞贴壁后,分别加入浓度为10μg/mL克百威、毒死蜱、联苯菊酯及其组合,联合组克百威、毒死蜱、联苯菊酯比例为1∶1∶1,对照组不添加农药,培养48 h。小心吸取各组细胞0.1 mL进行测定。超氧化物歧化酶(SOD)、脂质过氧化产物丙二醛(MDA)、谷胱甘肽(GSH)活性均按照试剂盒说明进行[13,14]。采用酶联免疫检测仪分别在550 nm和532 nm波长下测得其吸光度。
1.4 数据处理与分析
农药间的相互作用类型采用Chou-Talaly数学模型[15]分析获得。混合物的联合毒性类型采用CompuSyn(Compusyn Inc.,USA)[16]软件进行分析。CI>1表示拮抗作用;CI=1表示加和作用;CI<1表示协同作用。使用SPSS软件分析并处理数据,结果以平均值±标准差表示。通过Microsoft Excel软件制图。
2 结果与分析
2.1 克百威、毒死蜱、联苯菊酯对SH-SY5Y细胞存活率的影响
由图1可知,暴露24 h,不同浓度克百威、毒死蜱、联苯菊酯对SH-SY5Y细胞增殖的抑制率均低于20%,但具有浓度依赖性;暴露48 h,毒死蜱、克百威、联苯菊酯最高浓度处理对细胞增殖的抑制率分别为25.67%、20.98%和18.50%,均具有浓度依赖性。与单独处理相比,联合处理组对SH-SY5Y细胞增殖的抑制率极显著增加(P<0.01)。由图2可知,3种农药在不同效应水平下均为协同效应(CI<1),随着浓度的增加,CI值逐渐减小,说明协同作用逐渐增强,在效应10%水平下,3种农药呈极强的协同作用。

图1 3种农药单独和联合对SH-SY5Y细胞的抑制率
2.2 克百威、毒死蜱、联苯菊酯对SH-SY5Y细胞凋亡率的影响
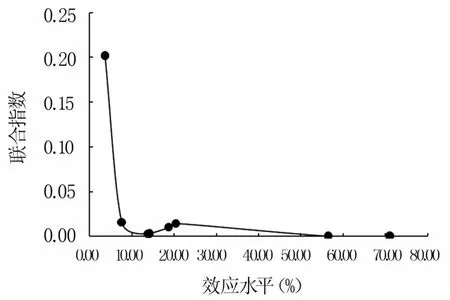
图2 48 h三种农药的联合指数

图3 双染法流式细胞术检测图
等浓度的毒死蜱、克百威、联苯菊酯处理SHSY5Y细胞48 h后,与对照组相比,均能引起细胞产生显著的凋亡现象(P<0.05,图3)。如表1所示,克百威处理组的细胞凋亡率为11.46%;联苯菊酯处理组的细胞凋亡率为10.66%;毒死蜱处理组的细胞凋亡率为10.06%。三者混合作用于SHSY5Y细胞后引起的凋亡率上升到38.04%。

表1 流式细胞术检测各组细胞凋亡率
2.3 克百威、毒死蜱、联苯菊酯对SH-SY5Y细胞ROS的影响
与对照组相比,克百威、联苯菊酯、毒死蜱处理后均使SH-SY5Y细胞产生过量ROS(P<0.05);3种农药处理之间无显著性差异,表明3种农药均可以诱导SH-SY5Y细胞产生氧化应激。联合组与单独组相比,产生ROS的水平极显著(P<0.01)提升(图4)。
2.4 克百威、毒死蜱、联苯菊酯对SH-SY5Y细胞抗氧化水平的影响
通过检测3种农药单独和联合处理SH-SY5Y细胞的SOD、GSH和MDA活性,判断其对细胞抗氧化水平的影响(图5)。与对照组相比,暴露于限量浓度的3种农药后SH-SY5Y细胞内SOD和GSH活性均显著下降(P<0.05),MDA活性显著提高;3个农药处理组间差异不显著。该结果表明3种试验农药均可以引起细胞抗氧化功能的显著下降,进一步验证了这些农药可能通过诱导氧化应激对SHSY5Y细胞产生毒性。与单独处理相比,联合组极显著降低GSH和SOD活性,提高MDA活性。说明3种农药联合对细胞诱导产生氧化应激的程度高于单独处理。

图4 3种农药对SH-SY5Y细胞产生ROS的影响

图5 3种农药对SH-SY5Y细胞中SOD、MDA、GSH活性的影响
3 讨论与结论
我国是农药生产和使用大国,农药的普遍使用尤其是复配农药的兴起,使多种农药残留的现象比较突出。岳晖等[17]对山东省市售蔬菜进行监测表明,18.7%的产品(322批次)含两种微量农药残留,15.4%(265批次)的产品存在3种及以上微量农药残留。多种农药在无损害作用水平下混合可产生复杂的联合效应,从而引起机体氧化应激、肝肾功能障碍[18]。即使是微量水平下的多农药残留毒性也可能是数倍或是数十倍地高于单体农药残留毒性[19]。因此本试验选取蔬菜中检出较多但超标率不高的3种农药,采用SH-SY5Y细胞作为体外模型,研究其单独和联合作用对细胞存活率的影响。结果表明,3种农药单独作用于细胞均降低其存活率,在培养24 h和48 h后均具有浓度依赖性。Wang等[20]在体外用不同浓度的氯化镉和毒死蜱(50、100 mmol/L)以及其组合处理SD大鼠脾淋巴细胞,发现毒死蜱对脾淋巴细胞增殖有显著抑制作用。克百威和毒死蜱对人肝细胞L-O2的增殖有抑制效果[21]。本试验表明3种农药联合作用于细胞时,其毒性高于单独处理;不同毒性效应水平下均为协同作用,随着毒性效应水平的增加,CI值逐渐降低,协同效应逐渐增强。这说明虽然农产品中单独农药残留量低于国家限量值,但多种农药同时存在引发的强协同作用可能导致毒性呈数倍甚至数十倍的增大。
细胞凋亡是指在一定的病理或生理条件下,细胞自发地遵循自身程序,并由相关基因调控而呈现出的一种自主有序的死亡过程。本试验研究了3种农药单独和联合对细胞凋亡的诱导作用,结果表明单独农药处理可显著引发细胞凋亡,且联合作用细胞的凋亡率显著高于单独农药。
为研究毒性、凋亡与氧化损伤之间的关系,本研究测定了暴露于各农药的SH-SY5Y细胞内ROS水平和GSH、SOD及MDA活性,结果表明无论单独还是联合处理,3种农药均显著改变细胞的氧化还原因子水平,且联合作用组的ROS含量显著高于单独处理组;3种农药均显著降低SOD和GSH活性,增加MDA活性。说明农药通过产生过量ROS和抑制抗氧化系统诱导SH-SY5Y细胞产生氧化应激,证实氧化应激是农药在SH-SY5Y细胞内引起毒性的机制之一。这与前人研究结果[22,23]类似。
综上所述,各农药单剂和组合可以抑制细胞增殖,显著诱导SH-SY5Y细胞产生氧化应激,并发生凋亡,但是混合农药诱导凋亡的作用机制尚不清楚,需要进一步通过细胞体外试验和动物体内试验探究其凋亡靶点和通路,为评估农药多残留联合毒性机制提供科学依据。
