小麦幼苗根系相关性状QTL定位与分析
2021-04-13刘洋王克森刘秀坤王利彬王灿国郭军程敦公穆平刘建军李豪圣赵振东曹新有张玉梅
刘洋,王克森,刘秀坤,王利彬,王灿国,郭军,程敦公,穆平,刘建军,李豪圣,赵振东,曹新有,张玉梅
(1.青岛农业大学农学院,山东 青岛 266109;2.山东省农业科学院作物研究所/小麦玉米国家工程实验室/农业部黄淮北部小麦生物学与遗传育种重点实验室,山东 济南 250100)
小麦种植范围遍布全球,提供了全球约40%人口的粮食需求[1]。近年来由于全球气候的改变,小麦产量较难满足人民的需求,因此,提高小麦产量是解决粮食危机的重要途径之一[2]。小麦产量受许多因素影响,其中根系从土壤中吸收其生长所需营养成分,对产量的影响尤为重要[3]。根系优先吸收距离较近的养分,其形态特征、次生根的数量、根群的活力与分布均影响根系对养分的吸收、传送[4-6]。
近年来,对小麦根系相关性状定位的研究越来越多,白彩虹[7]以Avalon×Cadenza构建的DH群体为材料,定位到9个与根长相关的QTLs,分别位于3A、3B、4D、5B、6A染色体上,可解释6.03%~16.03%的表型变异,同时发现控制多个性状的QTL位于同一区间。刘秀林等[8]利用构建的小麦DH群体在4A染色体上定位到1个控制最大根长的QTL,在3B染色体上定位到1个控制总根长和1个控制根直径的QTL,在2D染色体上定位到1个控制根直径的QTL。张瑶尧[9]利用F2∶3群体定位到了38个与根系相关的QTLs,分别位于1A、2A、2D、3A、3B、3D、4A、5B、5D、6B、6D、7A、7B和7D染色体上。李卓坤[10]利用构建的DH群体,检测到1个与根表面积相关的QTL,1个与根体积相关的QTL,1个控制根长的QTL。周晓果等[11]以构建的DH群体为材料,检测到3个与根数相关的QTLs,3个与最大根长相关的QTLs。在根系的各项形态指标中,根长是根系研究中重要的特征参数[12],根长增加,根系的表面积随之增大,可以促进根系对有机物营养元素的吸收[13]。目前关于小麦总根长和最大根长的定位结果见表1。但根系生长在地下,想要对其检测,相对于其他性状而言较难,且受环境影响很大,具有较大的遗传变异性[14]。
为了进一步挖掘影响小麦根系形态的基因,本研究以菏麦13与临麦2号为亲本构建的F8代重组自交系(RIL)群体为材料,拟通过SNP芯片分析,构建遗传连锁图谱,定位根系相关的QTLs,以期为小麦根系性状研究提供理论支撑。

表1 已定位到的小麦根长性状QTL位点
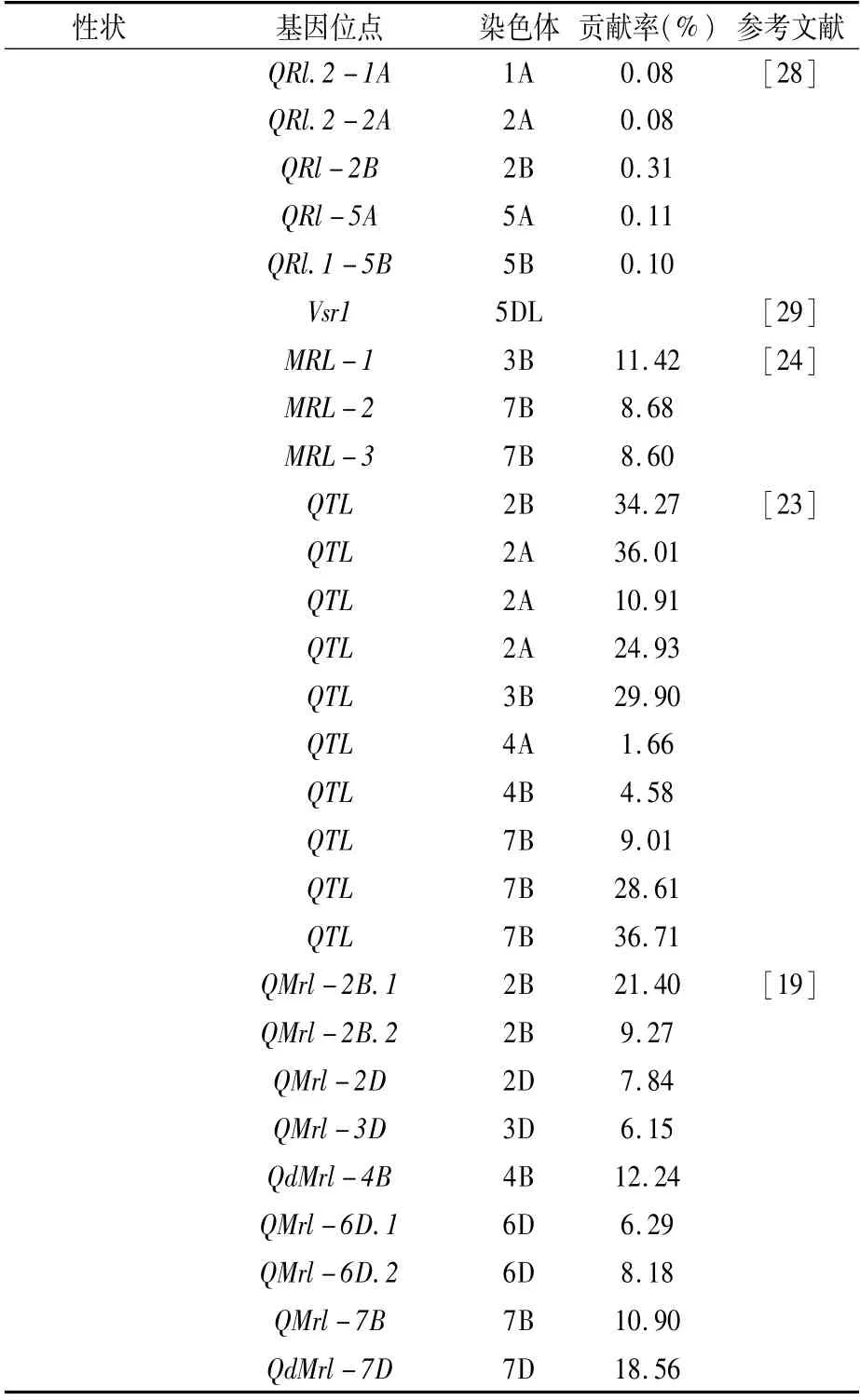
表1(续)
1 材料与方法
1.1 试验材料
本试验以菏麦13为母本、临麦2号为父本进行杂交,通过单粒传法得到包含200个株系的F8代RIL群体。其中,菏麦13是菏泽市农业科学院以沛304-1×鲁麦4号组合培育而成的优质、高产、抗病、弱冬性小麦,适合种植于黄淮冬麦区,于2000年4月通过山东省审定[30];临麦2号是由临沂市农业科学院以鲁麦23号×临90-15选育出的优质、稳产、抗逆、半冬性小麦,抗旱性1级,于2004年8月通过山东省审定[31]。
1.2 试验方法
1.2.1 小麦幼苗根系的培养 试验材料的准备:收获后,从每株系中挑选15粒饱满、形态相似的种子,用10%的H2O2处理15~20 min,纯净水冲洗5次,保证处理时间相同。
具体试验步骤如下:
(1)准备一次性培养皿,铺上两层滤纸,适当距离摆放种子,置于暗处36 h;
(2)每个材料挑选9粒萌发形态较为一致的种子摆放在有纱网的培养盘中,每盘种60个材料,室外用纯净水培养一周后,将培养盘移到室内再培养5 d(幼苗长到一心一叶),期间换1次纯净水;
(3)培养液配制:配制Hoagland营养液母液,量取15 mL母液逐步加入去离子水中,配制成15 L培养液,将pH值调到6.2;
(4)幼苗移栽:每个材料选取3株长势一致的幼苗,转入培养盒中用Hoagland营养液培养,每盒种202个材料,3次重复,室温培养9 d,每4 d换一次培养液;
(5)试验材料保存:待幼苗长到四叶一心期,剪下根放入自封袋,-20℃冰箱保存。
1.2.2 小麦幼苗根系性状测定 利用EPSON公司的EU-88型根系扫描仪扫描RIL群体幼苗根系形态,通过WinRHIZO软件分析总根长、根体积、根表面积、根平均直径、根尖数等性状表型值,取三次重复平均值进行分析。
1.2.3 RIL群体全基因组SNP芯片分析 利用北京中玉金标记公司研发的15k育种芯片对RIL群体200个株系及其亲本的基因组进行高通量基因分型,并对样品及分析结果进行质控:(1)计算样品的DQC(Dish QC)和CR(call rate)值,判断样品数据是否适合进行后续基因分型分析;(2)SNP位点质控,标记质量分类,选择群体最优标记分型类型;(3)基因分型分析,根据Affymetrix(Thermo Fisher)的筛选标准[32]过滤标记,筛选后得到8 558个多态性位点用于遗传图谱构建。
1.2.4 遗传图谱构建 以菏麦13和临麦2号为亲本构建的RIL群体为作图群体,对8 558个多态性位点进行筛选:舍去杂合率高的标记(>10%)和缺失率高的标记(>10%);应用Tassel v5.0过滤偏分离标记(0.3∶0.7)。
通过QTL IciMapping v4.2对标记初步分组。应用QTL IciMapping v4.2 Bin功能整合同一位点的所有共分离标记,仅保留一个用于后续做图;QTL IciMapping v4.2 Map过程识别基因型数据,根据连锁关系将标记分到小麦21条染色体上。
应用Join Map v4构建全基因组遗传连锁图谱。对QTL IciMapping初步分组结果进行检验,Regression mapping过程确定标记位置并计算遗传距离。
1.2.5 QTL定位方法 利用Windows QTL Cartographer 2.5软件复合区间作图法(CIM)进行QTL分析,置换检测(permutation test)参数设置为P=0.05水平下1 000次重复排列。QTL命名方法[33]按照q+目标性状+染色体+QTL个数。
2 结果与分析
2.1 遗传图谱构建
本研究利用筛选得到的8 558个多态性位点进行遗传图谱构建,所得遗传连锁图谱包含1 003个SNP标记,覆盖21条染色体,全长2 358.54 cM,标记间平均间距2.35 cM(表2)。

表2 遗传图谱标记分布及密度
2.2 小麦幼苗根系性状表型分析
根系扫描仪扫描分析RIL群体及其亲本的根系形态,利用SPSS 23.0软件进行基本统计和相关性分析。结果(表3)显示,亲本菏麦13的总根长、根体积、根表面积均小于亲本临麦2号;根平均直径和根尖数均大于临麦2号。从分离群体的分布(图1)可以看出,RIL群体幼苗根系性状均表现为双向超亲分离,样本分布呈正态分布或近似正态分布,符合多个基因控制的数量遗传性状特征,可以进行QTL定位。
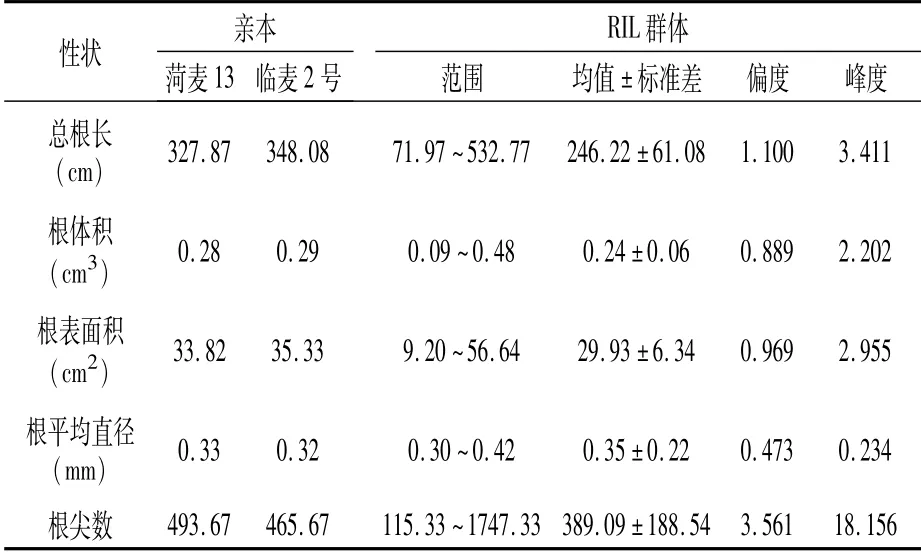
表3 RIL群体及其亲本幼苗根系性状的表型分析
2.3 根系各性状间相关性分析
分析结果(表4)表明,根表面积与总根长、根体积、根尖数呈显著正相关(P<0.01),相关系数为0.570~0.830;总根长与根体积、根尖数呈显著正相关(P<0.01),相关系数为0.600~0.676,与平均直径呈显著负相关(P<0.01);根体积与根尖数、根平均直径呈显著正相关(P<0.01),相关系数为0.152~0.521;根尖数与根平均直径呈显著负相关,相关系数为-0.163。

表4 根系各性状间相关性分析
2.4 小麦幼苗根系QTL定位分析
共检测到13个QTLs,分布于小麦的1D、3A、3B、4B、5A、5B、6B和7B染色体上(表5和图2),可解释5.11%~20.12%的表型变异。

图1 RIL群体幼苗根系性状的样本分布
检测到5个与根表面积相关的QTLs,分布于1D、3A、3B、4B、5B。1D染色体上的qRSA-1D可解释19.32%的表型变异,LOD值为4.83,加性效应为-11.91;3A染色体上的qRSA-3A可解释20.12%的表型变异,LOD值为6.70,加性效应为-11.48;3B染色体上的qRSA-3B可解释9.89%的表型变异,LOD值为4.47,加性效应为2.03;4B染色体上的qRSA-4B可解释20.00%的表型变异,LOD值为6.57,加性效应为-11.70;5B染色体上的qRSA-5B可解释16.37%的表型变异,LOD值为5.68,加性效应为12.82。
检测到3个与总根长相关的QTLs,分布于3B、6B、7B。3B染色体上的qRL-3B可解释6.50%的表型变异;位于6B染色体上的qRL-6B可解释11.56%的表型变异,LOD值为-10.01;位于7B染色体上的qRL-7B可解释5.11%的表型变异,LOD值为2.42。
检测到4个与根体积相关的QTLs,分布于1D、3B、4B、5B。1D染色体上的qRV-1D可解释18.31%的表型变异,LOD值为3.38;位于3B染色体上的qRV-3B可解释8.66%的表型变异,LOD值为3.85;位于4B染色体上的qRV-4B可解释11.58%的表型变异,LOD值为2.76;位于5B染色体上的qRV-5B可解释13.90%的表型变异,LOD值为3.55。
检测到1个与根平均直径相关的QTL,5A上的qRAD-5A可解释18.97%的表型变异。

表5 小麦幼苗根系性状的QTL定位结果
3 讨论与结论
本研究共定位到13个小麦根系相关的QTLs,分别位于1D(2)、3A、3B(3)、4B(2)、5A、5B(2)、6B、7B染色体上。通过分析QTL定位结果,发现在1D染色体标记区间AX-111632760~AX-109830556内存在1个QTL簇,包含了1个控制根表面积的QTL qRSA-1D,1个控制根体积的QTL qRV-1D,且贡献率都大于10%,为主效QTL。前人通过定位发现了多个QTL簇,王璐[34]利用泰农18×临麦6号的RIL群体定位了6个QTL簇,分布在1D、3A、3B(2个)、5D和6B染色体上。1D染色体上定位到控制根体积(QRv-1D)和控制根体积抗旱系数(QDCRv-1D)的2个QTL。3B染色体上定位到1个QTL簇,控制总根长的QTrl-3B和控制根平均直径的QRad-3B.1。6B染色体上定位到了1个QTL簇,控制根体积和根表面积2个性状的QTL(QRv-6B和QRsa-6B.2)。Yuan等[35]利用RIL群体定位到10个与苗期性状及成株期性状有关的QTL簇,分布在1A、1D、4B、5D、6A和6B六个染色体上,占总QTL数量的36.53%,7个相对高频QTL(RHFQTL)在4个QTL簇中被检测到,10个QTL簇分成两种类型:一种是仅在苗期性状被检测到,另一种是在苗期和成株期性状都可以被检测到。王红日[36]以125个小麦品种(系)进行关联分析,检测到26个QTL簇,分别位于1A、1B、1D、2A、2B、3A、3B、4A、5A、6B、7A和7B共12条染色体上。其中1D染色体上检测到两个QTL簇,包含3个QTL,可解释平均表型变异的范围为12.37% ~13.11%;另一QTL簇可解释平均表型变异的范围为9.56%~26.45%。
根表面积、总根长、根体积三个性状检测到相同的QTL位点,位于3B染色体上标记区间AX-110413790~AX-110375698内。控制根表面积的qRSA-3B可解释9.89%的表型变异;控制总根长的qRL-3B可解释6.50%的表型变异;控制根体积的qRV-3B可解释8.66%的表型变异。位于4B 染色体上AX-110430517~AX-111102215区间存在两个QTL位点。控制根表面积的qRSA-4B,LOD值为6.57,可解释20.00%的表型变异;控制根体积的qRV-4B,LOD值为2.76,可解释11.58%的表型变异。5B染色体上AX-109055754~AX-111538681检测到两个QTL位点,控制根表面积的qRSA-5B,LOD值为5.68,可解释16.37%的表型变异;控制根体积的qRV-5B,LOD值为3.55,可解释13.90%的表型变异。相关性分析显示,根表面积与根长、根体积显著正相关,与王璐[34]、翟荣荣[37]等的结果相同,说明根表面积与根长、根体积三个性状的关系密切,本研究检测到的位于3B、4B和5B染色体上的QTL位点存在一因多效的作用。其中,在3B染色体上检测到的控制根表面积、总根长、根体积的QTL簇包含qRSA-3B、qRL-3B、qRV-3B与董肖昌[21]定位到的控制茎叶干重的qSDW3Ba位置相近。
周升辉等[22]在7B染色体上检测到1个控制小麦最大根长的QTL,QMrl.cau-7BS,贡献率为9.41%;任永哲等[38]发现位于7B染色体上控制最大根长的QMrl.sqn-7B,能解释8.00%的表型变异。杨彩凤[39]利用DH群体在7BS染色体上检测到1个控制主根长的QTL位点qTL-7B,LOD值为2.84,贡献率为5.95%。姜朋[40]在7B染色体上定位到1个控制根长的QTL QRl-7B,LOD值为2.79,能解释9.50%的表型变异。本研究在7B染色体上定位到控制总根长的qRL-7B,能解释5.11%的表型变异。根据以上结果推测在小麦7B染色体上可能存在控制根长的重要基因。本研究检测到的位于6B染色体上控制总根长性状的 qRL-6B,位于标记区间 AX-109889475~AX-111468538之内,贡献率为11.56%,与周小鸿[41]在6B染色体上定位到控制总根长性状的qTRL-6B位置相近。
对两个亲本菏麦13和临麦2号的根系性状表型数据分析显示,临麦2号的总根长、根体积、根表面积大于菏麦13;根平均直径、根尖数小于菏麦13。在控制根表面积的5个QTL中,2个QTL加性效应为正值,增效基因来自菏麦13;控制根长的3个QTL中,2个QTL加性效应为正值,增效基因来自菏麦13;控制根体积的4个QTL中,2个QTL加性效应为正值,增效基因来自菏麦13。控制根平均直径的1个QTL,加性效应为负值,增效基因来自于临麦2号,以上结果说明在表现型较差的亲本中含有增加这种表型的基因,与黄清华[26]、Wang[17]、刘新元[18]等的结论一致。后续将进一步对本研究检测到的QTL进行精细定位,以期挖掘出控制根系的重要功能基因,为分子育种提供候选基因。
