两种靶向血栓载尿激酶微泡理化特性的比较研究*
2021-04-08饶华清车雪瑜潘晓熊
饶华清,车雪瑜,潘晓熊,黄 岗,陈 星,吴 棘△
(1.广西医科大学研究生院,南宁 530021;2.广西科学院,南宁 530003)
由血栓引起的血栓性疾病是一种常见的心脑血管疾病,溶栓是最为有效的治疗方法。尿激酶作为第一代溶栓药物,由于其疗效好、原料丰富、价格便宜,是临床上最常用的溶栓药物。尿激酶在体内的血液清除半衰期较短,只有20 min左右,溶栓时需要持续静脉滴注以维持血药浓度,容易引起出血的并发症,若让尿激酶具有血栓靶向性,选择性地作用于血栓部位,那么就可以提高尿激酶局部血药浓度,减少尿激酶的用量从而减少出血不良反应。
精氨酸-甘氨酸-天冬氨酸序列(Arg-Gly-Asp,RGD)是具有生物活性的短肽序列之一,其能与活化血小板表面的糖蛋白Ⅱb/Ⅲa受体特异性结合,即可与血栓特异性结合,是血栓的靶点之一[1]。
声诺维(SonoVue)是目前临床上最常用的超声造影剂,其可作为一个载体将靶点与药物结合起来。而脂质体(Liposome)是脂类材料分散在水中时形成的脂质双分子层,水溶性和脂溶性药物可分别包裹在脂质体内部和双分子层中,是一种低毒高效的药物载体[2-3]。
本研究分别制备了载尿激酶携RGD声诺维和载尿激酶RGD修饰脂质体,探讨两种载体各自的优缺点,从中找出最适宜的靶向血栓载体。
1 材料与方法
1.1 实验试剂
尿激酶原料药、胆固醇、二棕榈酰磷脂酰胆碱(DPPC)、DiI染料均购自北京索莱宝科技有限公司,DSPE-mPEG2000、二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-cRGD(DSPE-mPEG2000-cRGD)购自湖南华腾制药有限公司,异硫氰荧光素(FITC)标记的尿激酶和5-TAMRA荧光标记的RGD肽段由上海吉尔生化合成有限公司,声诺维(注射用六氟化硫微泡)购自广西医科大学第一附属医院中心药房,Bradford蛋白浓度测定试剂盒(去垢兼容型)购自上海碧云天生物技术有限公司等。
1.2 载尿激酶携RGD声诺维的制备
1.2.1制备
使用直接连接法制备载尿激酶携RGD声诺维。将声诺维粉剂与5 mL生理盐水混合后摇晃30 s后可得到白色、乳状的微泡混悬液。将FITC标记的尿激酶和5-TAMRA标记的RGD分别溶于生理盐水中并混匀。按照一定的比例将三者混匀,用旋涡混合器以400 r/min的转速振荡60 s后,室温下静置、孵育2 h。
1.2.2洗涤
上述制备完成后,取出一半静置,另一半采用浮选法洗涤[4]:将混悬液置于离心管内,加入等量的生理盐水,400 r/min离心1 min后可见微泡聚集在液体的顶部,保留上层液,弃去下清液,重复洗涤2次。
1.2.3理化性质检测
取少量微泡混悬液,光学显微镜下观察其形态和大小;荧光显微镜观察微泡的荧光标记情况;粒径细胞仪测定微泡的粒径。
1.2.4载尿激酶携RGD声诺维双结合率检测
流式细胞仪下检测FITC荧光标记尿激酶、5-TAMRA荧光标记RGD与声诺维的双结合率,洗涤后再次检测双结合率。
1.3 载尿激酶RGD修饰脂质体的制备
采用薄膜水化法制备载尿激酶RGD修饰脂质体。按一定比例称量DPPC、胆固醇、DSPE-mPEG2000、DSPE-mPEG2000-cRGD,将混合物加入茄形瓶中用5 mL氯仿溶解,并用水浴超声5 min使其完全溶解,置于旋转蒸发器(上海亚荣生化仪器厂)减压旋转蒸发使其在瓶底形成均匀的薄膜,放在真空干燥机中干燥过夜,以挥发干净有机溶剂。次日,用5 mL PBS缓冲液溶解尿激酶,加入茄形瓶中振荡并结合水浴超声将瓶底的薄膜水化,待薄膜完全水化后形成乳白色的混悬液,用移液枪转移至离心管内,超声细胞破碎仪(比利时Diagenode公司)超声10 min(4 ℃,5 s/5 s,on/off,320 W,60个循环)。超声完成后,4 ℃ 3 000 r/min离心5 min,离心后立即吸取上清液至EP管内。将混悬液转移至透析袋内,用2 L的PBS缓冲液透析6 h以除去未包封的尿激酶。用同样的方法制备空白对照脂质体(脂质体内包封的是PBS缓冲液)。
1.3.1检测理化性质
取少量制备好的载尿激酶RGD修饰脂质体,在光学显微镜及透射电镜下观察脂质体的形态及大小;粒径细胞仪测定脂质体的粒径。
1.3.2载尿激酶RGD修饰脂质体的体外释放曲线
取2 mL制备好的载尿激酶RGD修饰脂质体置于透析袋内,两端扎紧放进50 mL的离心管内,在离心管内加入20 mL pH为7.4的PBS缓冲液作为释放介质,于37 ℃摇床(100 r/min)进行释放试验。分别于0.2、0.4、1、2、3、4、5、6、7、8、12、24 h取6 mL透析袋外的液体,同时补充等量的PBS缓冲液。用Bradford蛋白浓度测定试剂盒测定释放液中尿激酶的浓度。
1.3.3载尿激酶RGD修饰脂质体的体外靶向性实验
配制浓度为10 μmol/L的DiI荧光染料,将载尿激酶RGD修饰脂质体或载尿激酶脂质体与DiI染料避光孵育20 min,制备成带荧光的脂质体。将新鲜血液滴于载玻片上,干燥使其凝固,取少量孵育好的载尿激酶RGD修饰脂质体和单纯载尿激酶脂质体滴加在血凝块上,孵育20 min,冲洗后用荧光显微镜观察脂质体与血凝块的结合情况。
2 结 果
2.1 载尿激酶携RGD声诺维
2.1.1表征
载尿激酶携RGD声诺维靶向微泡外观呈玫红色,不透明,静置以后容易分层,上层为白色凝乳状的微泡,下层为微微浑浊、半透明的玫红色液体;在光学显微镜下,洗涤前靶向微泡呈圆形,分布均匀,无明显聚集现象;洗涤后微泡大小未见明显改变,但可见聚集现象。在荧光显微镜下,靶向微泡表面可激出尿激酶和RGD的圆环形荧光标记,荧光染色均匀。连续洗涤2次后,荧光强度减弱。
2.1.2粒径大小和双携带率
粒径大小约5 015.2 nm,声诺维携RGD粒径约4 321.3 nm;载尿激酶携RGD声诺维的平均粒径约4 432.7 nm,见图1;洗涤前载尿激酶携RGD声诺维的双携带率为76.33%,洗涤后双携带率为46.19%,见图2。
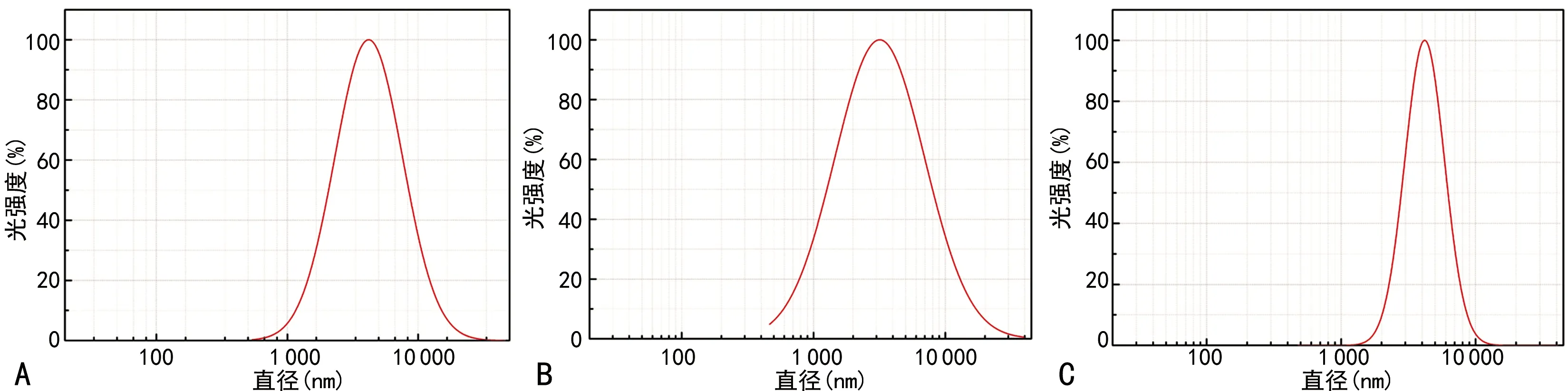
A:声诺维载尿激酶;B:声诺维携RGD;C:载尿激酶携RGD声诺维。

A、B:洗涤前;C、D:洗涤后。
2.2 载尿激酶RGD修饰脂质体
2.2.1表征
脂质体外观呈乳白色,浑浊、不透明,静置后也不分层。在光学显微镜下仅能观察到细小的圆点,其内结构显示不清,透射电镜下可见脂质体呈类圆形(图3)。空白脂质体平均粒径约139.7 nm;载尿激酶RGD修饰脂质体平均粒径约141.3 nm,见图4。
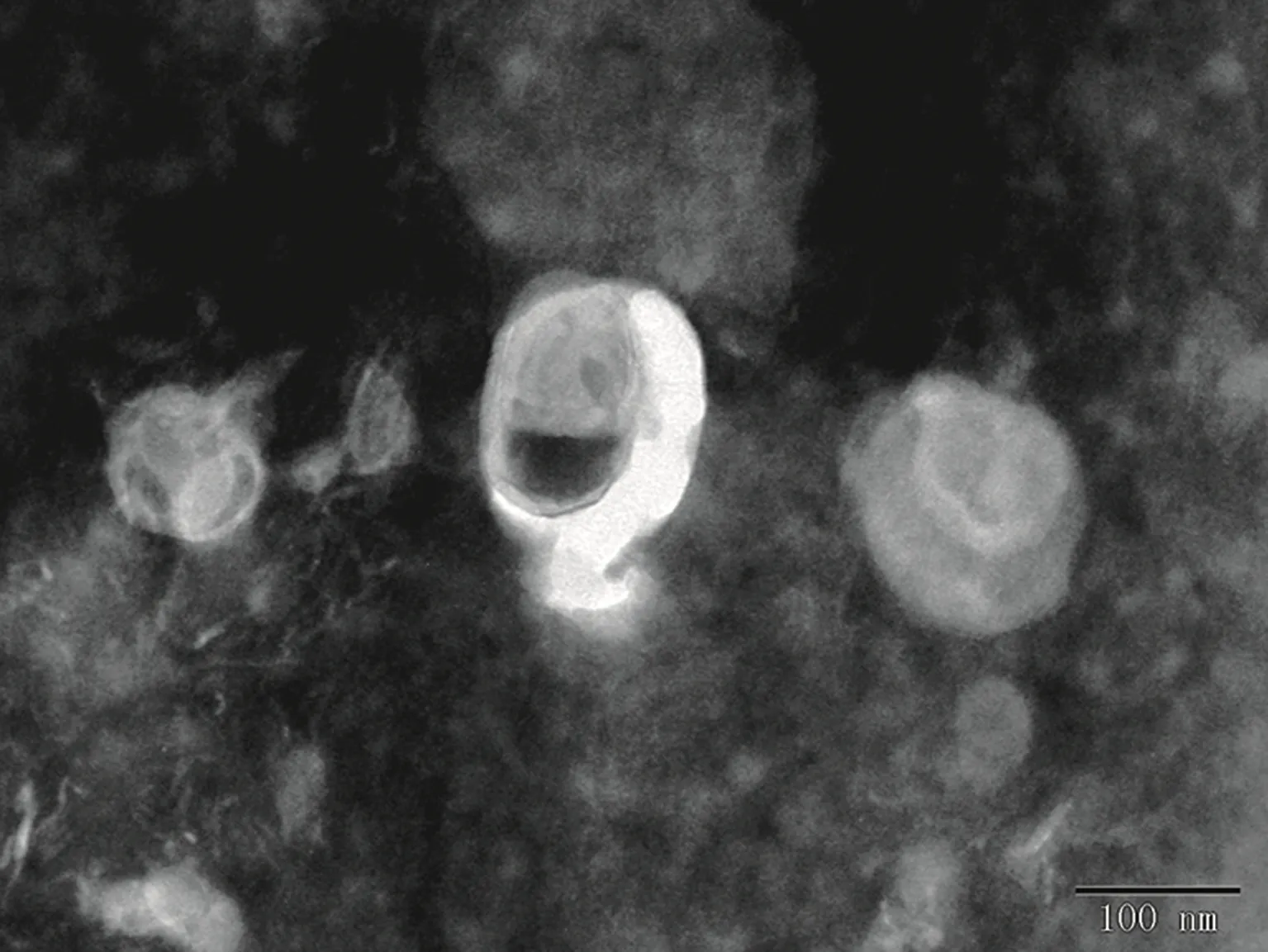
图3 载尿激酶RGD修饰脂质体的透射电镜形态

A:空白脂质体粒径;B:载尿激酶RGD修饰脂质体粒径。
2.2.2载药量包封率和体外释放
根据以下公式(1)、(2)计算出脂质体的载药量为19.07%,包封率为34.33%。

(1)

(2)
在体外模拟人体环境中,随着时间的延长,尿激酶缓慢释放,1 h尿激酶释放率约36.34%,12 h后尿激酶释放开始进入平台期,24 h后尿激酶几乎停止释放,见图5。
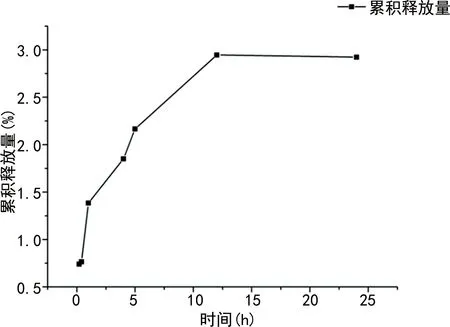
图5 载尿激酶RGD修饰脂质体的体外释放曲线
2.2.3体外实验
在载尿激酶RGD修饰脂质体的体外靶向性实验中,荧光显微镜下可见靶向脂质体与血凝块结合,载尿激酶RGD修饰脂质体发出红色荧光(图6),而单纯载尿激酶脂质体未能与血凝块结合,未见明显荧光。

图6 载尿激酶RGD修饰脂质体的体外靶向性实验
3 讨 论
近年来,超声造影剂在应用研究方面取得了突破性的进展,其在治疗领域的发展也越来越受到关注[5]。随着超声造影剂的出现和不断发展[6],将特异性配体连接到造影剂微泡的表面,使其到达感兴趣的组织或器官[7],选择性的与相应受体结合,从而达到特异性增强靶区的超声信号或局部靶向治疗的目的[8-9]。微泡造影剂携带药物的方法主要有[10]:(1)药物直接黏附在微泡表面;(2)将药物掺入微泡内部;(3)将药物嵌入微泡膜上;(4)通过静电吸附作用,药物可以非共价结合到微泡表面。
本实验通过直接连接法将尿激酶黏附在造影剂声诺维的微泡外壳上。采用直接连接法时,由于声诺维微泡的外壳为单层磷脂,而脂质微泡具有化学双极性(即结构上同时具备疏水与亲水两种基团),在不添加其他外在化学成分的情况下可以通过自身的离子键、物理吸附等方法将药物直接黏附到声诺维壁上,方法简单,易于操作[5]。在荧光显微镜下可见载尿激酶携RGD声诺维微泡发出圆环状荧光,表明尿激酶与RGD均位于微泡表面。流式细胞仪结果表明,静置2 h后载尿激酶携RGD声诺维的双结合率未见明显改变,较为稳定;但洗涤后靶向微泡的双结合率由76.33%下降至46.91%,结合率明显下降。洗涤后结合率下降的原因可能是尿激酶与声诺维微泡表面磷脂的结合力(离子键)为非共价结合不稳定。
对于脂质体的制备则采用薄膜水化法。由于尿激酶是水溶性药物,此方法对水溶性药物可获得较高的包封率,但是制备出的脂质体粒径较大且不均一,通过超声波处理在一定程度上可以减小脂质体的粒径并使其均一化[11]。本实验制备出的负载尿激酶RGD修饰脂质体粒径大小约141.3 nm,属于纳米级别,纳米级别的载体可以渗入更小的细胞间隙[12],使药物更好地发挥作用。而载尿激酶RGD修饰脂质体的体外靶向性实验表明制备出来的脂质体可在体外与血栓相结合,具有血栓靶向性。
药物在血液运输过程中由于各种酶的作用会有一部分被丢失[13],这可能是药物在体内有生物半衰期的原因之一,如果单纯使用游离药物,为了使药物在血液中达到有效的治疗浓度,则需要加大药量,但加大药量可能会导致全身性的不良反应且难以达到靶向的效果。尿激酶在人体内的半衰期约为20 min,为了达到溶栓效果,临床上常常需要持续静脉滴注,大大增加了患者的出血风险。而将药物与载体结合或者包封于载体内,在靶向的位置释放药物使药物在局部聚集,这才是较为理想的药物传输方式[8,14]。本实验将尿激酶直接吸附在声诺维微泡的表面,并不能减少尿激酶与血液的接触,即尿激酶在体内的半衰期并不能延长,这点与游离尿激酶一致。本实验制备的载尿激酶携RGD声诺维微泡的优势主要在于可以行超声显影观察血栓的位置及大小,携带RGD的声诺维可以靶向血栓使其周围聚集尿激酶,血栓局部的尿激酶浓度增加;但是该靶向微泡的缺陷也十分明显,其与尿激酶、RGD双携带率经洗涤之后大幅度下降,外加在人体复杂的内环境下尿激酶的半衰期短,在同等药量下,可能游离尿激酶的溶栓效果会更好。有研究表明[15],纳米脂质体在提高药物疗效与减少用药量方面有重要的作用。脂质体可以将亲水性的尿激酶包封于含水的内腔,避免了尿激酶过早的与血液接触导致衰减,相当于延长了尿激酶的半衰期,同时也避免了尿激酶在到达血栓前过早释放而减少了药物的用量;在脂质体的膜材中加入了靶向血栓的RGD肽段,可以使脂质体靶向血栓后缓慢释放尿激酶溶栓;但本研究制备的脂质体包封率和载药量都不高,在制备过程中会造成尿激酶的浪费。有研究表明,采用其他方法如主动载药法等制备脂质体,其包封率可达到90%以上[16],可见脂质体包载尿激酶的包封率和载药量还有提升的空间。
综合考虑,脂质体更适于作为靶向血栓的载体,下一步需要研究提高包封率与载药量的具体方法。脂质体主要由磷脂和胆固醇构成,其中磷脂是主体成分,而磷脂有天然提取和人工合成两类,因此制备脂质体的磷脂种类繁多。本研究采用的磷脂是DPPC,接下来笔者将研究其他种类的磷脂(如卵磷脂、氢化卵磷脂等)对脂质体的包封率和载药量是否有影响,从中找出脂质体包封尿激酶最佳的膜材配方及比例。与此同时,改进脂质体的制备方法。脂质体的制备方法众多,除了本研究中的薄膜水化法,还有注入法、逆向蒸发法、pH梯度法、冷冻干燥法、冻融法、超声分散法等,在制备载药脂质体的过程中根据实际情况有选择地结合和改变,以期在增加脂质体的包封率和载药量的同时不损害药物的活性。
