黏附连接蛋白Afadin在结直肠癌组织中的表达及临床意义*
2021-04-08卞红磊于溯洋程敏静梁春慧
桂 林,卞红磊,于溯洋,程敏静,梁春慧
(河北医科大学第三医院:1.肛肠一科;2.药剂科,石家庄 050051)
Afadin是近期发现的一种黏附连接蛋白,在细胞内与连接素(Nectins)、上皮细胞钙黏蛋白 (E-cadherin)及纤维状肌动蛋白(F-actin)等构成黏附连接,参与调控细胞定向移动、增殖等多种功能[1-3]。与此同时,多种肿瘤中存在Afadin编码基因的异常融合,在某些类型的肿瘤,例如乳腺癌[4]、子宫内膜癌[5]及胰腺癌[6]中,还存在Afadin表达水平的改变,本研究将检测Afadin在结直肠癌(colorectal cancer,CRC)中的表达情况,结合临床资料分析其临床意义。
1 资料与方法
1.1 一般资料
本研究已经通过本院临床研究伦理学会委员会批准(批准号:H2016-008-1)。所有患者均在本院肛肠一科手术,术前都未接受新辅助治疗。第一组病例包含2017年1-12月20例CRC患者,分别留取肿瘤组织及相对应的非肿瘤组织,进行蛋白免疫印记(Western blot)和免疫组织化学染色检测;第二组病例包含2010年1月至2013年1月共118例CRC患者,每例患者均拥有较为完整的病例资料和随访信息,肿瘤组织切片进行免疫组织化学染色评分,并与临床病理资料和预后资料进行相关性分析。
1.2 方法
1.2.1主要试剂
兔抗人Afadin多克隆抗体购于美国Abcam公司,SP试剂盒、BCA蛋白浓度测定试剂盒及电化学发光(ECL)试剂盒购于上海碧云天生物技术公司。
1.2.2Western blot
提取总蛋白,采取BCA法进行蛋白定量,每组上样20 μg,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转膜,一抗孵育过夜,二抗孵育1.5 h,ECL显影,以GAPDH为内参计算Afadin的表达水平。
1.2.3免疫组织化学染色及结果判定
切片脱蜡入水,热修复法进行抗原修复,滴加一抗后4 ℃孵育12 h,此后依次滴加二抗和辣根过氧化物酶标记的链霉卵白素,DAB显色,复染后脱水透明封片。由两位病理科医师单独进行结果评分。密度评分分为:0分(阴性,无黄色),1分(弱阳性,呈浅黄色),2分(中等阳性,呈棕黄色),3分(强阳性,呈棕色),阳性细胞比例评分分为:0分(未见阳性细胞),1分(阳性细胞百分比小于25%),2分(阳性细胞百分比25%~50%),3分(阳性细胞百分比大于50%),两个评分相乘即获得免疫组织化学染色评分。
1.3 统计学处理
2 结 果
2.1 Afadin在CRC组织中的表达
利用Western blot对20例CRC患者的肿瘤组织及相对应非肿瘤组织进行Afadin表达水平检测,其中的15对标本(75%),肿瘤组织中的Afadin表达水平低于相对应的非肿瘤组织(P<0.05),见图 1。对标本进行了免疫组织化学染色,结果显示,Afadin阳性细胞呈现细胞膜和细胞质着色。在非肿瘤组织中,Afadin呈中或强阳性表达(免疫组织化学染色评分大于4分)的比例为70.0%(14/20),而在肿瘤组织中,Afadin呈中或强阳性表达的比例为30.0%(6/20),两组比较差异有统计学意义(P<0.01),见图2。
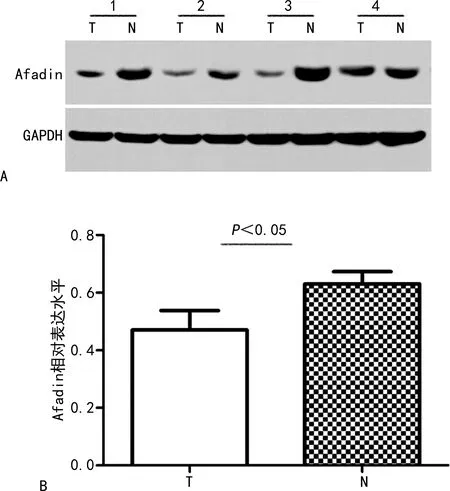
A:Western blot检测结果;B:两组标本表达平均灰度值比较;T:肿瘤组织;N:非肿瘤组织;1、2、3、4为病例号。
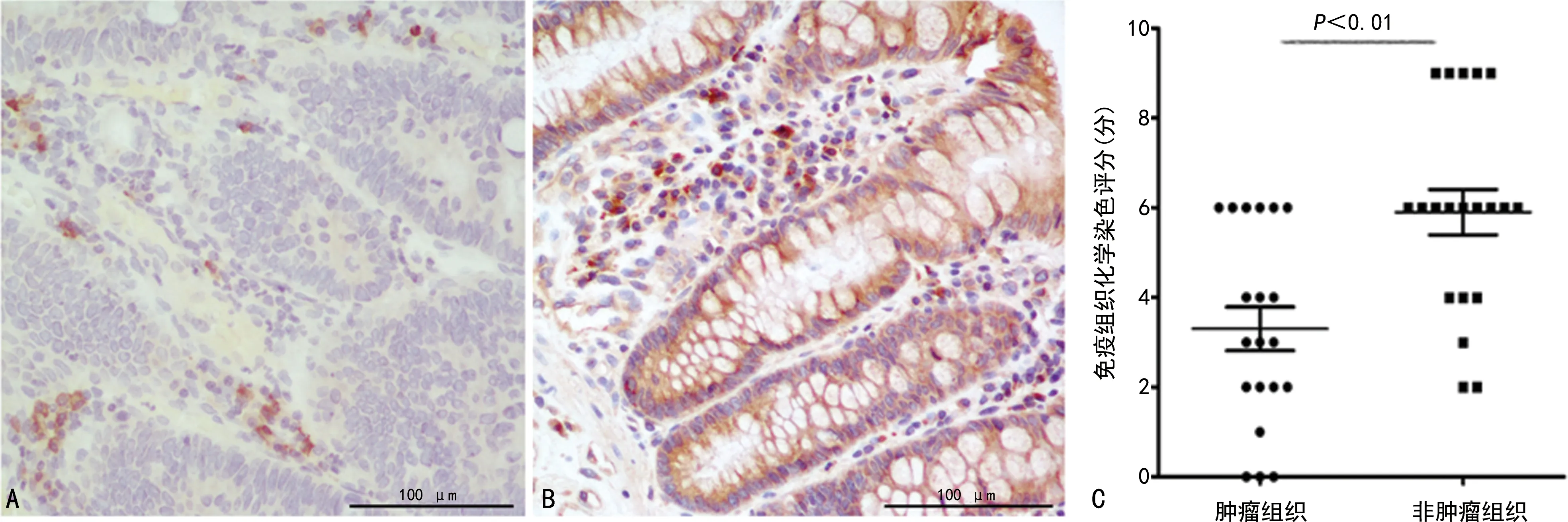
A:Afadin在肿瘤组织中低表达(×200);B:Afadin在非肿瘤组织中高表达(×200);C:两组间免疫组织化学染色评分比较。
2.2 CRC组织中Afadin表达水平与临床病理学因素之间的相关性分析
为了进一步分析CRC组织中Afadin表达水平与临床病理因素之间的相关性,笔者利用免疫组织化学染色的方法对118例CRC患者的肿瘤组织切片进行Afadin表达水平检测,根据免疫组织化学染色评分将其分为两组,Afadin高表达组(IHC评分大于4分)及Afadin低表达组(IHC 评分小于或等于4分),然后与患者的临床病理资料进行相关性研究,单因素分析结果显示,肿瘤组织中的Afadin表达水平与患者年龄、性别、肿瘤部位、肿瘤大小、病理组织学类型、脉管浸润、神经浸润均无明显相关性(P>0.05),但是在浸润深度达到T3水平及以上(P=0.020)或出现淋巴结转移(P=0.043)的肿瘤组织中,Afadin低表达的发生率明显升高,见表1。
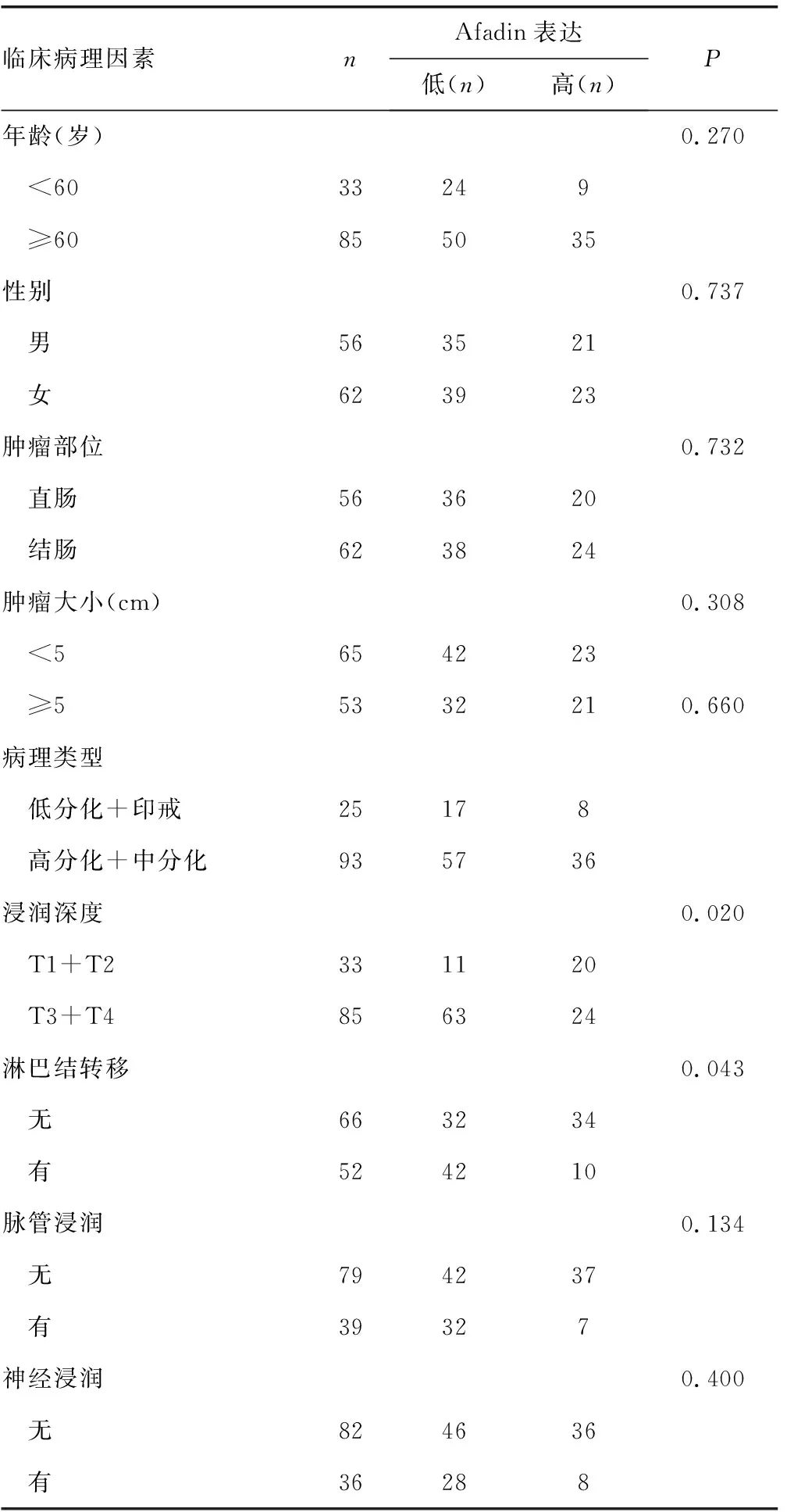
表1 118例CRC患者组织标本Afadin表达水平和临床病理因素之间的关系
2.3 CRC组织中Afadin表达水平对预后的影响
在上述118例CRC患者中,笔者还进行了Afadin表达水平与预后的相关性分析,结果显示,肿瘤组织中Afadin低表达患者总的生存率更低(P<0.01),见图3。将年龄、性别及Afadin表达水平引入Cox多因素回归分析,结果显示,出现淋巴结转移及Afadin低表达是CRC预后的独立风险因素,见表2。
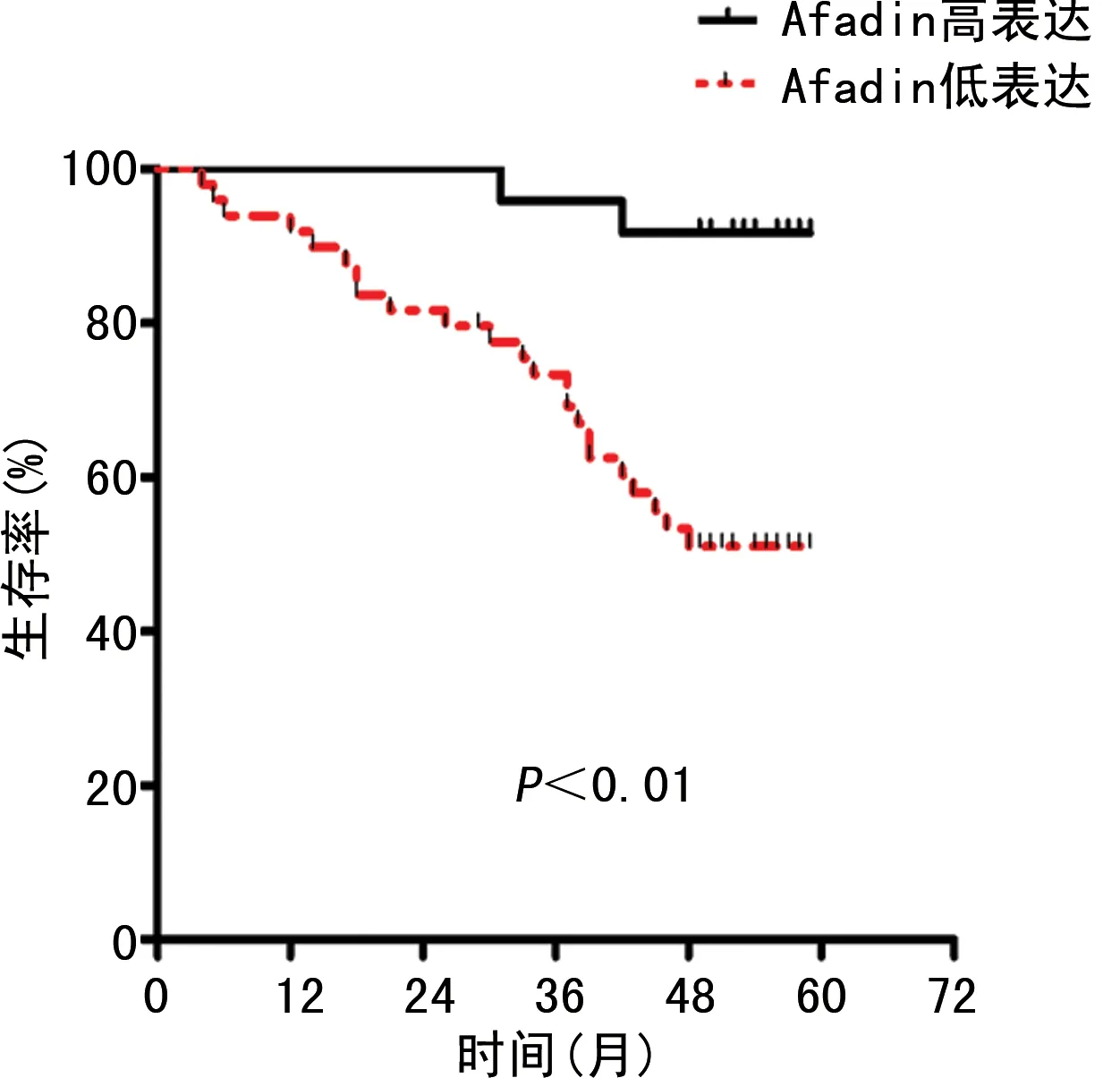
图3 Afadin高表达组和低表达组CRC患者的生存曲线
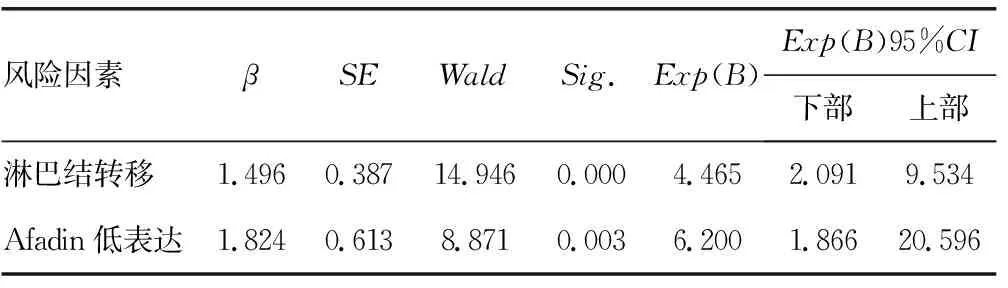
表2 118例CRC患者预后的Cox多因素回归分析
3 讨 论
细胞极性的建立对于维持上皮细胞的屏障功能是至关重要的,细胞极性丧失不仅会导致上皮出现渗漏,还在肿瘤的发生发展中发挥着关键性作用,参与上皮间质转化及肿瘤转移的过程,目前,细胞极性丧失已经被看作是进展期上皮性肿瘤的标志之一[7-8]。细胞极性的建立是一个多步骤过程,其中之一就是细胞黏附和连接复合体的正确组合,细胞与细胞之间的黏附主要依靠黏附连接(AJs)及紧密连接(TJs)维持。构成黏附连接的几种成分,例如E-cadherin 和 Catenins,与肿瘤的进展和转移有密切的关系,目前已经成为肿瘤研究领域的关注热点[9]。Afadin作为黏附连接蛋白之一,几乎存在于所有的上皮细胞之中,它捆绑肌动蛋白微丝和Nectins构成肌动蛋白骨架,参与调控多种细胞功能。鉴于Afadin在维持细胞极性中的关键性作用,它也逐渐受到肿瘤研究领域的关注,逐渐增多的研究结果显示,在多种类型的肿瘤中,存在Afadin表达水平的改变,并与肿瘤的恶性表现密切相关,例如Afadin与Claudin-2协作,共同促进乳腺癌细胞出现转移[10];在三阴乳腺癌对阿霉素耐药的产生机制中,也有Afadin的参与[11];对于恶性胶质瘤来说,Afadin促进了病理性血管形成[12];当胃癌细胞感染幽门螺杆菌后,Afadin的表达水平下降,同时伴有上皮间质转化[13];紧密连接蛋白2通过下调Afadin/ERK信号通路,抑制骨肉瘤细胞转移[14],这些研究都提示,Afadin可能通过多个途径,广泛参与肿瘤的发生发展过程。
根据上述研究结果,笔者推测,在CRC中可能也存在Afadin表达水平的改变,为了验证这种推测,本研究首先选择了20例CRC患者的肿瘤组织及其对应的非肿瘤组织,分别利用Western blot及免疫组织化学染色的方法对Afadin蛋白表达水平进行了检测,两种检测的结果都显示,与对应的非肿瘤组织比较,CRC组织中确实存在Afadin表达水平下降的现象。随后,为了检验Afadin的表达水平是否能够反映肿瘤的恶性程度,本研究又选择了拥有完整病例资料和随访信息的118例CRC患者,分别对肿瘤组织切片进行免疫组织化学染色评分并与临床病理因素和预后资料进行相关性分析,结果显示,肿瘤组织中 Afadin的表达水平与肿瘤的浸润深度及淋巴结转移状况密切相关,与Afadin高表达的患者比较,Afadin低表达的患者总生存率明显降低,Afadin低表达是CRC预后的独立风险因素,这些结果提示,Afadin参与CRC的发展与转移,CRC出现Afadin表达水平降低,预后不良。
尽管本研究发现,在CRC中存在Afadin表达水平的改变,但是这种改变是发生在转录、翻译还是翻译后加工及修饰层面并不明确,笔者将继续进行相关研究;与此同时,笔者还将对CRC细胞的Afadin表达水平进行干预,观察干预后CRC细胞生物学特性的改变,以进一步明确Afadin与CRC的相关性,为探索Afadin是否能够成为治疗CRC的新靶点提供依据。
