FAT/CD36表达及转位在有氧运动改善老年小鼠骨骼肌胰岛素敏感性中的作用
2021-04-06孙婧瑜苏亚娟秦黎黎董静梅
孙婧瑜,苏亚娟,秦黎黎,董静梅
关键字:衰老;运动干预;脂肪酸转位酶;胰岛素信号通路
随着社会老龄化的发展,老年人糖尿病的发病率急剧上升(Evans et al.,2013)。研究表明,衰老能够诱导胰岛素抵抗的发生(Hamanoue et al.,2017)。胰岛素抵抗是高血压、肥胖、2型糖尿病、非酒精性脂肪肝等代谢性疾病的主要危险因素。骨骼肌作为能量代谢的主要器官,随着年龄的增长,骨骼肌胰岛素敏感性下降(Dagdeviren et al.,2017;Hamanoue et al.,2017)。因此,骨骼肌被认为是衰老诱导胰岛素抵抗的主要部位(Biswas et al.,2016)。
近年来,有研究发现脂质代谢紊乱是衰老诱导骨骼肌胰岛素敏感性下降的重要因素(Biswas et al.,2016)。长链脂肪酸(long-chainfatty acids,LCFAs)从脂肪组织运输到骨骼肌线粒体需要经过一系列脂肪酸转运载体的调控。其中,脂肪酸转位酶(fatty acid translocase,FAT/CD36)广泛存在于骨骼肌中(Nickerson et al.,2009),并且FAT/CD36向细胞膜的转位功能可能是所有脂肪酸转运载体中所特有的(Romic et al.,2017)。在人类肥胖模型及啮齿类动物胰岛素抵抗模型研究中发现,细胞膜FAT/CD36与脂肪酸摄取、甘油三酯堆积以及胰岛素刺激下葡萄糖摄取的减少密切相关(Bonen et al.,2004)。因此,骨骼肌细胞膜FAT/CD36在调节脂肪酸转运过程中可能起到了中心作用。有研究发现,与衰老相关的胰岛素抵抗发生时,细胞膜FAT/CD36含量增多不是由于FAT/CD36合成的增加,而是由于永久固定于细胞膜上的FAT/CD36增多。这种永久固定于细胞膜上的FAT/CD36增多可能是导致2型糖尿病早期发病的主要因素;而线粒体功能障碍引起的过量脂质沉积可能是糖尿病后期发病的主要因素(Steinbusch et al.,2011)。因此,对骨骼肌FAT/CD36的表达及转位机制进行研究可能是糖尿病防治的新思路。
由于运动的安全性、有效性和多重靶点作用等优势,越来越多的研究聚焦其潜在的糖尿病防治机理。然而,运动对衰老诱导的胰岛素抵抗骨骼肌FAT/CD36的作用及作用机理尚不明确。因此,本研究首先利用siRNA干扰技术,在C2C12细胞中进行FAT/CD36基因敲低,探讨FAT/CD36缺乏对骨骼肌细胞胰岛素信号通路的影响。其次,利用老年小鼠,探讨运动对老年小鼠骨骼肌FAT/CD36总蛋白含量的影响。有研究发现,与FAT/CD36总蛋白相比,运动诱导的FAT/CD36向细胞膜的转位功能可能对骨骼肌脂肪酸代谢更为重要(Mcfarlan et al.,2012)。电压依赖性阴离子通道蛋白(voltage-dependent anion channel,VDAC)是线粒体外膜上含量极为丰富的孔状蛋白,也是线粒体的重要标志物之一(Zhang et al.,2019);小窝蛋白(caveolins)在FAT/CD36向细胞膜脂筏锚定的过程中起到了重要的调控作用(Eyre et al.,2007)。因此,本研究进一步探讨运动对老年小鼠骨骼肌FAT/CD36向细胞膜和/或线粒体膜转位的影响及其在细胞膜脂筏中的定位。根据研究推测,运动可能通过减少FAT/CD36的表达、增加向细胞膜脂筏转位的双重作用,激活AKT/ERK信号通路,从而改善衰老诱导的骨骼肌胰岛素敏感性。
1 实验材料与方法
1.1 C2C12细胞培养及siRNA干扰
小鼠骨骼肌C2C12细胞系在6孔板内培养,以生长培养基(高糖DMEM、10%小牛血清、1%谷氨酸、1%青霉素/链霉素)培养2天后,改用分化培养基(高糖DMEM、2%马血清、1%谷氨酸、1%青霉素/链霉素)进行分化培养4~6天。在C2C12细胞分化第3天时,换用无抗生素的分化培养基,分别对各组细胞进行siRNA干扰:siCont、siCD36-1、sicd36-2。siCont:5’-UUCUCCGAACGUGUCACGUTT-3’;siCD36-1:5’-GGAUGACAACUUCACAGUUTT-3’;siCD36-2:5’-CCACAUUUCCUACAUGCAA-TT-3’。
6孔板中每孔加入A液(150 μl Optimem+1.5 μl 20mol/L siRNA)和B液(150 μl Optimem+3 μl Lipofecta-mine RNAi-MAX)。A液混入B液后,将混合物于室温放置5 min,加入C2C12细胞,于37℃培养箱孵育6 h后,换回分化培养基,继续分化培养2天。然后,对细胞进行低糖DMEM及无血清饥饿过夜,并用含磷酸酶抑制剂的蛋白裂解液裂解细胞,用于后续检测。
1.2 实验动物与分组
8周龄C57BL/6雄性小鼠自由进食饮水,环境温度20℃~24℃,相对湿度40%~60%,通风良好,昼夜12 h/12 h循环照明(所有操作均严格遵守同济大学道德伦理委员会的要求)。小鼠自然饲养至56周龄后,随机分为老年对照组(aging control,AC;n=10)和老年运动组(aging exercise,AE;n=10)。老年对照组无特殊运动训练,进行16周中等强度运动训练。
1.3 小鼠运动模型构建
小鼠进行适应性跑台训练1周,每周6次,每次训练时间由20 min/次逐渐递增至60 min/次,跑速由10 m/min逐渐递增至20 m/min。第2周开始,小鼠跑台训练以20 m/min跑速,6次/周,60 min/次进行并持续16周。训练时间固定在每周一至周六下午,周日休息。
1.4 腹腔注射葡萄糖耐量实验
第72周末对小鼠进行腹腔注射葡萄糖耐量实验(intraperitoneal glucose tolerance test,IPGTT)。小鼠禁食16 h后,腹腔注射葡萄糖溶液1 g/kg,并分别在腹腔注射0 min、15 min、30 min、60 min、120 min及180 min时进行取血。采用罗氏卓越精采型血糖仪及其配套试纸进行血糖测量,并绘制血糖曲线,计算血糖曲线下面积(area under the curve,AUC)(Sun et al.,2018)。
1.5 腹腔注射胰岛素耐量实验
第72周末对小鼠进行腹腔注射胰岛素耐量实验(intraperitoneal insulin tolerance test,IPGTT)。小鼠禁食16 h后,腹腔注射胰岛素2 g/kg,并分别在腹腔注射0 min、15 min、30 min、60 min及120 min时进行取血。采用罗氏卓越精采型血糖仪及其配套试纸进行血糖测量,并绘制血糖曲线,计算血糖曲线下面积(AUC)(Sun et al.,2018)。
1.6 动物取材
实验干预后,小鼠禁食12 h,自由饮水。选用7 mL/kg 20%戊巴比妥钠对小鼠进行腹腔麻醉注射。主动脉取血后迅速分离双侧腓肠肌,进行RT-PCR、WB及免疫荧光相关指标检测。剩余组织置于−80℃冰箱冷冻待用。
1.7 血脂检测
甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,T-CHO)、高密度脂蛋白胆固醇(high density lipopro⁃tein cholesterol,HDL−C)及低密度脂蛋白胆固醇(low density lipoprotein chesterol,LDL-C)4项血脂指标按照相应试剂盒说明书进行酶联免疫检测仪检测。
1.8 RNA的提取和RT-PCR
60~80 mg腓肠肌剪碎后加入500 ul Trizol(抽提总RNA。室温静置5 min后,加入100 μl氯仿。12 000 r/min,4℃离心15 min后吸取170 μl上清,并加入等体积异丙醇,室温静置 10 min。12 000 r/min,4℃离心10 min,弃上清。75%乙醇洗涤沉淀2次后,沉淀溶于10 μl RNase-free水中并测定OD值。取1 μg总RNA,按照cDNA合成试剂盒说明书进行反转录。
RT-PCR 反应体系为 10 μl,包括 100 ng cDNA、5 μl 2×FastStart Universal SYBR GreenMaster、0.5 μl Primer F/R(10 μmol/L)、4 μl RNase Free Water。表1为 PCR 引物正向和反向序列。反应条件为:起始模板预变性95℃,10 min;PCR循环反应95 ℃,10 s;60 ℃,10 s,72 ℃,10 s,共40个循环。用内参β-actin对样品进行标准化,并用2-△△Ct方法计算mRNA的相对含量。

表1 荧光定量PCR引物序列Table 1 Primer Sequences for Fluorescence Quantitative PCR
1.9 免疫印迹
取60~80 mg腓肠肌置于含磷酸酶抑制剂的RIPA裂解液中,剪碎后充分匀浆(或C2C12细胞裂解液),冰上静置30 min后,12 000/min,4℃离心10 min,取上清;BCA法测定蛋白样品浓度后进行煮沸变性。蛋白样品经过SDSPAGE电泳、转膜、5%脱脂奶粉室温封闭1 h后,一抗4℃孵育过夜。TBST洗膜3次,5 min/次,二抗室温孵育1 h。采用ECL发光法检测目标蛋白条带,并用Image J软件分析条带灰度值。
1.10 免疫荧光
制备骨骼肌冰冻切片,置于4%多聚甲醛冰上固定60 min,封闭60 min后,分别加入CD36/Caveolin-1混合一抗(FAT/CD36,1:200;Caveolin-1,1:200),CD36/VDAC 混合一抗(FAT/CD36,1:200;VDAC,1:200),4 ℃孵育过夜。混合 Alexa Fluor 594(红)、Alexa Fluor 488(绿)标记的二抗,室温孵育60 min。滴加含DAPI的抗荧光淬灭剂封片。采用Zeiss LSM700激光共聚焦显微镜观察并采集图像,用ZEN分析软件分析荧光强度及共定位程度。荧光强度反映FAT/CD36蛋白表达的变化情况,共定位程度反映FAT/CD36在胞内的转位情况。
1.11 数据处理
实验数据采用SPSS 20.0软件处理,结果以平均数±标准误(M±SE)表示。组间比较采用独立样本t检验,显著性差异水平设置为P<0.05。
2 实验结果
2.1 FAT/CD36缺乏对骨骼肌细胞胰岛素信号通路AKT/ERK激活的影响
经siCD36干扰后的C2C12细胞,FAT/CD36蛋白表达水平显著下降(图1),说明本实验中的FAT/CD36基因敲低效率较好。进一步研究发现,经siCD36干扰后的C2C12细胞,AKT/ERK磷酸化水平显著增加,说明FAT/CD36基因缺乏能够激活骨骼肌细胞胰岛素信号通路。
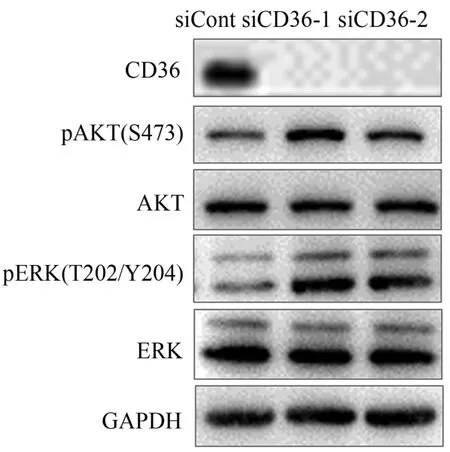
图1 FAT/CD36缺乏对C2C12小鼠骨骼肌细胞相关蛋白表达水平的影响Figure 1. Effect of FAT/CD36 Deficiency on Related Protein Expression Levels in C2C12 Skeletal Muscle Cells
2.2 运动对老年小鼠糖耐量水平的影响
小鼠腹腔注射葡萄糖0 min、15 min、30 min、60 min、120 min、180 min后血液葡萄糖水平及IPGTT血糖曲线下面积(AUC)(图2)。结果显示,AE组AUC显著低于AC组(P<0.05),说明运动能改善老年小鼠葡萄糖耐量。
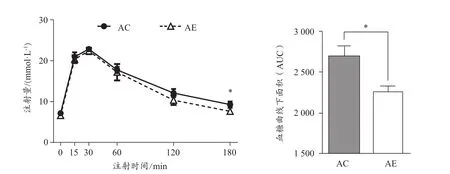
图2 运动对老年小鼠葡萄糖耐量的影响Figure 2. Effect of Exercise Intervention on Glucose Tolerance inAged Mice
2.3 运动对老年小鼠胰岛素耐量水平的影响
小鼠腹腔注射胰岛素 0 min、15 min、30 min、60 min、120 min后血液葡萄糖水平及IPITT血糖曲线下面积(图3)。结果显示,AE组AUC显著低于AC组(P<0.05),说明运动能改善老年小鼠胰岛素耐量。
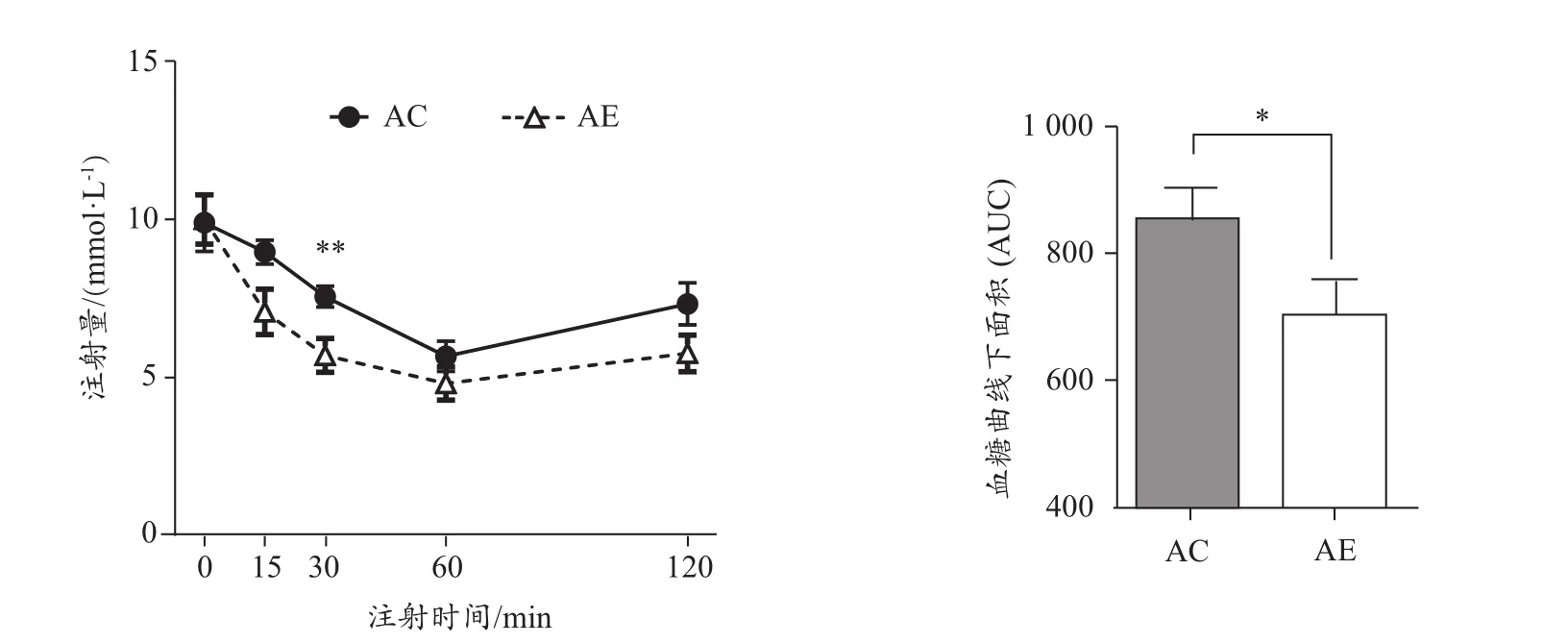
图3 运动对老年小鼠胰岛素耐量的影响Figure 3. Effect of Exercise Intervention on Insulin Tolerance inAged Mice
2.4 运动对老年小鼠血脂的影响
与AC组相比,AE组小鼠血清甘油三酯(TG)、总胆固醇(T-CHO)及低密度脂蛋白胆固醇(LDL-C)含量无显著性差异;与AC组相比,AE组小鼠高密度脂蛋白胆固醇(HDL-C)水平显著增加(P<0.01),说明运动能显著改善老年小鼠HDL-C含量(图4)。

图4 运动对老年小鼠血脂的影响Figure 4. Effect of Exercise Intervention on Blood Lipid Content inAged Mice
2.5 运动对老年小鼠骨骼肌胰岛素信号通路激活的影响
与AC组相比,AE组小鼠骨骼肌AKT/ERK磷酸化水平显著增加(P<0.05,图5),说明中等强度运动训练能显著改善老年小鼠骨骼肌胰岛素敏感性。
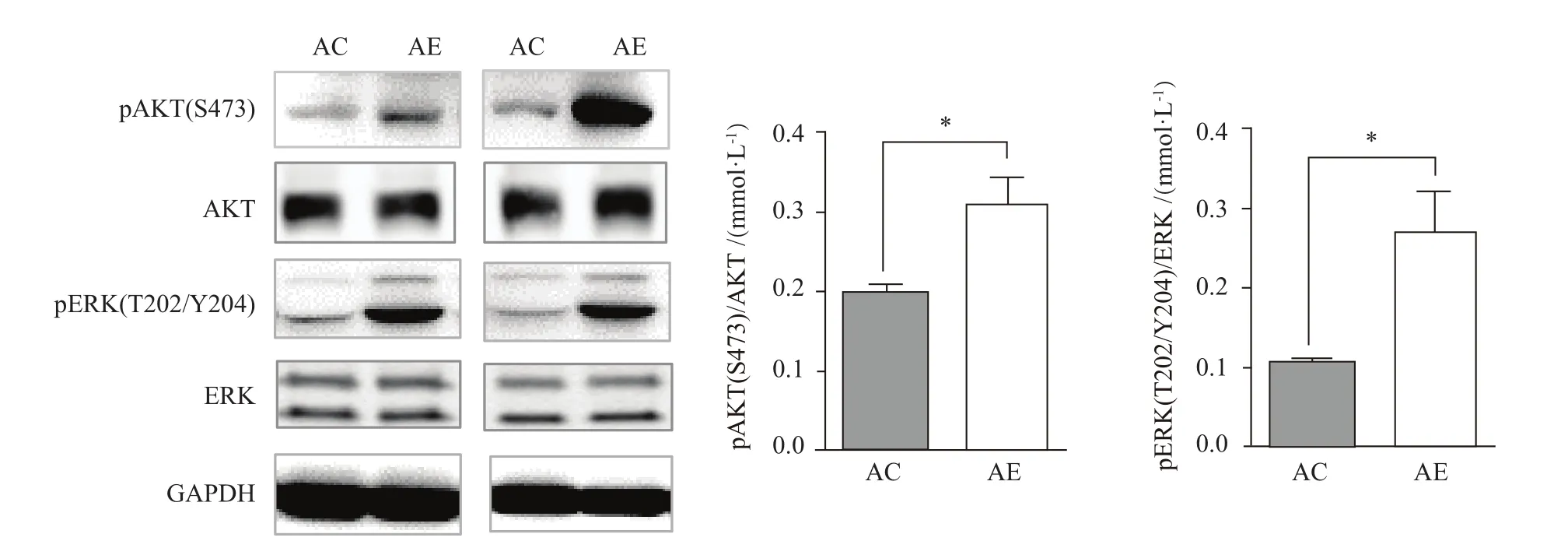
图5 运动对老年小鼠骨骼肌胰岛素信号通路激活的影响Figure 5. Effect of Exercise on theActivation of Insulin Signaling Pathway in the Skeletal Muscle ofAged Mice
2.6 运动对老年小鼠骨骼肌FAT/CD36及其他脂肪酸转运载体mRNA表达水平的影响
与AC组相比,AE组小鼠骨骼肌脂肪酸结合蛋白(fatty acid binding protein,FABPpm)、脂肪酸转运蛋白(fatty acid transport protein 4,FATP4)mRNA表达水平未见显著变化,而FAT/CD36、肉碱脂酰转移酶-1(carnitine acyltransferase-1,CPT-1)mRNA表达水平显著降低(P<0.05,图6),说明与其他脂肪酸转运载体相比,FAT/CD36、CPT-1在运动改善老年小鼠骨骼肌胰岛素敏感性中可能发挥了更重要的作用。与AC组相比,AE组小鼠骨骼肌过氧化物酶增殖物激活受体γ共化合物1α(peroxisome proliferator activated receptorγcoactivator-1α,PGC-1α)和过氧化物酶体增殖物激活受体γ(peroxisome proliferatoractivated receptor-γ,PPAR-γ)mRNA表达水平未见显著性变化,说明PGC-1α、PPARγ可能不是运动调控FAT/CD36表达变化的主要转录因子。
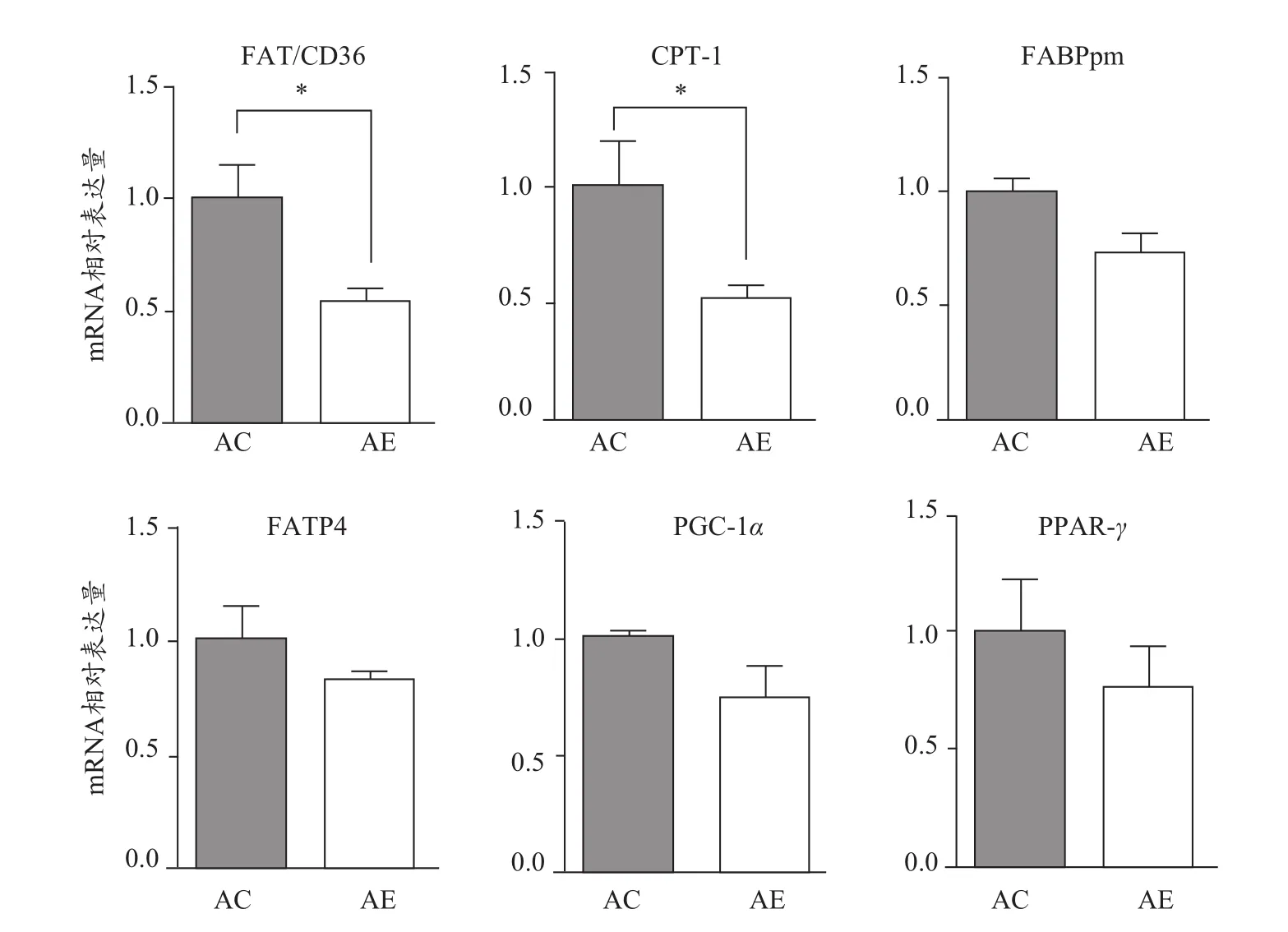
图6 运动对老年小鼠骨骼肌脂肪酸转运载体mRNA表达水平的影响Figure 6. Effect of Exercise on mRNAExpression Levels of FattyAcid Transporters in the Skeletal Muscle ofAged Mice
2.7 运动对老年小鼠骨骼肌FAT/CD36蛋白表达水平的影响
与AC组相比,AE组小鼠骨骼肌FAT/CD36的蛋白表达水平显著减少(P<0.05,图7),说明运动能显著降低老年小鼠骨骼肌FAT/CD36的蛋白表达水平。
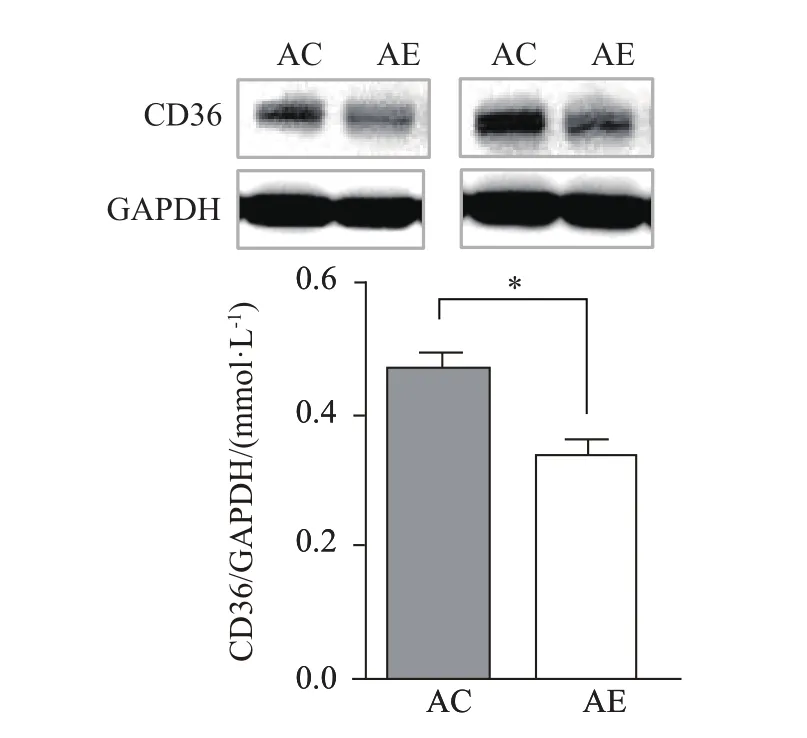
图7 运动对老年小鼠骨骼肌FAT/CD36蛋白表达水平的影响Figure 7. Effect of Exercise on FAT/CD36 Protein Expression Levels in the Skeletal Muscle ofAged Mice
2.8 运动对老年小鼠骨骼肌FAT/CD36转位功能的影响
小鼠骨骼肌组织CD36/Caveolin-1免疫荧光双标检测结果显示(图8),FAT/CD36被标记为绿色荧光,Caveolin-1被标记为红色荧光,二者的共定位重叠区域为黄色,细胞核被DAPI标记为蓝色。与AC组相比,AE组FAT/CD36绿色荧光强度显著减少(P<0.05),说明运动能减少老年小鼠骨骼肌FAT/CD36的蛋白表达水平;AC组显示,黄色共定位区域明显,说明FAT/CD36存在于细胞膜脂筏中;与AC组相比,AE组黄色共定位程度进一步增加,说明运动能够进一步诱导老年小鼠骨骼肌FAT/CD36向细胞膜转位,并定位于细胞膜脂筏中。
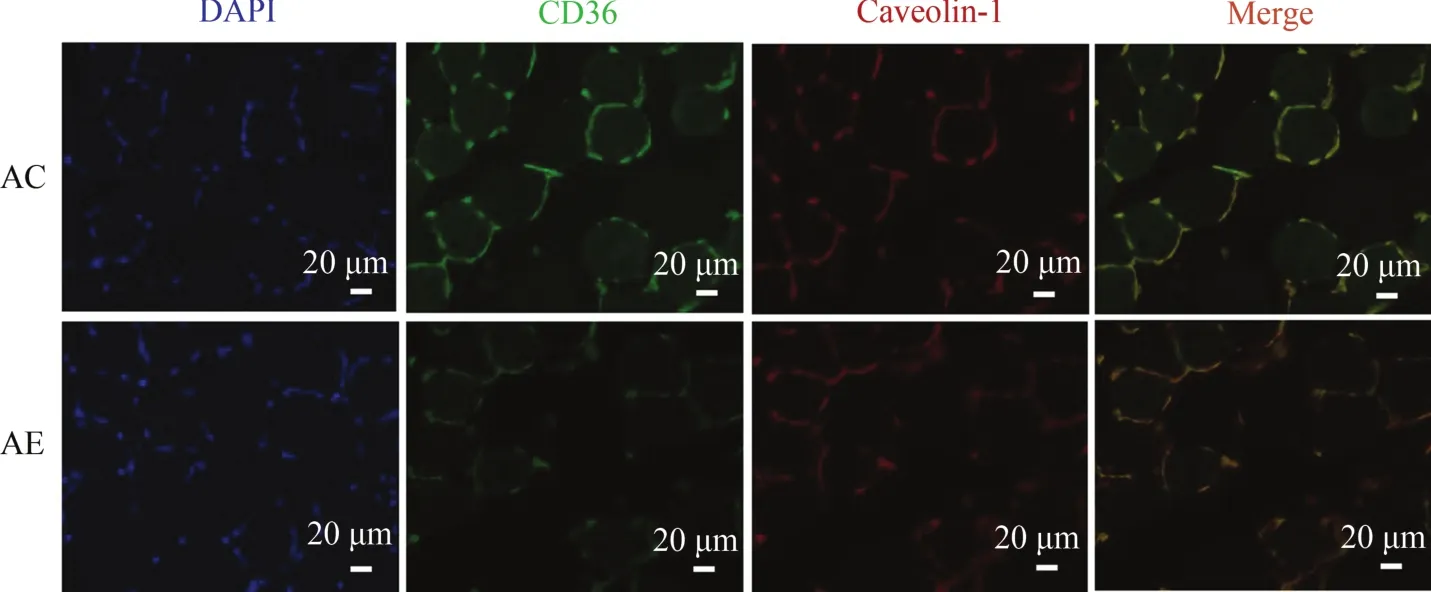
图8 运动诱导老年小鼠骨骼肌FAT/CD36向细胞膜转位Figure 8. Exercise Induced FAT/CD36 Trafficking to Plasma Membrane in the Skeletal Muscle ofAged Mice
2.9 运动未能诱导老年小鼠骨骼肌FAT/CD36向线粒体膜转位
小鼠骨骼肌组织CD36/VDAC免疫荧光双标检测结果显示(图9),FAT/CD36被标记为绿色荧光,VDAC被标记为红色荧光,二者的共定位重叠区域为黄色,细胞核被DAPI标记为蓝色。AC组显示,黄色共定位区域不明显,说明FAT/CD36不存在于线粒体膜上;与AC组相比,AE组黄色共定位程度未有明显改变,说明运动干预亦未能诱导老年小鼠骨骼肌FAT/CD36向线粒体膜转位。
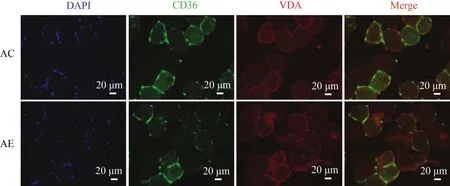
图9 运动未诱导老年小鼠骨骼肌FAT/CD36向线粒体膜转位Figure 9. Effect of Exercise Induced FAT/CD36 Trafficking to Mitochondrial Membrane in the Skeletal Muscle ofAged Mice
3 分析与讨论
3.1 运动对老年小鼠骨骼肌胰岛素敏感性的改善作用
胰岛素抵抗是许多衰老相关疾病的独立危险因素,如2型糖尿病、高血压、动脉粥样硬化等。骨骼肌是人体摄取和利用葡萄糖最重要的组织。随着年龄的增长,骨骼肌的质量和功能出现衰退,导致胰岛素抵抗的发生。因此,提高老年人骨骼肌胰岛素敏感性是预防衰老相关疾病的重要措施。然而,除了运动干预之外,目前尚未有成熟的骨骼肌衰退治疗方法。本研究结果显示,中等强度运动训练能显著改善老年小鼠血糖、血脂及骨骼肌胰岛素敏感性。
衰老导致过量脂肪酸流入骨骼肌细胞,脂肪酸在骨骼肌细胞内的过量沉积,导致骨骼肌脂肪酸氧化能力下降,线粒体生物合成发生障碍,线粒体功能损伤,慢肌纤维向快肌纤维转变增多以及肌萎缩等变化,这些变化均与骨骼肌脂肪酸代谢紊乱有关,最终引起胰岛素抵抗的发生(Oseph et al.,2012)。传统观点认为,外源性脂肪酸通过自由扩散的方式实现向骨骼肌细胞内的转运;然而近年来研究发现,一些膜蛋白,如FAT/CD36、FABPpm及FATPs在协助脂肪酸跨过细胞膜,向细胞膜内转运过程中起到了重要作用(Glatz et al.,2010)。尤其是FAT/CD36与骨骼肌细胞内脂肪酸的异位沉积关系密切(Bonen et al.,2004)。有研究结果表明,外源性脂肪酸通过激活FAT/CD36的转位机制,对骨骼肌细胞内的脂肪酸摄取与氧化平衡起到了重要的调控作用(Samovski et al.,2015)。然而,静息状态下FAT/CD36可能不是最为重要的脂肪酸转运载体,CPT-1可能更为重要;在运动等能量需求较大时,与其他脂肪酸转运载体相比,FAT/CD36对骨骼肌脂肪酸代谢的调控作用更为明显(Holloway et al.,2009)。因此,本研究着重探讨FAT/CD36在运动改善老年小鼠骨骼肌胰岛素敏感性中的作用及作用机制。
3.2 FAT/CD36蛋白表达水平在运动改善老年小鼠骨骼肌胰岛素敏感性中的作用
研究显示,胰岛素抵抗骨骼肌中FAT/CD36的表达水平显著增加(Bonen et al.,2004),而运动训练对骨骼肌FAT/CD36表达水平的改变呈现多元化的调控。有研究显示,6周高强度间歇训练能显著增加骨骼肌细胞FAT/CD36总蛋白表达水平(Talanian et al.,2010)。Kiens等(2004)发现,长期耐力训练并不能增加人类股外侧肌FAT/CD36总蛋白表达水平。这可能是因为FAT/CD36对运动的适应性变化,主要表现在FAT/CD36向细胞膜的转位机制,而非总蛋白水平上的改变。另外,运动诱导的骨骼肌FAT/CD36总蛋白表达水平的变化可能存在时效性及运动干预方式上的差异,特别是在运动适应的初期,FAT/CD36诱导的骨骼肌脂肪酸调控机制较为复杂。骨骼肌FAT/CD36蛋白表达水平的增加可能是对运动训练初期的一个暂时性的适应过程。随着运动时间的延长,这种适应过程可能逐渐消失。本研究结果显示,中等强度运动训练显著降低了老年小鼠骨骼肌组织FAT/CD36及CPT-1的mRNA表达,然而FABPpm及FATP4脂肪酸转运载体的mRNA表达水平未见显著性变化。该结果与Palacios等(2009)研究相一致,说明了与其他脂肪酸转运载体相比,FAT/CD36及CPT-1在运动改善骨骼肌胰岛素敏感性中可能发挥了重要的调控作用。另外,与FAT/CD36 mRNA表达水平变化相一致,16周中等强度运动训练显著降低了胰岛素抵抗骨骼肌组织FAT/CD36的蛋白表达水平。
PGC-1α含量的增加不仅能够诱导线粒体的生物发生,促进脂肪酸氧化代谢,还可以增加FAT/CD36的含量(Benton et al.,2010)。本研究结果显示,16周中等强度运动训练能够显著降低老年小鼠骨骼肌组织FAT/CD36的含量,但未能降低PGC-1α及PPARγ的mRNA表达水平,说明运动诱导的衰老小鼠骨骼肌FAT/CD36表达水平的变化可能不完全通过PGC-1α及PPARγ转录因子的调控。其他途径对老年小鼠骨骼肌FAT/CD36表达水平的调控机制,需要进一步研究。
3.3 FAT/CD36转位在运动改善老年小鼠骨骼肌胰岛素敏感性中的作用
FAT/CD36普遍分布于骨骼肌细胞膜及胞质储存囊泡中。研究显示,机械收缩或胰岛素刺激均能诱导细胞膜FAT/CD36含量的增加,而骨骼肌细胞内FAT/CD36总蛋白含量并没有增加(Koonen et al.,2005)。由此推测,FAT/CD36在细胞膜和胞浆储存体内可能是以循环的形式存在。当FAT/CD36的胞内转位机制发生障碍时,细胞膜上的FAT/CD36便无法正常回收至胞质储存囊泡,导致过量外源性脂肪酸的摄入,从而导致了骨骼肌脂肪酸代谢异常(Bonen et al.,2004)。但是对于FAT/CD36是否存在于线粒体膜上,尚存争议。Lopaschuk等(2010)认为,FAT/CD36存在于线粒体膜上,并通过调节脂肪酸进入线粒体的数量,对脂肪酸氧化代谢进行调控。Holloway等(2007)认为,FAT/CD36既不存在于线粒体膜上,又不能通过调节脂肪酸进入线粒体的数量来对脂肪酸氧化进行调控。本研究结果显示,FAT/CD36高表达于老年小鼠骨骼肌细胞膜中,而线粒体膜上未见表达。进一步研究发现,FAT/CD36向细胞膜的转位功能是运动过程中脂肪酸氧化代谢调节的重要机制(Mcfarlan et al.,2012)。本研究结果与该结论相一致,即16周有氧运动能够进一步诱导老年小鼠骨骼肌FAT/CD36向细胞膜的转位,然而运动未能诱导老年小鼠骨骼肌FAT/CD36向线粒体膜的转位。这可能是因为运动过程中需要大量的能量供应,外源性LCFA可以为骨骼肌收缩提供能量底物,而FAT/CD36可能主要在LCFA进入骨骼肌细胞膜过程中起到重要作用,在LCFA进入线粒体膜过程中的作用不如其他脂肪酸转运蛋白,如FABPpm、CPT-1等。
3.4 FAT/CD36向细胞膜脂筏上的定位在运动改善老年小鼠骨骼肌胰岛素敏感性中的作用
衰老诱导的胰岛素抵抗伴有胰岛素信号通路上的多个分子表达或活化水平的异常,如胰岛素与受体的结合能力下降、胰岛素受体、胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)的酪氨酸磷酸化以及磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI-3K)活化水平下降等,这些均被认为是衰老诱导骨骼肌胰岛素抵抗发生的可能机制。但是,目前对胰岛素信号通路分子表达或活化水平改变的上游机制尚不清楚。随着脂筏的发现,人们开始关注小GTP结合蛋白Rab GTPases在胰岛素抵抗中的作用。脂筏是细胞膜上含有特殊脂质及特殊蛋白质的微结构域(microdomains)。有研究证明,脂肪酸的跨膜转运离不开脂筏结构域(Ehehalt et al.,2006),这就为探讨有氧运动改善胰岛素敏感性的作用机制提供了一个新视角。
小窝是脂质膜上直径约为50~100 nm的囊泡凹陷结构,在上皮细胞、脂肪细胞和肌细胞的细胞膜上表达丰富(Lo et al.,2015)。脂筏、小窝能够通过聚集某些转运蛋白,如葡萄糖、胆固醇转运蛋白,来调控营养物质的摄取(Ortegren et al.,2007)。研究显示,相关的长链脂肪酸转运蛋白与脂筏、小窝结构关系密切(Ehehalt et al.,2006)。因此,推测小窝蛋白可能参与了FAT/CD36在细胞膜上的定位及功能。FAT/CD36只有锚定在细胞膜表面的脂筏微结构域内,并与小窝蛋白共同作用,才能对脂肪酸的摄取进行调控(Ehehalt et al.2008);若在回收过程中,FAT/CD36未能正确定位于脂筏和/或小窝中,可能会影响脂肪酸的摄取及转运。然而,运动能否诱导衰老小鼠骨骼肌FAT/CD36向细胞膜脂筏和/或小窝上的正确定位,尚不清楚。本研究结果显示,运动能够诱导衰老小鼠骨骼肌FAT/CD36向细胞膜转位并准确定位于细胞膜上的脂筏中。脂筏被看作是一个信号募集、发生、转导的平台,含有多种信号分子(Philip et al.,2007)。因此,本研究结果进一步说明了运动可能通过增加FAT/CD36在细胞膜脂筏上的定位,增强了FAT/CD36与下游信号分子的相互作用,如Src家族蛋白激酶(Fyn、Lyn和Yes)(Yamada et al.,2010),从而激活了相关胰岛素信号通路,进而对衰老诱导的骨骼肌胰岛素敏感性进行调控。在今后的研究中,可以选取运动初期、运动中期以及运动末期等多个时间点,从而可以更清晰地反映出FAT/CD36的表达及转位功能在运动适应中的变化趋势,进一步说明FAT/CD36在运动防治衰老诱导的骨骼肌胰岛素抵抗中的靶点价值。
4 结论
FAT/CD36在调节骨骼肌胰岛素信号通路中具有重要作用,并且运动可能通过减少FAT/CD36的表达、增加向细胞膜脂筏转位的双重作用,激活AKT/ERK信号通路,从而改善衰老诱导的骨骼肌胰岛素敏感性下降(图10)。
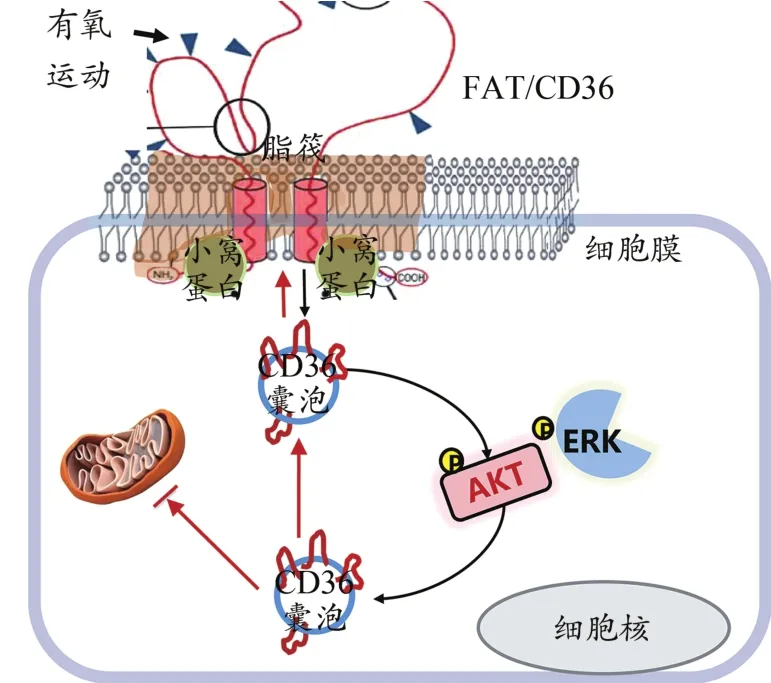
图10 FAT/CD36在运动改善衰老骨骼肌胰岛素敏感性中的作用及可能机制Figure 10. The Role of FAT/CD36 in Improving Insulin Sensitivity of Skeletal Muscle inAged Mice by Exercise
