不同家系凡纳滨对虾对低盐度的适应能力及其适应机理
2021-04-01胡利华刘广绪付万冬廖妙飞黄贤克罗吴佳燕闫茂仓
胡利华 施 巍 刘广绪 付万冬 廖妙飞 黄贤克罗 奎 吴佳燕 闫茂仓
(1.浙江省海洋水产养殖研究所, 浙江省近岸水域生物资源开发与保护重点实验室, 温州市海洋生物遗传育种重点实验室,温州 325005; 2.浙江大学动物科学学院, 杭州 310058; 3.浙江省海洋开发研究院, 舟山 316021)
凡纳滨对虾(Litopenaeus vannamei), 又称南美白对虾, 广泛分布于太平洋沿岸水域, 具有生长快、适应力强和出肉率高等特点, 是世界上最重要的水产养殖品种之一[1,2]。自20世纪80年代末成功引入我国以来, 凡纳滨对虾养殖迅猛发展, 已成为我国对虾的主要养殖品种之一, 据统计目前我国凡纳滨对虾产量已占全世界总产量的约40%[3]。由于凡纳滨对虾对盐度的适应范围较广, 且众多养殖者认为低盐度养殖可以有效控制虾病的暴发, 因而生产实践中越来越多地采用低盐乃至淡水养殖凡纳滨对虾[4]。调查结果显示, 目前浙江低盐及淡水养殖凡纳滨对虾的产量甚至已超过其海水养殖产量[5]。在此情况下, 养殖水体盐度对凡纳滨对虾生长和存活的影响在近年来越来越受到人们的广泛关注。但目前关于凡纳滨对虾盐度适应的研究结果却存在一定争议。例如, Laramore等[6]的研究指出30‰为凡纳滨对虾最适生长盐度, 但Ogle等[7]却认为其最适生长盐度为4‰—8‰。造成这一现象的原因可能是由于不同遗传背景的凡纳滨对虾在对盐度的适应能力上具有明显的差异[8]。因此深入探究不同凡纳滨对虾家系对不同盐度的适应情况及其适应机理, 进而选育适合低盐和淡水养殖的凡纳滨对虾, 对选育适合低盐和淡水养殖的南美白对虾新品系(种)具有重要的实际应用价值和理论指导意义。
研究表明维持正常的生理代谢水平在对虾适应盐度变化的过程中发挥着重要作用[9]。在低盐或高盐度水体中, 对虾需要消耗体内储存的能量以维持机体的离子浓度和渗透压水平, 因此对虾的生理代谢或能量供给在低盐水体中受到抑制, 有可能是其导致生长率及存活率下降的原因[9,10]。鳃是水生甲壳类动物进行渗透压调节及离子交换的主要器官和重要场所, Na+/K+-ATP酶(Na+/K+-ATPase)位于鳃细胞表面, 是水生甲壳类动物渗透压调节过程中Na+和K+的跨膜运输泵[11]。此外, Ca2+是生物生长发育等诸多生命过程中的关键信号分子, 在渗透压调节过程中Ca2+也起着维持机体离子浓度的重要作用[12]。Ca2+-ATP酶(Ca2+-ATPase)是一种重要的离子调节酶, 其为机体渗透压调节过程中Na+和Ca2+的交换提供了动力[13,14]。因此, Ca2+-ATPase和Na+/K+-ATPase活力很可能也决定了对虾对盐度变化的适应能力。但到目前为止, 不同对虾家系间这些离子调节酶活力是否存在差异尚不知晓。此外,根据报道, 在环境胁迫的条件下(如水体盐度、酸碱度变化和重金属污染), 海洋生物将更多的机体能量用于应对环境压力, 减少在生长、免疫和毒物代谢等生理过程中的能量消耗[15,16]。皮质醇激素是水生生物应激反应过程中产生的一种类激素, 急性及慢性应激反应都可以造成其在血浆中浓度的变化, 因此也常被用于衡量包括对虾在内多种水生生物所受应激强度的重要指标[17,18]。
为了探究不同凡纳滨对虾家系对盐度变化的适应能力, 本研究比较了30个凡纳滨对虾家系在3个不同盐度水体(5‰、20‰和30‰)中的生长性能和存活率。由于机体的能量供给为水生甲壳类动物渗透压调节提供了动力, 本研究对比分析了各盐度条件下不同家系间生理代谢、ATP含量及ATP合成关键酶酶活力的差异, 以期判断对虾能量代谢水平是否影响了其对不同盐度的适应。此外, 本研究检测了不同家系凡纳滨对虾鳃Na+/K+-ATPase及Ca2+-ATPase酶活水平, 以分析不同家系对虾离子转运能力的差异及其与盐度适应性之间的关系。最后, 本研究以血浆中皮质醇浓度为指标, 对比分析了不同盐度下不同对虾家系的机体应激水平, 以探究机体应激与盐度适应之间的内在关系。本研究获得的相关结果, 将有助于筛选凡纳滨对虾盐度适应性生理指标, 并为对虾养殖产业合理选择淡化驯养家系奠定了理论基础。
1 材料与方法
1.1 实验材料
实验在浙江省海洋水产养殖研究所清江基地进行, 海水取自乐清湾海区[盐度为(18.5±0.6)‰],在蓄水塘二级砂滤后, 经海水浓缩装置(杭州帕尔水处理科技有限公司)处理后获得盐度为(29.9±0.4)‰的浓缩海水。本实验所用盐度为5‰和20‰的海水是利用浓缩海水和淡水调配获得。2016年通过引入厄瓜多尔、美国、泰国、中国等国内外凡纳滨对虾群体, 采用不完全双列杂交方式组合构建基础群体, 2017年构建F1育种核心群体, 采用BLUP(Best line unbiased prediction)方法进行遗传评估, 在控制近交的情况下, 2018年利用人工定向交尾技术, 通过巢式交配设计构建F2家系103个。家系构建与标准化培育参照已报道的方法[19]。在第五、第六腹节左、背、右3个部位注射2—3种不同颜色(红、橙、蓝、绿)组合的荧光染料标记和区分家系。利用SPSS19.0软件对荧光标记时的103个家系的体重进行方差分析, 挑选30个差异不显著的家系(P<0.05)作为实验材料(编号范围6002—6050), 体重(1.61±0.68) g, 在室内养殖池(长5 m×宽4 m×高1.5 m)暂养[水温(29.2±0.5)℃, pH 8.2±0.1, 盐度30‰]。暂养期间投喂体质量15%的正大牌对虾配合饲料, 分6:00、14:00和22:00三次投喂, 每天吸污清理残饵和虾壳。
1.2 实验设计
凡纳滨对虾经5d暂养后, 从每个家系中各挑选108尾大小相近的对虾[体长(5.48±0.38) cm, 体重(2.17±0.38) g]用于本次实验。本实验共设置了2个低盐度实验组(盐度为5‰和20‰)和一个对照组(盐度为30‰)。实验在室内养殖池中进行(长5 m×宽4 m×高1.5 m), 每个养殖池中放置每个家系对虾12尾(共计30家系×12尾=360尾), 实验设置3个平行重复(共9个养殖池), 处理时间持续30d。记录各家系对虾的初始体重用于后续生长率的计算。在进行盐度梯度养殖实验前, 需要将实验用虾进行淡化驯养, 即从原始水体盐度(30‰)开始, 每天降低5个盐度, 逐步达到目标盐度并稳定2d以避免对虾的应激反应对实验结果的影响。实验期间每天分3次投喂体质量15%的正大牌对虾饲料, 每4天换水100%并清理残饵、虾壳和死虾, 全程不间断充气增氧,自然光照。实验过程中水体理化参数如表1所示。
1.3 生长率和存活率计算
实验结束前24h停止投喂, 在实验结束后统计每个实验组中每个家系对虾的存活数量, 按下述公式计算对虾的存活率(Survival rate %), 其中Nt和N0分别为实验结束和开始时对虾的数目。


表1 对照组与实验组的海水理化参数值(均值±标准误)Tab.1 Seawater chemistry parameters of the control and experiment groups (Mean±SE)
同时, 在实验结束时从每个池中取各家系对虾,擦干对虾体表水分后, 使用电子天平(BSA3202S,赛多利斯)称量各实验组中各家系对虾体重(精确至0.01 g), 随后按以下公式计算其特定生长率(Specific growth rate,SGR), 式中W2和W1分别为实验结束与开始时对虾的湿重,T为本实验的持续时间(30d)。
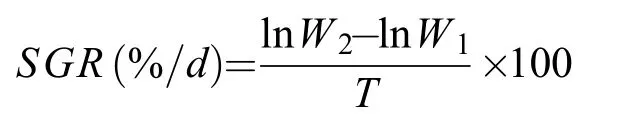
为了对30个对虾家系在不同盐度条件下的生长情况进行比较, 参考已报道的方法[7], 本研究将每个盐度梯度下对虾的特定生长率与存活率相乘, 计算出30个对虾家系各组评分, 将3种盐度下各家系评分相加用以比较各家系盐度适应能力, 据此筛选出盐度适应能力最强与最弱的各2个家系以进行后续实验。
1.4 耗氧率和排氨率的测定
从筛选得到的适应性最强与最弱的4个家系中各取对虾6尾(6个重复)对其进行耗氧率和排氨率的测定。实验设6个重复组和一个空白对照组, 以2 L广口瓶为呼吸瓶, 每瓶中放置一尾对虾(实验前已禁食24h), 随后立即用插有进水管和出水管的瓶盖密封, 实验持续2h, 实验温度为29.1℃。实验结束时取水样测定溶解氧与氨氮含量, 将对虾擦干于电子天平上称取湿重。根据之前报道的研究方法[20], 分别通过多参数水质分析仪(Multi 3410 SET4, WTW)和次溴酸钠氧化法对实验水体中的溶解氧和氨氮浓度进行测定。
1.5 对虾肌肉ATP含量及丙酮酸激酶酶活测定
适应性最强与最弱的4个家系中各取6尾对虾,于冰上解剖取对虾尾部肌肉组织, 每尾取1 g肌肉组织, 小心匀浆后用于ATP含量测定及丙酮酸激酶酶活测定。此外, 解剖对虾取其鳃组织, 用作后续Ca2+-ATPase及Na+/K+-ATPase酶活测定[13,20]; 从对虾的围心腔中取血液用于皮质醇浓度分析[18]。组织匀浆的蛋白浓度使用Bradford蛋白浓度测定试剂盒(P0006, 碧云天)进行检测。在本实验中, 根据ATP含量测定试剂盒(A095-1, 南京建成)说明书所述方法, 利用分光光度计(UV-2100, 上海菁华)测量样品在636 nm波长处0.5 cm光径的吸光度值, 按照以下公式计算得到对虾肌肉组织的ATP浓度(μmol/g prot)。参考之前的方法[20], 使用丙酮酸激酶测定试剂盒(A076-1, 南京建成)检测对虾肌肉组织丙酮酸激酶(PK)活力。
1.6 对虾鳃Ca2+-ATPase及Na+/K+-ATPase酶活测定
对虾鳃组织小心匀浆后, 使用超微量的Ca2+-ATPase酶测定试剂盒(A070-4, 南京建成)检测组织样品的Ca2+-ATPase酶活力[20]。按试剂盒说明书所述方法加样后, 使用分光光度计(UV-2100, 上海菁华)测量样品在636 nm波长处0.5 cm光径的吸光值(OD值), 进而按照以下公式计算得到Ca2+-ATPase酶活值。

使用超微量Na+/K+-ATP酶测定试剂盒(A070-2-2, 南京建成)对鳃组织的Na+/K+-ATPase活力进行测定[13]。按试剂盒要求加样后静置5min, 测量样品在636 nm波长处1 cm光径的吸光值。将每小时每毫克细胞蛋白ATP 酶分解 ATP 产生1 μmol无机磷的量定义为一个 ATP 酶活力单位, 即μmol磷/(mg protein·h)(UATPase), 按以下公式计算得到Na+/K+-ATPase酶活力。

1.7 对虾血浆皮质醇含量测定
对虾血浆皮质醇含量使用皮质醇ELISA检测试剂盒(ml024863, 上海酶联)进行测定[18]。在实验中使用含有0.5 mL预冷抗凝剂的1 mL预冷注射器, 从对虾的围心腔中采血。取得血液后, 将血淋巴离心10min(4℃, 1000 r/min), 取上清即无细胞血浆用以测定皮质醇含量。按试剂盒所述步骤在96孔板内加样完成后, 使用酶标仪(Multiskan GO, Thermo)检测各样品在450 nm处的吸光值。通过将所测吸光度值代入标准曲线计算得到血浆皮质醇含量。
1.8 数据统计与分析
分别利用Levene检验和Shapiro-Wilk检验对数据的方差齐性和正态性进行检验, 对不符合的数据进行平方根反正弦变换以满足相关统计分析要求。利用单因素方差分析(One-way ANOVA)检验不同盐度条件下不同凡纳滨对虾家系间的耗氧率、排氨率、机体ATP含量、丙酮酸激酶酶活、Na+/K+-ATPase酶活、Ca2+-ATPase酶活和血浆皮质醇含量差异。并通过Tukey检验(Post-hoc Tukey tests)进行多重比对, 明确组间的显著性差异。所有统计分析均在R统计分析软件(R Development Core Team, 2012)中进行, 采用P<0.05 作为显著性判断标准。
2 结果
2.1 不同盐度条件下各家系对虾的生长率、存活率和评分
从表2中可以看出, 总体而言30个对虾家系的总特定生长率随着盐度的下降而显著降低(P<0.05), 但每个家系的对虾在不同盐度条件下的表现具有差异。部分家系(如家系6010)的对虾在不同盐度条件下生长率并无显著差异(P>0.05)。此外, 水体盐度为5‰时, 各家系对虾的存活率均显著低于饲养于高盐度水体时的存活率。根据总评分可见, 此次实验所选用的30个对虾家系中, 盐度适应能力最强的两个家系为家系6016和6022, 盐度适应能力最差的两个家系为家系6039和6040。
2.2 不同盐度条件下不同家系的耗氧率和排氨率
当水体盐度为30‰时, 家系6016和6022对虾的耗氧率显著高于家系6039和6040(P<0.05)。在养殖水体盐度为20‰和5‰时, 家系6016对虾的耗氧率和排氨率均显著高于家系6039和6040(图1,P<0.05)。从图1中可以看出, 4个家系对虾的耗氧率随着盐度的降低均显著降低(P<0.05)。20‰盐度组家系6016和6022的排氨率显著低于30‰盐度组, 但当盐度为5‰时, 家系6016和6022的排氨率较30‰盐度组显著升高(P<0.05)。然而, 家系6039和6040对虾的排氨率在盐度为5‰时较30‰和20‰显著下降(P<0.05)。

表2 不同盐度条件下30个凡纳滨对虾家系的生长率和存活率(均值±标准误)突出显示部分加注英文Tab.2 The growth and survival rates of 30 families of Litopenaeus vannamei under different salinity conditions (Mean±SE)

图1 不同盐度条件下四个家系凡纳滨对虾的(A)耗氧率和(B)排氨率(均值±标准误)Fig.1 Respiration rates (A) and ammonium excretion rates (B) of Litopenaeus vannamei from 4 families possessing the highest and the lowest salinity adaptive ability at salinity of 5‰, 20‰, and 30‰ (Mean±SE)
2.3 不同盐度条件下不同家系对虾肌肉ATP含量和丙酮酸激酶酶活力
从图2中可以看出, 4个家系的对虾肌肉ATP含量随着盐度的下降均显著降低(P<0.05)。在3个盐度水平中, 家系6016和6022对虾肌肉组织的ATP含量都显著高于家系6039和6040(P<0.05)。与此同时, 家系6016和6022对虾肌肉中丙酮酸激酶酶活力也显著高于家系6039和6040(P<0.05)。在盐度为5‰时, 家系6016和6022对虾肌肉组织的丙酮酸激酶酶活力相比较高盐度组有显著升高(P<0.05, 图3)。
2.4 不同盐度条件下不同家系对虾鳃Ca2+-ATPase和Na+/K+-ATPase酶活
从图4可以看出, 不同家系凡纳滨对虾鳃Ca2+-ATPase和Na+/K+-ATPase酶活在盐度为30‰时并无显著性家系差异(P>0.05)。但当盐度降至5‰时, 家系6012和6022对虾鳃Ca2+-ATPase和Na+/K+-ATPase酶活水平显著高于家系6039和6040(P<0.05)。此外, 4个家系对虾鳃Ca2+-ATPase酶活水平在盐度为5‰时较30‰显著升高(P<0.05)。
2.5 不同盐度条件下不同家系对虾血浆皮质醇浓度

图2 不同盐度条件下四个家系凡纳滨对虾肌肉ATP含量(均值±标准误)Fig.2 ATP contents in the muscle of Litopenaeus vannamei from 4 families possessing the highest and the lowest salinity adaptive ability at salinity of 5‰, 20‰, and 30‰ (Mean±SE)
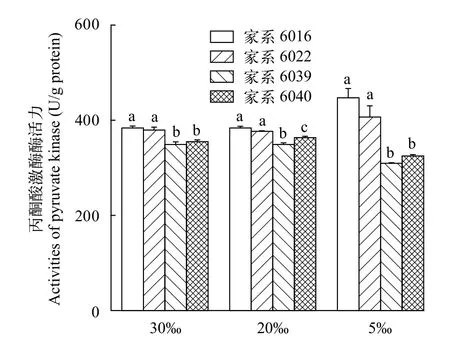
图3 不同盐度条件下四个家系凡纳滨对虾肌肉丙酮酸激酶酶活力(均值±标准误)Fig.3 Activities of pyruvate kinase in the muscle of Litopenaeus vannamei from 4 families possessing the highest and the lowest salinity adaptive ability at salinity of 5‰, 20‰, and 30‰ (Mean±SE)

图4 不同盐度条件下四个家系凡纳滨对虾鳃(A)Ca2+-ATPase和(B)Na+/K+-ATPase酶活力(均值±标准误)Fig.4 Activities of Ca2+-ATPase (A) and Na+/K+-ATPase (B) in the gill of Litopenaeus vannamei from 4 families possessing the highest and the lowest salinity adaptive ability at salinity of 5‰,20‰, and 30‰ (Mean±SE)

图5 不同盐度条件下4个家系凡纳滨对虾血浆皮质醇浓度(均值±标准误)Fig.5 Plasma cortisol concentrations of Litopenaeus vannamei from 4 families possessing the highest and the lowest salinity adaptive ability at salinity of 5‰, 20‰, and 30‰ (Mean±SE)
从图5可以看出, 在养殖水体盐度为30‰和20‰时, 4个家系对虾血浆皮质醇没有显著性家系间差异(P>0.05)。但当盐度降至5‰时, 家系6036和6039对虾血细胞内皮质醇浓度显著高于另外2个家系(P<0.05)。此外, 家系6016和6022血液中皮质醇浓度在3个盐度水体中并无显著差异(P>0.05), 而家系6039和6040的血浆皮质醇浓度显著高于其在30‰和20‰时的浓度(P<0.05)。
3 讨论
3.1 不同凡纳滨对虾家系对盐度的适应能力
尽管凡纳滨对虾是一种广盐性(2‰—40‰)虾类, 但养殖水体的盐度仍是影响凡纳滨对虾生长性能的重要因素, 凡纳滨对虾对不同盐度条件下的适应性也吸引了海内外学者的广泛关注[21—23]。本研究对比了30个凡纳滨对虾家系在3个盐度下(5‰、20‰和30‰)的特定生长率和存活率, 结果表明不同遗传背景的凡纳滨对虾在不同盐度条件下的生长性能和适应能力存在显著差异, 这可能是由于不同家系对环境变化的适应能力与不同遗传背景家系的取食、行为竞争相关, 取食、行为竞争能力强的家系更能在相同环境条件下表现出更具优势的生长、存活等目标性状。研究结果进一步显示, 家系6016和6022相比6039和6040表现出了更好的适应能力, 家系6016和6022构建的父母本中均有来自厄瓜多尔自然群体的种虾, 一方面其遗传多样性显著高于家系6039和6040父母本(养殖群体), 另一方面, 未经驯化的自然群体的取食和行为竞争可能比养殖群体更具优势, 因此凡纳滨对虾对盐度的适应性与遗传背景密切相关。而造成这一现象的原因很可能是不同家系凡纳滨对虾的能量代谢水平和渗透压调节能力有所不同。
3.2 血浆皮质醇浓度对低盐适应能力的影响
无论是在哺乳动物或是水生无脊椎动物中, 血浆皮质醇激素含量都被用作衡量机体应对环境变化能力的重要指标[17]。在本次研究中, 家系6039和6040两组对虾的血浆皮质醇浓度在水体盐度为5‰时显著高于另外两组, 说明这两组对虾在经30d饲养后仍不能适应低盐的水体条件。此外, 皮质醇也是调节机体代谢的重要激素, 皮质醇升高也会导致机体组织对能量的利用率降低[24,25]。因此,家系6039和6040两组对虾血浆皮质醇浓度升高也可能是导致其在低盐条件下生长率和存活率降低的重要原因。
3.3 Ca2+-ATPase和Na+/K+-ATPase酶活对低盐适应能力的影响
由于海水的盐度一直处于动态变化之中, 海洋中的无脊椎动物就需要通过多种方式维持体内的渗透压稳定[26,27]。例如, 当水域盐度降低时, 对虾可以通过外排Na+、Cl-等离子和分解氨基酸使体内的渗透压降低以保证细胞和体液的渗透压相对平衡[28]。在此过程中, 离子的转运主要是通过位于鳃内薄层隔膜细胞内的Na+/K+-ATP酶和Ca2+-ATP酶等多种离子转运酶来完成[29]。例如丁森等[30]研究发现, 中国明对虾(Fenneropenaeus chinensis)在水体盐度为15‰时的机体Na+/K+-ATP酶活力显著低于其在盐度为5‰时的水平。与之类似, 本研究发现当海水盐度下降至5‰时, 家系6016和6022组对虾鳃细胞内的Na+/K+-ATP酶和Ca2+-ATP酶活力较盐度为30‰和20‰时显著上升。而家系6039和6040对虾鳃的Na+/K+-ATP酶和Ca2+-ATP酶活力则显著低于更适应盐度变化的两个家系, 较低的相应酶活力水平会限制对虾在低盐环境下的渗透压调节能力, 这也可能是造成家系6039和6040对虾盐度适应能力差的重要原因。
3.4 ATP含量和丙酮酸激酶酶活力对低盐适应能力的影响
除此之外, 生物体内离子的转运是一个耗能的过程, 机体代谢水平降低或是ATP合成不足都将削弱对虾机体在低盐环境中的离子外排能力[31,32]。在本研究中, 所有4个家系对虾机体ATP含量均随着水体盐度的下降而显著降低。这是因为当海洋无脊椎动物的体液在等渗点时, 机体维持渗透压所需能量较少, 但当外界环境盐度过低时, 机体就需要消耗体内的ATP并同时提高机体能量合成及机体代谢水平以稳定渗透压[32—34]。本研究中家系6016和6022对虾的代谢水平在低盐度条件下显著升高, ATP合成关键酶丙酮酸激酶酶活也显著上调,但家系6039和6040对虾机体的丙酮酸激酶酶活在3个不同盐度环境下未有显著变化, 这可能是导致该两组对虾体内ATP含量相对较低的原因, 这也进一步限制了其在低盐度条件下的渗透压调节。
综上所述, 本研究表明不同遗传背景的对虾对盐度的适应能力不同, 这可能主要是由其机体代谢、离子转运及能量合成能力所决定。
