植物多酚与肠道微生物群的相互作用及其对代谢性疾病影响的研究进展
2021-03-31宋泽和
赵 媚,常 凌,宋泽和,贺 喜
(湖南农业大学动物科学技术学院,饲料安全与高效利用教育部工程研究中心,湖南家禽安全生产工程技术研究中心,湖南畜禽安全生产协同创新中心,湖南 长沙 410128)
据统计,到2 0 3 5 年,代谢综合征(m e t a b o l i c syndrome,MetS)的患病率将会增加到53%[1],如何有效地控制MetS已经成为一个世界性的热点问题。MetS是多种代谢紊乱的集合,如高血糖、胰岛素抵抗、氧化应激、高血压、血脂异常等。MetS的发展最终会导致肥胖、炎症、肝病、肾病、糖尿病、心肌病、骨关节炎和神经变性等代谢性疾病的发生[2]。
肠道微生物群是动物机体消化、代谢和维生素合成等生理功能的重要组成部分。代谢性疾病可以改变肠道微生物群的组成和功能[3],相反,肠道微生物群通过能量的吸收、脂质和葡萄糖的代谢、肝脏和脂肪组织中脂肪的储存等途径来调节代谢紊乱[4-7]。但是目前尚不清楚是肠道微生物群的改变导致了代谢性疾病的发生,还是代谢性疾病导致肠道微生物群的变化[8]。
除了代谢性疾病的影响外,日粮饮食也是调节肠道微生物群组成和功能的一个重要因素[9-11]。高脂饮食可以减少微生物的多样性,增加致病菌的数量[12-13]。植物多酚可以刺激肠道中有益菌数量的增加,并抑制致病菌的增殖和扩散。植物多酚还可以通过抑制食欲、改善脂肪的代谢和抑制胰脂肪酶活性来调控机体体质量。同时,肠道微生物群能够将膳食多酚代谢成为简单化合物,具有更高的生物活性和吸收效率[14-16]。因此,本文主要以植物多酚和肠道微生物群为对象,综述两者之间的相互作用并探讨它们对代谢性疾病的影响。

表 1 植物多酚的特性、代谢和生物活性Table 1 Characteristics, metabolism and biological activity of plant polyphenols
1 植物多酚的分类
多酚是植物的次生代谢产物,广泛存在于水果、蔬菜以及植物衍生食品(如可可、巧克力、茶叶、咖啡以及葡萄酒等)中。基于多酚化学结构的复杂性,可以将其分为黄酮类化合物和非黄酮类化合物。黄酮类化合物又可分为6 个亚类:黄酮类、黄烷酮类、黄酮醇类、黄烷-3-醇类、花青素和异黄酮类。非黄酮类化合物相比黄酮类具有更多的亚类,包括酚酸、木脂素和二苯乙烯等[17]。
多酚一般通过与糖或有机酸结合的形式,或者以未结合的低聚物形式存在于食物中,约5%~10%的多酚(具有单体和二聚体结构)可能会被小肠直接吸收。释放的苷元可以通过被动扩散进入肠细胞。苷元吸收之后,先后在肠细胞和肝细胞中进行生物转化。如一些聚合物能够特异性地被α-鼠李糖苷酶、β-葡萄糖苷酶和β-葡萄糖醛酸酶等裂解成单体[18],完成第一阶段代谢;这些初步代谢后的酚酸被吸收之后,通过门静脉循环到达肝脏,经历第二阶段的转化:多酚苷元和酚酸与葡萄糖醛酸盐、硫酸盐和/或甲基部分进行结合,然后被分配到器官中并随尿液排出体外。此外,植物多酚的代谢和转化离不开结肠微生物菌群,这将会在下文详细描述。植物多酚的特性、代谢和生物活性见表1。
2 肠道微生物群与代谢性疾病
导致代谢性疾病的原因有很多,但研究表明环境因素相比遗传因素有更显著的相关性[48],而肠道微生物群就是环境因素之一,肠道菌群在机体中除了消化的作用外,还会产生一些机体无法产生的酶来促进多糖、植物多酚的分解和一些维生素的产生等[49],有助于宿主的肠道健康。并且代谢性疾病与肠道微生物群呈正相关关系。
2.1 肠道微生物群与肥胖
肥胖形成与减肥过程均与肠道菌群密切相关。Żak-Gołąb等[50]对肥胖人群和正常人群取样进行炎症标志物检测分析和肠道微生物群定量分析,发现肥胖人群肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、可溶性肿瘤坏死因子受体1(soluble tumor necrosis factor receptor 1,sTNFR1)、sTNFR2和白细胞介素(interleukin,IL)-6的水平高于正常人群,并且肥胖组中sTNFR1和连蛋白血浆水平与菌落计数呈正相关,连蛋白血浆水平与每日能量摄入和血糖浓度呈正相关,此外,在肥胖人群中,连蛋白水平与肠道菌群促进的全身轻度炎症相关[51]。Furet等[52]对经过腹胃镜Roux-en-Y胃旁路手术的肥胖患者(其中含有7 例II型糖尿病(type 2 diabetes,T2D)患者)进行实时定量聚合酶链式反应检测发现,肥胖组拟杆菌属/普氏菌属(Bacteroides/Prevotella)的比值较低;糖尿病患者经过胃旁路手术3 个月之后,肠道大肠杆菌(Escherichia coli)数量增加,乳酸菌数量减少,此外,普拉梭菌属(Faecalibacterium prausnitzii)数量较少,其与一些轻度炎症的增加呈负相关。而Maya-Lucas等[53]利用鸟枪法宏基因组测序技术观察到肥胖儿童肠道中普雷沃菌属(Prevotellaspp.)的丰度较高,巨单胞菌属(Megamonasspp.)数量增加,但颤螺旋菌属(Oscillospiraceae)数量减少,其与血清胆固醇水平呈负相关;此外,还检测到肥胖儿童粪便中人疱疹病毒4型的数量是正常儿童的19 倍。Fleissner等[54]则研究了高脂饮食对无菌小鼠和常规小鼠的影响,结果发现常规小鼠组中高脂饮食处理(21.4 kJ/g)和西方饮食处理(21.5 kJ/g)的厚壁菌门(Firmicutes)比例均升高,主要是韦荣球菌科(Erysipelotrichaceae)的大量繁殖,而拟杆菌门(Bacteroidetes)的比例则降低。Bäckhed等[55]利用粪群移植的方法进行研究,结果发现移植了微生物群(取自常规饲养小鼠的盲肠)的无菌小鼠两周内进食量减少,但增加了其体内脂肪含量(约60%)和胰岛素抵抗。微生物群可以促进肠道内单糖的吸收,从而诱导肝脏脂肪的新生,表明肠道菌群是一个重要的环境因素,其会影响饮食中能量的收集和宿主体内的能量贮存。
2.2 肠道微生物群与糖尿病
肠道微生物群异常、肠黏膜屏障渗漏和肠道免疫反应的改变及相互作用是导致I型糖尿病(type 1 diabetes,T1D)等疾病的重要因素[56]。Giongo等[57]对8 个患有T1D的儿童进行粪便16S rRNA扩增和焦磷酸测序,结果发现T1D儿童粪便中厚壁菌属(Firmicutessp.)数量减少,拟杆菌属(Bacteroidetessp.)数量增加。与免疫相关的微生物群数量在T1D儿童和正常儿童中具有显著差异,T1D儿童粪便中梭状芽孢杆菌(Clostridium)、拟杆菌属和韦荣氏球菌属(Veillonella)的数量增加,乳酸杆菌(Lactobacillus)、双歧杆菌属(Bifidobacterium)、同型产乙酸菌/直肠真杆菌(Blautia coccoides/Eubacterium rectale)的比值和普雷沃菌属的数量均减少[58-59]。
Brugman等[60]建立糖尿病模型BB-DP大鼠,利用荧光原位杂交技术观察与抗生素治疗组的肠道菌群差异,发现T1D的发病机制与高丰度拟杆菌属相关,并且发现抗生素治疗对肠道菌群的调节降低了糖尿病的发病率并延迟了糖尿病的发作时间。
而导致T2D的主要原因是肥胖相关的胰岛素抵抗。Larsen等[61]为了评估T2D患者和正常人之间肠道微生物群的组成差异,采用实时定量聚合酶链式反应和16S rRNA扩增测序对18 例T2D成人男性患者和18 例正常成人男性的粪便进行微生物群分析,结果发现T2D患者粪便中的厚壁菌和梭状芽胞杆菌数量减少,相反的是,β-变形菌(Betaproteobacteria)高度富集且与血糖浓度呈显著正相关。对于T2D女性患者而言,Karlsson等[62]发现除了梭状芽孢杆菌丰度减少外,另外4 种乳酸菌丰度反而有所增加,肠道菌群的失调与T2D女性患者体内空腹血糖浓度以及糖化血红蛋白、胰岛素、高密度脂蛋白、血浆甘油三酯和脂联素水平等都有相关性。在此基础上,Qin Junjie等[63]制定了全基因组关联研究方案,对345 名中国T2D患者进行深度鸟枪法宏基因组测序后发现,T2D患者的直肠真杆菌、普拉氏梭杆菌(Faecalibacteriumprausnitzii)、梭状芽胞杆菌SS3/4、罗斯拜瑞氏菌(Roseburia intestinalis)和食葡糖罗斯拜瑞氏菌(Roseburia inulinivorans)等产丁酸菌的数量减少,但是患者肠道中机会致病菌(如Hathewayi梭菌(Clostridium hathewayi)、共生梭菌(Clostridium symbiosum)、多枝梭菌(Erysipelatoclostridium ramosum)、粪拟杆菌(Bacteroides caccae)、迟缓埃格特菌(Eggerthellalenta)和大肠杆菌)的数量增多;此外,患者肠道的黏蛋白降解菌——艾克曼菌(Akkermansia)和硫酸盐还原菌——脱硫弧菌属(Desulfovibriosp. 3_1_syn3)的数量也有所增加。肠道微生物群与糖的膜转运、支链氨基酸转运、甲烷代谢、硫酸盐还原、外源性降解和代谢相关。基于这些肠道微生物标记物,可能为以后T2D患者的分类针对性治疗有帮助。
2.3 肠道微生物群与其他代谢性疾病
除了肥胖和糖尿病之外,心血管疾病、高血压和非酒精性脂肪肝病等也与肠道菌群相关。Wang Zeneng等[64]以无菌小鼠为研究对象,通过代谢组学研究证实肠道菌群促进了脂质向胆碱的微生物代谢、三甲胺N-氧化物(trimethylamine-N-oxide,TMAO)和甜菜碱类的生成,增加了心肌梗死的风险。向无菌小鼠补充膳食胆碱和肠道菌群可以促进TMAO的产生,TMAO与心血管疾病动脉粥样硬化相关[65]。Yang Tao等[66]对高血压大鼠模型和高血压患者的粪便样本进行细菌基因组分析后,发现自发性高血压大鼠与患者的粪便微生物丰度、多样性和均匀度都降低,其中自发性高血压大鼠的厚壁菌和拟杆菌数量的比值增加,而产乙酸和丁酸的细菌减少。Jiang Weiwei等[67]发现非酒精性脂肪肝患者粪便中的大肠杆菌、厌氧杆菌(Anaerobacter)、乳酸杆菌和链球菌(Streptococcus)的数量均高于健康人,白细胞分化抗原(cluster of differentiation 4,CD)4+、CD8+T淋巴细胞数量减少,而TNF-α、IL-6、干扰素-γ(interferon-γ,IFN-γ)水平升高,并且与健康人相比,非酒精性脂肪肝患者肠道绒毛排列不规则、紧密连接处变宽。此外,Liu等[68]发现另外一种名为植物乳杆菌的乳酸杆菌具有益生菌的作用,对MetS、糖尿病和脑健康具有很好的疗效。
3 植物多酚和肠道菌群的相互作用与代谢性疾病
3.1 肠道菌群对植物多酚的转化代谢
在机体结肠部位定植了许多微生物,如厚壁菌门、拟杆菌门、变形菌门、放线菌门和疣微菌门等[69]。在正常健康人体中,厚壁菌门和拟杆菌门占细菌种类的90%以上,但肠道微生物群的组成极易受到饮食、疾病和药物的影响,其中饮食摄入的影响占主导地位,经常食用富含碳水化合物食物的人群,肠道中的主要细菌是普氏菌属,而食用富含动物蛋白和饱和脂肪较多的人群体内主要是拟杆菌属[70]。一些结构复杂的多酚(如缩合单宁和水解单宁),在到达机体结肠时几乎没有发生性质上的变化,但能够被肠道微生物群进一步代谢,发生C环裂解、脱羧、脱氢和去甲基化等反应,生成相对简单的化合物,如酚酸和羟基肉桂酸酯[71]。聚合度大于3的低聚黄烷-3-醇、聚合黄酮醇(原花青素和浓缩单宁)、羟基肉桂酸酯、黄酮醇葡萄糖鼠李糖苷,如槲皮素-3-O-葡鼠李糖苷(芦丁)等,不以原始形式被吸收,在结肠部位被肠道微生物代谢成酚酸和其他产物。其中原花青素被代谢产生如羟基苯甲酸、羟基苯乙酸、羟基苯丙酸、羟基苯戊酸或羟基肉桂酸等分子质量较小的酚酸[72]。Theilmann等[73]研究发现,嗜酸乳杆菌(Lactobacillus acidophilus)可将植物糖苷转化为苷元,苷元可进一步被其他细菌修饰转化或者直接被宿主吸收利用。铅黄肠球菌(Enterococcus casseliflavus)参与一些如槲皮素-3-O-葡萄糖苷等糖类的部分水解,产生乳酸、甲酸、乙酸和乙醇。此外,细枝真杆菌(Eubacterium ramulus)、氧化真杆菌(Eubacterium oxidoreducens)、Flavonifractor plautii和梭状芽孢杆菌可能代谢槲皮素,产生短链脂肪酸、花旗松素和3,4-二羟苯基乙酸[74]。Tao Jinhua等[75]研究发现,真杆菌与黄酮类化合物的代谢相关,此外,在结肠中,羟基肉桂酸的产生也与一些乳酸杆菌和双歧杆菌相关。人类肠道菌群中大肠杆菌4号、大肠杆菌34号、肠球菌45号(Enterococcussp. 45)和芽孢杆菌46号(Bacillussp. 46)具有比较广泛的黄酮类化合物转化能力,可以将蒙花苷(黄酮类化合物)转化为金合欢素。Chen Yao等[76]在大鼠肠道中评估了3 种桑葚花青素(矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷、飞燕草素-3-芸香糖苷)的代谢转化。花青素在肠道发酵后的代谢组学分析表明,矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷被分解为原儿茶醛、香兰酸、对香豆酸和2,4,6-三羟基苯甲醛,而飞燕草素-3-芸香糖苷则被转化为丁香酸、没食子酸和2,4,6-三羟基苯甲醛。Mayta-Apaza等[77]利用一种体外胃肠发酵模型来代谢富含多酚(矢车菊素-糖基-芸香糖苷、槲皮素-芸香糖苷、绿原酸和新绿原酸)的酸樱桃,代谢产物主要是4-羟基苯丙酸,而表儿茶素和4-羟基苯甲酸含量较低。Gowd等[78]最近的一项研究发现,在体外的条件下,用提取的健康人体肠道微生物群对黑莓花青素提取物进行发酵代谢,能产生咖啡酸、3,4-二羟基苯甲酸、2,4,6-三羟基苯甲酸、香豆素、对香豆酸、阿魏酸、2,4,6-三羟基苯甲醛和没食子酸。当机体摄入富含鞣花单宁的食物(如草莓、石榴、覆盆子和核桃等)之后,鞣花单宁会先在胃肠腔中通过水解作用产生鞣花酸[79-80],鞣花酸的吸收率极低,它会到达结肠,被微生物(如假单胞双歧杆菌P815、尿链球菌和棒状戈登氏菌等[81])进一步代谢,产生生物可利用的尿石素A、B和异尿石素A等[82],然后可能会通过首过代谢被吸收或者随尿液、粪便排出体外。尿石素类衍生物是鞣花酸的肠道微生物活性代谢产物,在体内具有多种有益作用。但是鞣花单宁和鞣花酸代谢成尿石素类衍生物受到个体肠道微生物群差异的影响:在“尿石素A代谢型”个体中只产生尿石素A;而在“尿石素B代谢型”个体中,除了产生尿石素A之外,还会产生异尿石素A和/或尿石素B;在“尿石素0代谢型”个体中不产生任何尿石素,而其中发挥转化作用的产尿石素戈登氏杆菌(Gordonibacter urolithinfacienssp.)和异尿石鞣花杆菌(Ellagibacter isourolithinifaciens)被发现占重要地位[83-84],白藜芦醇(3,4’,5-芪三酚)到达结肠部位主要被转化为二氢白藜芦醇(3,4-二羟基二苯乙烯)和轮孢霉素(3,4’-二羟基二苄基)[85]。
3.2 植物多酚对肠道微生物群调节和对代谢性疾病的影响
植物多酚的代谢与吸收离不开肠道菌群的参与,其代谢产物能够发挥出对肠道微生物群和机体更有益的作用[86]。Wang Jing等[87]发现植物乳杆菌ZLP001可以通过增强肠道上皮细胞的防御功能和调节肠道菌群来加强肠道屏障。同时Barroso等[88]的研究也证明了植物乳杆菌IFPL935菌株可以发挥黄烷-3-醇的代谢作用,其分别将红葡萄酒多酚提取物与植物乳杆菌IFPL935添加到人体肠道微生物生态系统中模拟发酵,发现红酒多酚导致结肠中细菌总数下降,其中拟杆菌、球形梭菌(Clostridium coccoides)/直肠真杆菌和双歧杆菌受影响最大,但植物乳杆菌IFPL935的添加逆转了细菌总数的下降趋势,特别是恢复了乳杆菌和肠杆菌的数量,帮助多酚代谢能力低的个体提高其结肠微生物代谢多酚能力。Chen Manyun等[89]报道肠道菌群能够介导三七总皂苷(三七皂苷和人参皂苷)的去糖基化,促进如人参皂苷K、人参皂苷F1、人参皂苷Rh2、原人参三醇和原人参二醇等代谢物的生成。
多酚类物质可能会影响心血管疾病、T2D、肠道健康和癌症等的多种代谢或信号通路。食用蔬菜和水果有助于保持身体的健康,这是由于多酚具有强大的抗氧化活性[90-91],此外,多酚可以通过重塑肠道菌群来增强宿主-微生物之间的相互作用以达到减肥的效果。肠道微生物的组成差异会影响多酚及其代谢产物的生物利用度,许多体外、动物和疾病案例研究表明,植物多酚可以通过增加各种有益细菌种类的丰度和微生物群β-多样性,同时减少机会致病菌的数量,抑制肠道失调。肠道菌群的调节有助于增加糖的降解代谢,改善肠道屏障功能和能量消耗,同时减少炎症反应、胰岛素抵抗、肥胖、体质量增加和血脂异常等。这些改善最终有助于减少代谢性疾病及相关并发症(表2和图1)。
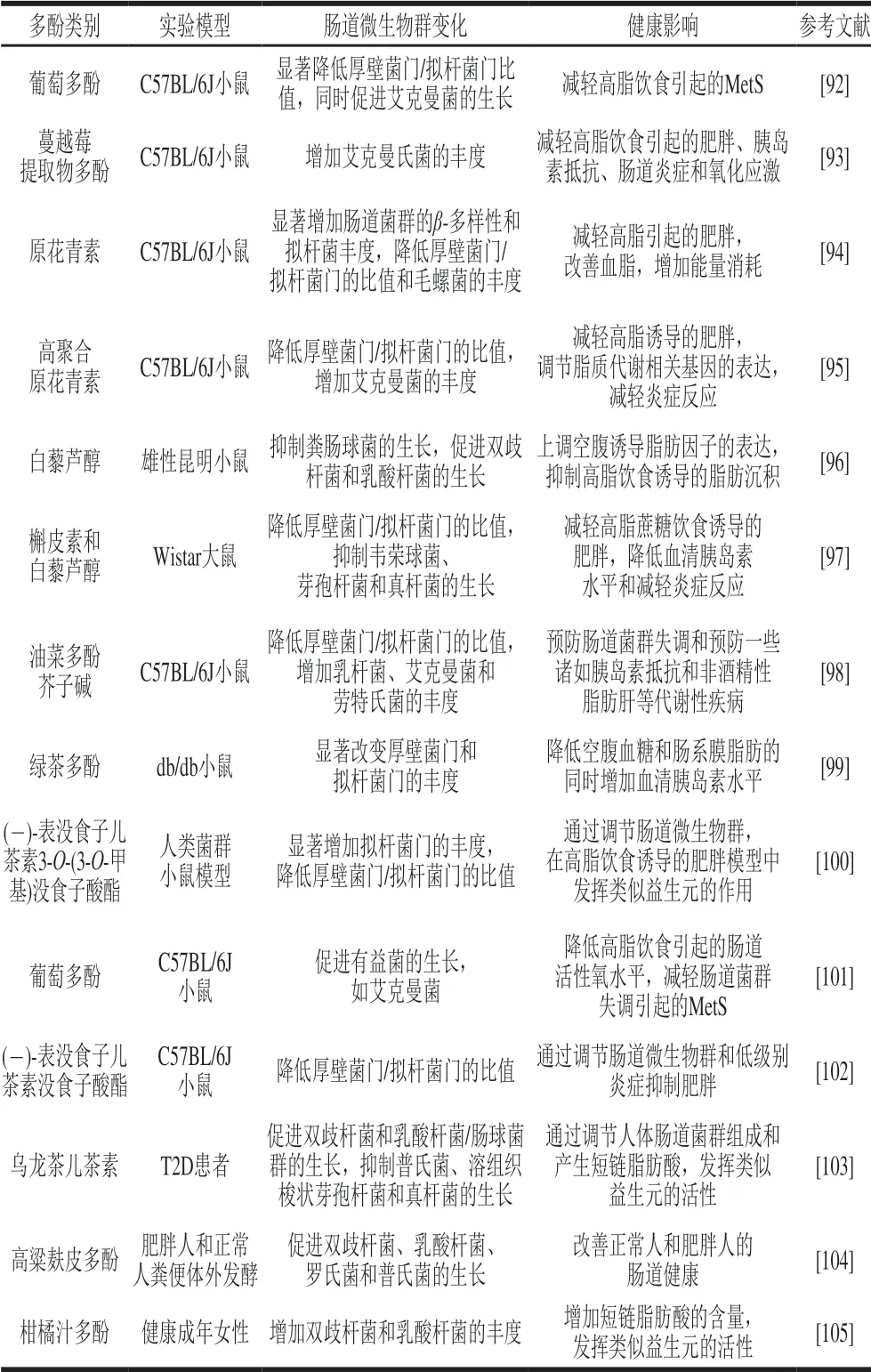
表 2 植物多酚对肠道微生物群的调节和代谢性疾病的影响Table 2 Effects of plant polyphenols on intestinal microbiota and metabolic diseases
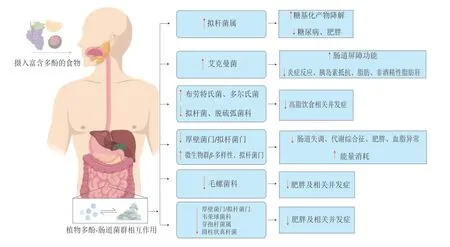
图 1 植物多酚与肠道菌群相互作用对代谢性疾病的影响[106]Fig. 1 Effect of interaction between plant polyphenols and intestinal microbiota on metabolic diseases[106]
4 结 语
植物多酚类物质有助于通过延缓或预防代谢型疾病来维持机体的健康,如减少体质量、降低血糖和血压等。但是摄入单一的植物多酚很难调控所有代谢型疾病。因此,为了防止代谢性疾病的发生和发展,需要大量摄入富含多酚的食物。研究表明,植物多酚能显著影响肠道微生物群,调节其菌落结构和功能。摄入植物多酚类有利于肠道微生物群的发展及其宿主的健康。目前,大多数研究集中于富含植物多酚食物的有益作用,而不是肠道微生物在新陈代谢和健康影响中的作用。因此,在这一研究领域迫切需要更加精确的微生物群研究,以确定肠道微生物群对植物多酚代谢的确切影响及其对健康的有益作用。此外,使用更精确的代谢组学方法可能有助于确定植物多酚循环代谢产物的有益作用和肠道微生物群介导的具体机制,以及对宿主整体产生的积极作用。这些结果将进一步协助测定各种水果和蔬菜中酚类代谢物的疗效及其生物学特性,从而发现新的功能性植物多酚类食品和营养品来对抗代谢性疾病和相关并发症。
