百香果皮体外抑制葡萄糖吸收、抗氧化及调节高血糖大鼠肠道菌群结构的作用
2021-03-31种俸亭黄子珍滕建文韦保耀
种俸亭,黄子珍,滕建文,韦保耀,黄 丽,夏 宁
(广西大学轻工与食品工程学院,广西 南宁 530004)
百香果又名西番莲,为西番莲属(Passiflora)多年生藤本植物,原产于巴西,现广泛分布在热带和亚热带地区[1]。在我国,百香果主要分布在广西、云南等地[2]。百香果主要用于果汁生产,然而果皮尚未得到有效利用,导致资源浪费。百香果皮富含膳食纤维[3]和植物化学物质如多酚[4]、黄酮[5]、花色苷[6]等,具有抗氧化[7]、抗炎[8]、降血糖[9]的功效。
糖尿病是由胰岛素分泌和作用缺陷导致的碳水化合物、脂肪、蛋白质等代谢紊乱,长期高血糖和糖耐受量下降为其主要特征[10]。目前,降血糖的研究中有抑制胰岛β细胞凋亡、促进胰岛素分泌[11],改善胰岛素与靶细胞特异性结合、增强胰岛素敏感性[12],调节关键酶活性[13],以及调节肠道菌群等多种途径[14]。在百香果辅助降血糖作用机制研究中,已有文献证明百香果皮中的类固醇、类黄酮等物质可通过降低氧化应激,或通过改善胰岛素敏感性从而调节血糖浓度。例如,Kandandapani等[15]用百香果皮提取物喂食高血糖大鼠15 d,并测定大鼠血糖浓度和终末器官氧化应激标记物,结果显示,百香果皮提取物具有明显降低氧化应激的作用,高效液相色谱测得提取物中含有类固醇、类黄酮和三萜类化合物;Queiroz等[16]使II型糖尿病患者摄入黄果百香果皮粉(passion fruit peel powder,PFP)60 d,测定膳食补充前后患者的血糖浓度、空腹胰岛素和糖化血红蛋白含量,通过血糖浓度和胰岛素含量关系的数学模型研究摄入PFP对胰岛素敏感性的影响,结果表明,黄果PFP可以通过降低胰岛素抵抗、改善胰岛素敏感性,对II型糖尿病起到辅助治疗作用。但在抑制餐后血糖研究中,百香果果皮是否可以通过抑制消化酶活性阻滞葡萄糖吸收利用,以及PFP在大肠水平通过肠道菌群利用而产生作用效果的潜在可能,均需要进一步的研究证明。
本实验采用体积分数70%的乙醇溶液提取PFP中的百香果皮醇提取物(passion fruit peel ethanol extract,PFPE)、百香果果皮醇提余物(passion fruit peel ethanol extraction residue,PFPR)、百香果皮可溶性膳食纤维提取物(passion fruit peel soluble dietary fiber,PFSF)和百香果皮不可溶性膳食纤维提取物(passion fruit peel insoluble dietary fiber,PFIF),通过研究PFP、PFPE、PFPR、PFSF和PFIF抗氧化作用以及对消化酶和葡萄糖吸收的影响,探讨百香果皮的体外降血糖效应;将PFP及各提取物与糖尿病大鼠粪便进行离体培养,对离体培养后肠道菌群结构及其代谢产物短链脂肪酸(short-chain fatty acids,SCFAs)进行分析,探讨百香果皮对糖尿病大鼠肠道菌群的调整作用,从肠道菌群方面考察百香果果皮降血糖效果及其作用机制。
1 材料与方法
1.1 动物、材料与试剂
SPF级大鼠购于广西医科大学实验动物中心,生产许可证号:SCXK(桂2018-0002),使用许可证号:SYXK(桂2018-0003)。
‘台农一号’紫红色百香果广西仟果农业科技有限公司;新鲜时采收于南宁宾阳,剔除机械损伤果和病害果,选取完全成熟、大小均匀的百香果进行实验。
无水乙醇(分析纯)天津市富宇精细化工有限公司;葡萄糖检测试剂盒北京百奥莱博科技有限公司;HP-20大孔树脂上海研谨生物科技有限公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
AE244型分析天平上海舜宇恒平仪器有限公司;DHG-9146A型电热恒温鼓风干燥箱上海精宏实验设备有限公司;722N型可见分光光度计上海仪电分析仪器有限公司;LG10-2.4A型高速离心机北京时代北利离心机有限公司。
1.3 方法
1.3.1 样品制备
PFP的制备:参照Seixas等[17]的方法稍作修改,百香果洗净、切开,去果浆和果皮内瓤层,切块,55 ℃热风干燥60 h,用中药粉碎机初粉碎后进行超微粉碎,避光保存。
PFPR和PFPE的制备:参照Wong[18]和文良娟[19]等的方法稍作修改,称取PFP样品20 g于400 mL体积分数70%乙醇溶液中,室温浸提1 h,定性滤纸抽滤,收集不溶物。400 mL体积分数70%乙醇溶液重复提取不溶物至滤液清澈透明。收集不溶物于55 ℃干燥60 h,粉碎机粉碎得PFPR(12.56 g),密封保存。
取上述步骤的滤液,55 ℃旋转蒸发浓缩,过0.45 μm滤膜,纯化,选用规格为30 mm×500 mm玻璃层析柱,以HP-20大孔吸附树脂湿法装柱,装柱高度420 mm,装料体积300 cm3,洗脱液为蒸馏水和体积分数75%乙醇溶液。上样量15 mL,质量浓度0.10 g/mL,以15 r/min的流速上样,先用蒸馏水洗脱,直至洗脱液在硫酸苯酚法下无显色,用体积分数75%乙醇溶液洗脱至洗脱液在全波长扫描下检测不到酚类物质的特征峰(760 nm)。收集合并上述乙醇洗脱液,55 ℃下旋转蒸发浓缩,浓缩液冷冻干燥得到PFPE(0.28 g)。
PFSF和PFIF的制备:参照文良娟等[19]的方法稍作修改,向PFPR(12.56 g)中加入蒸馏水(125.6 mL),60 ℃水浴3 h,5 000 r/min离心10 min,取上清液,向上清液中按体积比1∶4加入体积分数95%乙醇溶液,搅拌后静置1 h,5 000 r/min离心10 min,沉淀物冷冻干燥,粉碎得PFSF(1.17 g),密封保存;收集制备PFSF过程中的滤渣,冷冻干燥,粉碎得PFIF(10.39 g),密封保存。
1.3.2 化学成分的测定
1.3.2.1 膳食纤维质量分数测定
参照GB 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》[20]测定样品干基中所含膳食纤维质量分数。
1.3.2.2 总酚质量分数测定
参照Singleton等[21]的方法,用Folin-Ciocalteau法测定。样品处理:PFP、PFPR、PFIF、PFSF、PFPE各取1.000 g,分别加入30 mL体积分数80%乙醇溶液,室温下磁力搅拌1 h,静置分层后过滤,收集滤液,沉淀用30 mL体积分数80%乙醇溶液,室温下磁力搅拌1 h,静置分层,过滤至滤液基本无色为止,最后合并所有滤液,旋转蒸发除去乙醇,定容至50 mL备用。以没食子酸为标准品绘制标准曲线,计算样品干基中总酚质量分数。
1.3.2.3 总黄酮质量分数测定
参照Tohidi等[22]的方法,样品处理同1.3.2.2节,以芦丁为标准品绘制标准曲线,计算样品干基中总黄酮质量分数。
1.3.3 样品对消化酶活力的抑制作用
样品处理同1.3.2.2节,配制质量浓度1、5、10、15、20、25 mg/mL的样品溶液,按照Apostolidis等[23]方法测定α-葡萄糖苷酶、α-淀粉酶活力抑制率,每组实验测定3 次。以阿卡波糖为阳性对照,超纯水代替样品溶液作为空白对照组。酶活力抑制率按式(1)计算,并计算酶活力半抑制质量浓度(half inhibitory concentration,IC50)。
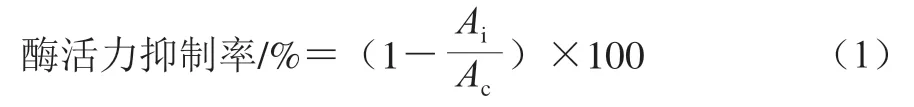
式中:Ai、Ac分别为样品组、空白对照组溶液在520 nm波长处的吸光度。
1.3.4 样品体外抗氧化活性的测定
样品处理同1.3.2.2节,配制质量浓度4、8、12、16、20 mg/mL样品溶液,备用。
1.3.4.1 DPPH自由基清除率测定
参照J e d d o u 等[24]方法稍作修改。取3 m L 样品溶液和3 mL 200 μmol/L的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)乙醇溶液,漩涡混匀,避光反应30 min,在517 nm波长处测定吸光度。以超纯水代替样品溶液作为空白对照组,以VC为阳性对照,测定3 次。DPPH自由基清除率按式(2)计算,并计算DPPH自由基IC50。
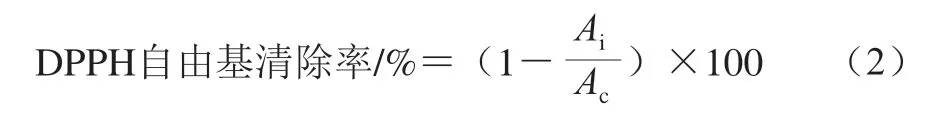
式中:Ai、Ac分别代表样品组、空白对照组溶液在517 nm波长处的吸光度。
1.3.4.2 ABTS阳离子自由基清除率测定
参照An Kejing等[25]的方法稍作修改。在室温下将7 mmol/L 2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium,ABTS)溶液和2.45 mmol/L过硫酸钾溶液等体积混匀,反应12~16 h得ABTS阳离子反应液,将ABTS阳离子反应液用蒸馏水稀释至734 nm波长处吸光度为0.70±0.02,作为应用液。取0.2 mL样品溶液加入6 mL ABTS阳离子应用液,漩涡混合,室温避光反应6 min,在734 nm波长处测定吸光度。以蒸馏水代替样品溶液作为空白对照组,VC作为阳性对照,测定3 次,ABTS阳离子自由基清除率按式(2)计算。式中Ai、Ac分别代表样品组、空白对照组溶液在734 nm波长处的吸光度。
1.3.5 葡萄糖扩散浓度和GDRI测定
参照Almoosawi等[26]的方法,称取0.500 0 g样品和25 mL 100 mmol/L葡萄糖溶液混匀后,装入透析袋(12 000~14 000 Da),放于200 mL去离子水中,37 ℃振荡透析。分别在30、60、90、120、150 min收集透析液,用葡萄糖检测试剂盒测定葡萄糖扩散浓度,重复3 次。在葡萄糖扩散浓度测定基础上,以未加样品的葡萄糖溶液为对照组。葡萄糖透析延迟指数(glucose dialysis retardation index,GDRI)按式(3)计算。
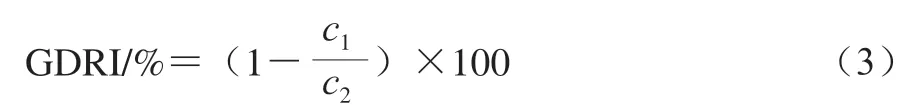
式中:c1、c2分别代表样品组、对照组溶液的葡萄糖扩散浓度/(mmol/L)。
1.3.6 体外肠道菌群发酵实验
1.3.6.1 高血糖大鼠造模及其粪便采集
20 只SPF级雄性SD大鼠,按照马玉仙等[27]的方法随机均分为两组:正常大鼠为对照组;实验组大鼠进行糖尿病造模,造模后实验组大鼠禁食8 h,用血糖仪检测血糖浓度,血糖浓度不低于16.7 mmol/L,且出现多饮水、多食、多尿情况即为造模成功。实验当天采集5 只对照组和5 只实验组大鼠的粪便,用无菌镊子取自然排出的新鲜粪便,置于无菌EP管中,厌氧、-80 ℃下保存,以备分析。
1.3.6.2 体外模拟发酵实验
参照何欣欣[28]的方法,制备磷酸缓冲溶液(phosphate buffered saline,PBS)、BCM培养基、粪便悬液和质量浓度10 mg/mL样品悬液,构建体外厌氧培养体系(每个独立重复的培养体系体积为5 mL:3.5 mL BCM培养基、0.5 mL粪便悬液和1 mL样品悬液)。以等体积PBS替代体系中的样品悬液作为对照组,以菊粉为阳性对照。37 ℃下厌氧发酵0、12、24、48、60 h。
1.3.6.3 微生物计数和pH值测定
发酵60 h后取1 mL发酵液进行梯度稀释,根据表1中的选择性培养基和培养条件对稀释液进行培养,参照《保健食品检验与评价技术规范(2003)》,根据菌落形态和革兰氏染色与生化反应等进行微生物鉴别和计数[29-30];取0、12、24、48、60 h发酵液,冷却至室温,用pH计测定pH值,平行3 次,结果取平均值。
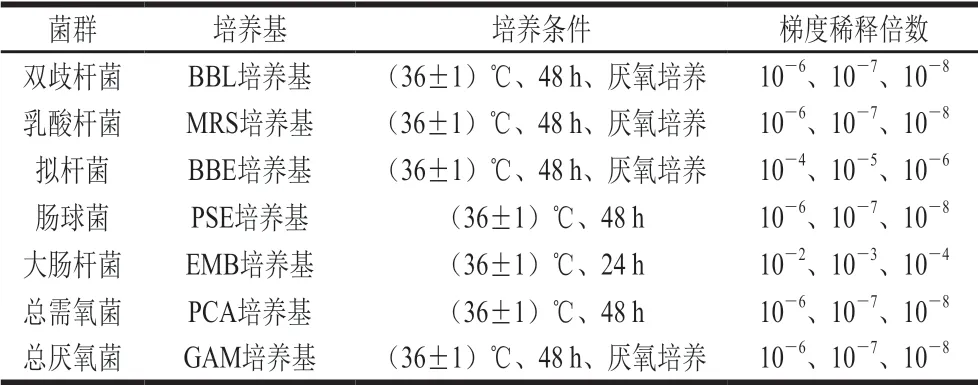
表 1 肠道菌群计数用培养基和培养条件[30]Table 1 Media and culture conditions for gut microflora[30]
1.3.6.4 气相色谱分析SCFAs
参照何欣欣[28]的方法:取2 mL样品发酵上清液(4 ℃、8 000 r/min、15 min),加入0.2 mL体积分数50%硫酸溶液,漩涡15 s,加入2 mL乙醚,漩涡1 min,离心(4 ℃、8 000 r/min、10 min),取上层溶液,0.45 μm滤膜过滤至进样瓶中,以备分析。
色谱条件参照赵晓亚等[31]的方法并稍作修改。色谱柱:DB-FFAP石英毛细管柱(30 m×0.32 mm,0.25 μm);氢火焰离子检测器;H2流速60 mL/min,空气流速300 mL/min,N2流速10 mL/min;升温程序:60 ℃保留1 min,以6 ℃/min升至120 ℃;再以20 ℃/min升至220 ℃,保留9 min;载气(N2)流速0.5 mL/min,压力20.7 kPa,进样量0.5 μL。
1.4 数据处理与分析
采用Origin Pro 9.1软件作图,采用SPSS 25.0软件对数据进行方差分析,各组数据采用单因素方差分析比较差异显著性,方差齐时用Bonferroni法进行两两比较,方差不齐时用Tamhane’s T2法进行多重比较,结果以平均值±标准差表示;对于不符合正态分布或正态转化无效的数据,采用Kruskal-Wallis秩和检验。采用SPSS 25.0软件拟合S曲线,计算IC50。
2 结果与分析
2.1 百香果皮活性成分分析
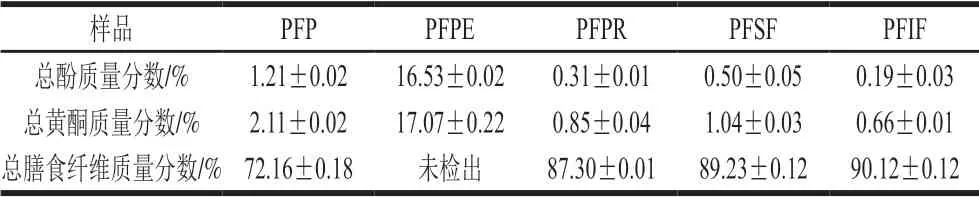
表 2 百香果皮活性成分分析Table 2 Composition analysis of passion fruit peel
由表2可知,PFP中总膳食纤维质量分数为72.16%,高于人们所熟知的高膳食纤维材料(如麦麸44.46%[32]、米糠37.5%[33]、葡萄皮56.5%[34]、番石榴49%[35]等)。PFPE的总酚和总黄酮质量分数远高于其他提取组分,分别为16.53%、17.07%;而PFPR、PFSF、PFIF以膳食纤维为主。
2.2 百香果皮及其提取物对消化酶活力的抑制作用
碳水化合物在人体内经过α-淀粉酶和α-葡萄糖苷酶等消化酶水解生成单糖才能被小肠吸收。因此,可以通过抑制消化酶活力进而阻碍或减缓碳水化合物分解为葡萄糖的速率,抑制葡萄糖在肠道内的吸收,降低血液中的葡萄糖浓度[36]。
2.2.1α-葡萄糖苷酶活力抑制作用
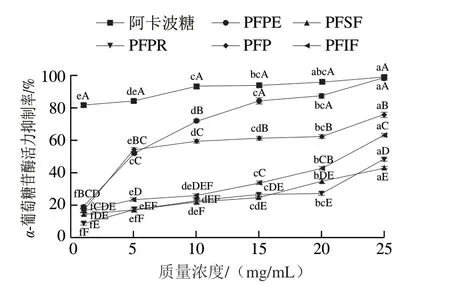
图 1 百香果皮及其提取物对α-葡萄糖苷酶活力的抑制作用Fig. 1 Inhibitory activity of passion fruit peel and its extracts on α-glucosidase
由图1可知,百香果皮及其提取物对α-葡萄糖苷酶活力均有抑制作用,表现出明显的剂量-效应关系,这与文献[37]结论相同。质量浓度1~10 mg/mL时PFPE的α-葡萄糖苷酶活力抑制率显著低于阿卡波糖(P<0.05);质量浓度15~25 mg/mL时,与阿卡波糖相比,PFPE的α-葡萄糖苷酶活力抑制率无显著性差异(P>0.05)。质量浓度在10 mg/mL以上时,PFPE的α-葡萄糖苷酶活力抑制率显著高于其他百香果皮提取物(P<0.05)。说明PFPE是百香果皮发挥α-葡萄糖苷酶活力抑制作用的主要组分。
2.2.2α-淀粉酶活力抑制作用
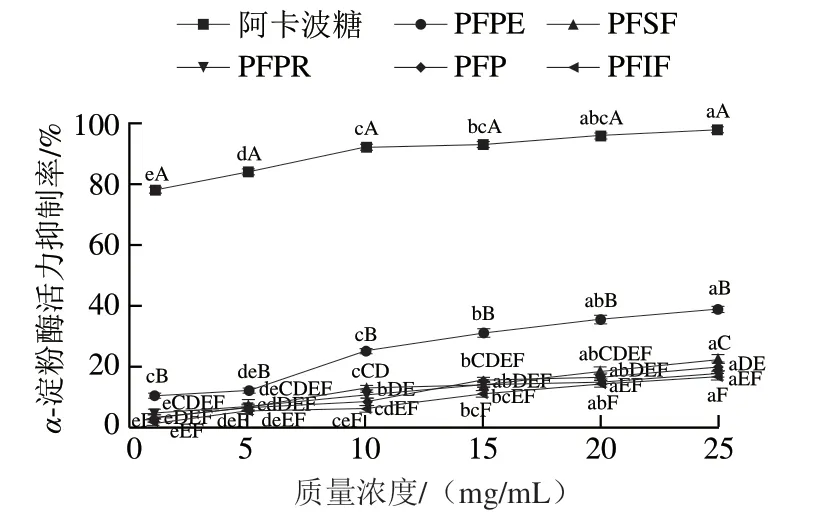
图 2 百香果皮及其提取物对α-淀粉酶活力的抑制作用Fig. 2 Inhibitory activity of passion fruit peel and its extracts on α-amylase
由图2可知,百香果皮及其提取物对α-淀粉酶活力均表现出一定的抑制作用,也呈剂量-效应关系,这与文献[38]结论相同。阿卡波糖的α-淀粉酶活力抑制率显著高于百香果果皮及其提取物(P<0.05)。质量浓度5~25 mg/mL时,随着质量浓度的增加,PFPE对α-淀粉酶活力的抑制率显著升高(P<0.05)。PFPE对α-淀粉酶活力的抑制率显著高于PFP及其他提取物(P<0.05),但显著低于阿卡波糖(P<0.05)。虽然PFPE对α-淀粉酶活力的抑制率与阿卡波糖相比存在显著差异,但PFPE的总酚质量分数仅为16.53%,若进一步提高百香果皮多酚纯度,其是否具有与阿卡波糖相近的抑制活性还需要深入研究。
2.2.3 消化酶活力抑制IC50

表 3 百香果皮及其提取物消化酶活力抑制的IC50Table 3 IC50 of passion fruit peel and its extracts against digestive enzymes mg/mL
由表3可知,百香果皮及各提取物间α-葡萄糖苷酶和α-淀粉酶活力IC50均有显著差异(P<0.05)。其中,PFPE表现出较强的α-葡萄糖苷酶、α-淀粉酶活力抑制效果,IC50分别为6.23 mg/mL和28.65 mg/mL。PFPE的α-葡萄糖苷酶IC50较罗汉果皂苷粗提物(IC50为9.125 mg/mL)[39]和龙眼壳乙醇提取物(IC50为11.93 mg/mL)[40]低,但高于阿卡波糖(IC50为0.14 mg/mL);PFPE的α-淀粉酶活力IC50与黄秋葵水提物(IC50为24.6 mg/mL)相当,但高于阿卡波糖(IC50为0.23 mg/mL)。
综上所述,PFPE是百香果果皮中发挥消化酶活力抑制作用的主要组分,结合表2可以看出,PFPE中未检测到膳食纤维,因此膳食纤维对PFPE对消化酶活力抑制作用的贡献较小,具有主要贡献的组分为总酚和总黄酮。Choudhary等[41]探讨蚕豆醇提物对α-葡萄糖苷酶活力抑制作用时也发现醇提物中的酚类、黄酮类物质可以通过氢键等与α-葡萄糖苷酶结合,从而抑制酶活性。
2.3 百香果皮及其提取物的体外抗氧化作用
2.3.1 DPPH自由基清除作用
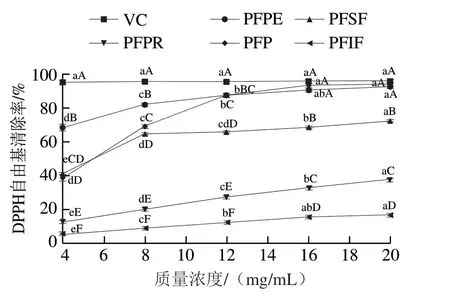
图 3 百香果皮及其提取物的DPPH自由基清除率Fig. 3 Scavenging effect of passion fruit peel and its extracts on DPPH radicals
由图3可知,百香果皮及其提取物对DPPH自由基均有一定的清除作用,均表现出明显的剂量-效应关系。这与柑橘皮提取物[42]中DPPH自由基清除率的变化趋势一致。质量浓度4~12 mg/mL时VC的DPPH自由基清除率显著高于百香果皮及其提取物(P<0.05),12~20 mg/mL时VC的DPPH自由基清除率与PFP及PFPE差异不显著,而以膳食纤维为主的PFPR、PFSF、PFIF的DPPH自由基清除率显著低于PFPE(P<0.05),表明PFPE是百香果皮中发挥DPPH自由基清除作用的主要组分。结合表2分析可知,总酚、总黄酮与DPPH自由基清除率有密切关系,这与Othmen等[43]研究结果类似,角豆叶提取物中总酚、类黄酮含量高,具有更高的抗氧化活性。
2.3.2 ABTS阳离子自由基清除作用
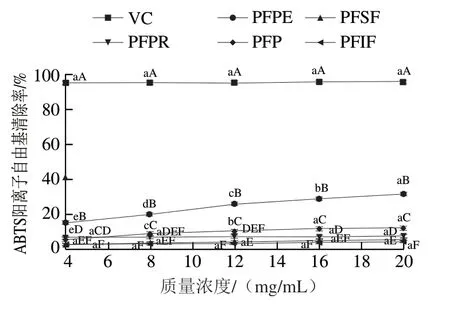
图 4 百香果皮及其提取物的ABTS阳离子自由基清除率Fig. 4 Scavenging effect of passion fruit peel and its extracts on ABTS cation radicals
由图4可知,PFPE的ABTS阳离子自由基清除率表现出明显的剂量-效应关系,并且显著高于PFP及其他提取物(P<0.05)。PFPR、PFSF及PFIF的ABTS阳离子自由基清除率随着质量浓度的增加均无显著变化(P>0.05)。与DPPH自由基清除率结果相似,PFPE是百香果皮中发挥ABTS阳离子自由基清除作用的主要组分,表明总酚、总黄酮与ABTS阳离子自由基及清除率有密切关系。
2.3.3 体外抗氧化作用IC50

表 4 百香果皮及其提取物体外抗氧化作用的IC50Table 4 IC50 of passion fruit peel and its extracts for antioxidant activity in vitro mg/mL
由表4 可知,百香果皮及各提取物间的D P P H自由基和A B T S 阳离子自由基I C50均有显著差异(P<0.05)。PFPE表现出较强的抗氧化能力,其对DPPH自由基和ABTS阳离子自由基的IC50分别为1.89 mg/mL和32.25 mg/mL,其次为PFP。PFPE的DPPH自由基IC50与菲尔杜德红树莓果渣提取物(IC50为1.41 mg/mL)相近,比柑橘皮醇提取物(IC50为7.51 mg/mL)小[44],但大于VC(IC50为0.1 mg/mL);PFPE的ABTS阳离子自由基IC50较VC(IC50为0.14 mg/mL)小。百香果皮中高纯度多酚提取物的抗氧化活性还需要进一步研究。
2.4 百香果皮及其提取物的葡萄糖透析延迟作用
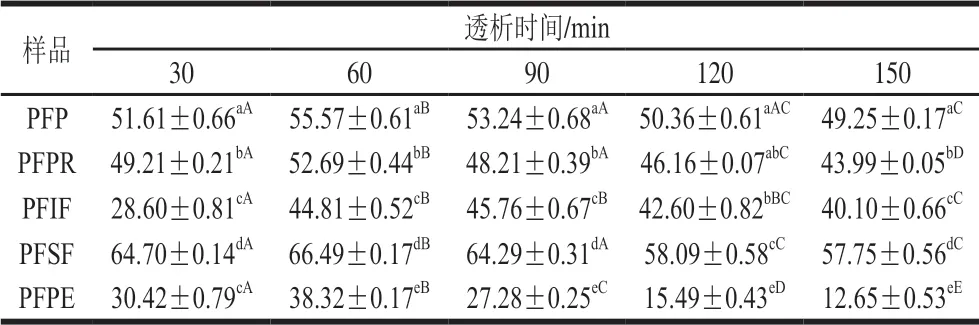
表 5 百香果皮及其提取物的GDRITable 5 Glucose dialysis retardation indices of passion fruit peel andits extracts%
葡萄糖延迟吸收作用可以用GDRI来表征[45],GDRI越大,说明样品对葡萄糖的透析延迟效果越好,对餐后血糖升高的抑制也更好。由表5可知,百香果皮及各提取物均有一定的葡萄糖延迟吸收作用。在透析60~150 min内,各样品的GDRI均随透析时间的延长逐渐减小,说明对葡萄糖延迟吸收作用随透析时间的延长逐渐减弱;其中PFPR、PFIF、PFSF的GDRI显著高于PFPE(P<0.05),PFSF的GDRI在各样品中最高(P<0.05),说明在葡萄糖延迟吸收能力中,PFPE贡献最小,PFPR、PFIF、PFSF贡献较大,尤其是PFSF,这与文献[46]结论相一致。结合表2分析可知,膳食纤维是影响GDRI的主要成分,其他成分作用不明显。膳食纤维中,PFIF的葡萄糖延迟吸收作用可能是由于不溶性纤维颗粒对葡萄糖分子的物理阻碍以及葡萄糖在纤维形成的网络内被截留造成[47],PFSF可能是因为具有黏性,能够对葡萄糖形成包裹[48]。
2.5 百香果皮及其提取物的肠道菌群调节作用
2.5.1 百香果皮及其提取物对大鼠肠道菌群的影响
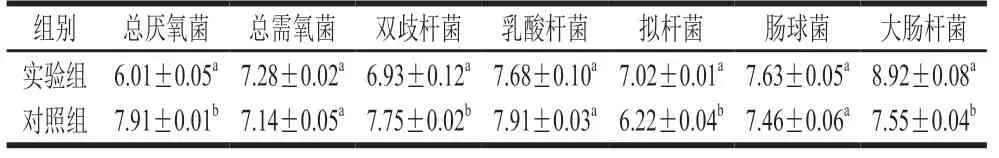
表 6 糖尿病大鼠与健康大鼠肠道菌群结构比较(n=6)Table 6 Comparison of intestinal microflora structure in diabetic rats and healthy rats (n= 6)lg(CFU/mL)
由表6可知,与对照组健康大鼠相比,实验组糖尿病大鼠粪便中总厌氧菌、双歧杆菌数量极显著减少(P<0.01),拟杆菌、大肠杆菌数量极显著增加(P<0.01)。由此可见,与正常大鼠相比,糖尿病大鼠存在肠道菌群失调的情况。
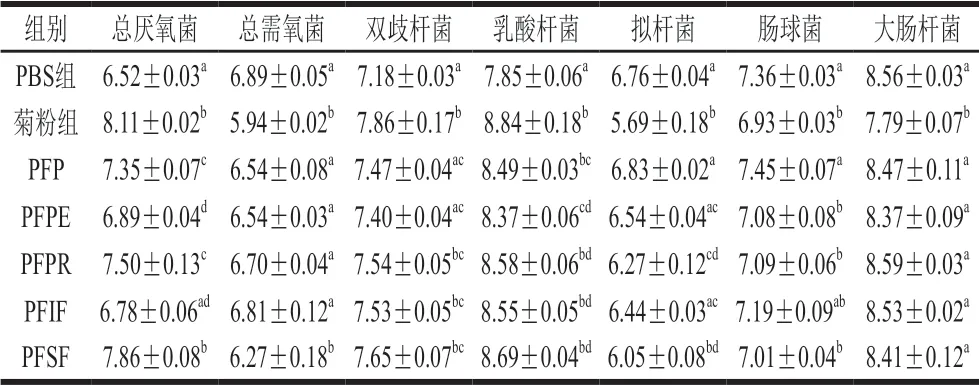
表 7 体外发酵60 h实验组大鼠肠道菌群结构比较(n=6)Table 7 Comparison of rat intestinal microflora structure in in vitro 60 h fermentation groups (n= 6)lg(CFU/mL)
由表7可知,百香果皮及其提取物均能不同程度地改善实验组糖尿病大鼠肠道菌群失调的状况。与PBS组相比,PFSF能够显著增加糖尿病大鼠肠道中总厌氧菌、双歧杆菌、乳酸杆菌的数量(P<0.05),显著降低总需氧菌、拟杆菌、肠球菌的数量(P<0.05)。除大肠杆菌之外,PFSF对肠道菌群的调节作用与菊粉相比无显著性差异(P>0.05),说明百香果皮中PFSF对调节肠道菌群失衡贡献比较大,这与文献[25]结论一致。
2.5.2 发酵产物与pH值的变化
由图5可知,随着发酵时间的延长,PBS组pH值在7.5~6.9之间波动,组内pH值无显著差异(P<0.05);菊粉组发酵1 2 h 的p H 值与发酵0 h 相比显著下降(P<0.05),之后组内pH值无显著差异(P>0.05),发酵48 h时降至最低5.4,之后稳定在5.7左右,说明菊粉能够有效改善体系pH值,抑制大肠杆菌、拟杆菌以及肠球菌等不耐受较低pH值微生物的生长,有利于双歧杆菌(生长pH 4.5~7.5)以及乳酸杆菌(生长pH 5.5~6.0)的生长。PFP、PFPE、PFPR、PFSF 4 种提取物组pH值的变化规律基本一致,与发酵0 h相比,发酵12 h时pH值均显著降低(P<0.05),发酵48 h时pH值降至最低;与菊粉组发酵48 h时pH值相比,仅PFSF组pH值无显著性差异(P>0.05),说明PFSF调节发酵体系pH值的能力较强。PFSF组发酵体系pH值可以降低到5.9,能够很好地促进双歧杆菌和乳酸杆菌的生长,这与表7的结论一致。
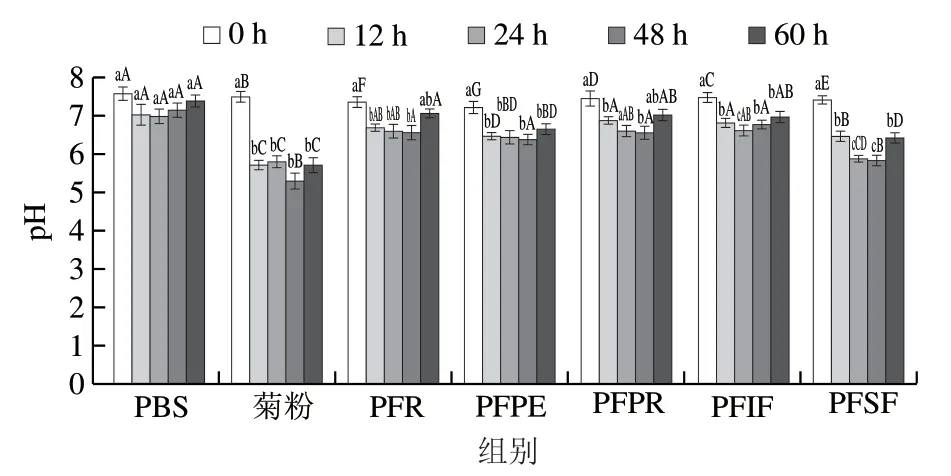
图 5 百香果皮及其提取物与实验组大鼠粪便发酵上清液pH值Fig. 5 pH of in vitro fermentation supernatants of rat feces with passion fruit peel, its extracts or inulin
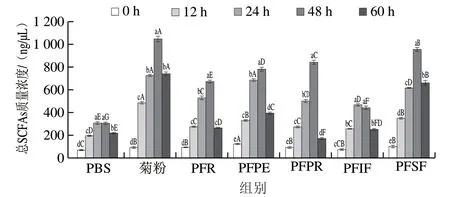
图 6 百香果皮及其提取物与实验组大鼠粪便发酵上清液的总SCFAs含量Fig. 6 Total SCFAs contents in in vitro fermentation supernatants of rat feces with passion fruit peel, its extracts or inulin
由图6可知,与发酵0 h对比,发酵能够显著增加上清液中SCFAs质量浓度,这与da Silva等[49]的研究结果一致。SCFAs是酸性物质,其质量浓度的增加会引起体系pH值下降,结合图5 pH值的变化规律可知,发酵体系pH值的变化主要是由于SCFAs的产生。组间对比分析可知,发酵期间,PFSF组的SCFAs质量浓度整体高于PFP及其他提取物,而PFIF组的SCFAs质量浓度则整体低于PFP及其他提取物组。肠道微生物能高效酵解可溶性膳食纤维,如PFSF、寡糖、菊粉和玉米淀粉,产生较高质量浓度的SCFAs,不溶性膳食纤维则不易被肠道微生物酵解,在结肠中产生较少SCFAs[50]。
3 结 论
本实验通过对百香果皮及其4 种提取物的成分和功能活性进行分析发现:百香果皮具有抑制消化酶活力和抗氧化活性,富含膳食纤维的提取物贡献较小,富含总酚和总黄酮的PFPE具有主要贡献;百香果皮的葡萄糖延迟吸收能力主要归因于膳食纤维,特别是PFSF发挥作用。体外肠道菌群发酵实验结果表明,PFP及其4 种提取成分均能被高血糖大鼠肠道菌群利用产生SCFAs,能不同程度地富集乳酸杆菌、双歧杆菌,抑制致病菌,PFSF调节高血糖大鼠肠道菌群结构的效果最好,因为其产SCFAs较多,能够很好地促进双歧杆菌和乳酸杆菌的生长,抑制致病菌的生长。后续研究可以从提升百香果皮的多酚纯度和对活性多酚单体的分离鉴定角度出发,提升百香果皮的功能活性,从肠道菌群角度深入探究百香果皮的降血糖效果及作用机制。
