紫苏籽肽对环磷酰胺致性功能损伤大鼠的改善作用
2021-03-31李明亮王雨辰蔡木易谷瑞增
李明亮,姜 盛,郭 颖,陈 亮,王雨辰,蔡木易,谷瑞增,魏 颖,
(1.中国食品发酵工业研究院北京市蛋白功能肽工程技术研究中心,北京 100015;2.华狐生物科技(中国)有限公司,辽宁 沈阳 110000)
紫苏(Perilla frutescensLinn.)是我国卫生部首批公布的60 种药食兼用型植物之一,分布于我国长江中下游[1],为唇形科一年生草本植物[2]。我国是紫苏资源大国,紫苏类别极为丰富[3],其被作为药物或调味香料应用历史悠久。
目前国内外对紫苏的研究多集中在其所含的化学成分和活性物质方面,已在紫苏属植物中发现黄酮类、萜类、苯丙素类、甾体类等化学成分,以及多种具有抗过敏、抗菌、抗炎、免疫调节等功能的活性物质[4]。紫苏茎叶中的蛋白质量分数约为27%,紫苏籽内蛋白质量分数更是高达39%(干质量)[5],且氨基酸种类齐全,含有人体所需8 种必需氨基酸,是一种优质的植物蛋白资源。目前对于紫苏蛋白或紫苏肽的研究已有一些报道,多集中在对紫苏蛋白提取工艺的改进、紫苏多肽的分离纯化以及紫苏肽的抗氧化功能等方面,对于紫苏肽的其他生物功能活性或体内实验少有研究。
我国是世界上老龄化问题最突出的国家之一。对男性而言,随着年龄的增长,下丘脑-垂体-睾丸轴功能逐步减退,促性腺激素释放激素分泌下降,睾丸供血减少,睾丸间质细胞数量减少,类固醇合成酶活性降低,血清睾酮水平下降,造成性欲和勃起功能减弱以及肌力下降等症状。同时,机体衰老产生过多的自由基,通过一系列过氧化链式反应引起睾丸间质细胞睾酮合成能力下降。疾病、肥胖、药物和不良生活方式等因素可加速上述症状的产生[6]。精氨酸可以合成信号分子NO以及参与某些多胺类物质的合成,而NO和多胺对于男性勃起功能和精子生成至关重要,有研究显示,补充精氨酸或富含精氨酸的蛋白质可以提高男性的性功能。
本课题组前期研究发现由紫苏籽粕提取的紫苏籽蛋白中富含精氨酸及其他多种功能性氨基酸,推测紫苏籽蛋白可能具有改善男性性功能的作用。由于小分子肽比蛋白质和游离氨酸具有更高的生物利用度,更容易被机体吸收和发挥生理活性,本实验通过酶解法进一步将紫苏籽蛋白酶解为分子质量更小的紫苏籽肽,比较紫苏籽蛋白和紫苏籽肽对男性性功能的影响。环磷酰胺具有生殖毒性,可造成睾丸组织学改变,引起氧化应激和脂质过氧化以及DNA损伤,还可以引起促性腺激素分泌紊乱和血清睾酮水平降低,进而造成性功能障碍。本实验以自制紫苏籽肽为研究对象,通过对大鼠腹腔注射环磷酰胺,构建大鼠生殖损伤模型,并连续灌胃不同剂量的紫苏籽肽和紫苏籽蛋白,通过检测大鼠血清中免疫和生殖相关的细胞因子、蛋白和激素水平,以及相关基因表达量变化等,分析紫苏籽肽对大鼠生殖损伤状况的改善作用,以期为开发紫苏籽肽新的生物活性和新的植物源活性肽提供思路。
1 材料与方法
1.1 动物、材料与试剂
6 周龄SPF级SD雄性大鼠购自北京维通利华实验动物技术有限公司;生产许可证号:SCXK(京)2016-0006;使用许可证号:SYXK(京)2017-0033;体质量(2 6 0±2 0)g。实验动物饲养在无菌环境,温度(20±2)℃,昼夜照明时间12 h∶12 h。实验期间动物自由进食和饮水。
紫苏籽粕由华狐生物科技(中国)有限公司提供;紫苏籽蛋白与紫苏籽肽为北京市蛋白功能肽工程技术研究中心实验室制备。
大鼠睾酮酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、大鼠游离睾酮ELISA试剂盒南京森贝伽生物科技有限公司;Rodent卵泡刺激素(follicle stimulating hormone,FSH)ELISA试剂盒、Rodent促黄体生成素(luteinizing hormone,LH)ELISA试剂盒美国Endocrinetech公司;环磷酰胺江苏盛迪医药有限公司;L-精氨酸、西地那非北京索莱宝科技有限公司;丙二醛(malondialdehyde,MDA)检测试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒南京建成生物工程研究所有限公司;动物组织总RNA提取试剂盒天根生化科技(北京)有限公司;鼠免疫球蛋白G(immunoglobulin G,IgG)ELISA试剂盒、鼠白细胞介素2(interleukin 2,IL-2)ELISA试剂盒、鼠干扰素γ(interferon γ,IFN-γ)ELISA试剂盒碧云天生物技术研究所。
1.2 仪器与设备
Spectra MR多功能酶标仪美国Dynex公司;实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国赛默飞世尔科技有限公司;A300氨基酸自动分析仪德国曼默博尔公司;UDK-159全自动凯氏定氮仪意大利Velp公司;LC-20AD型高效液相色谱仪日本Shimadzu公司。
1.3 方法
1.3.1 紫苏籽蛋白和紫苏籽肽制备
紫苏籽蛋白和紫苏籽肽的制备参考文献[7-8]并略作修改。
紫苏籽蛋白:紫苏籽粕经碱溶萃取(pH 10),离心(3 000 r/min、20 min)、酸沉(pH 4.4)、热处理、挤压过滤、中和回调、均质,最后灭菌、喷雾干燥,制得紫苏籽蛋白粉。
紫苏籽肽:将紫苏籽蛋白粉以1∶10(m/V)比例混合匀浆,并调节pH值至5.5~6.0,制得蛋白匀浆;加热蛋白匀浆至45~55 ℃,并向其中同时加入酸性蛋白酶、中性蛋白酶及木瓜蛋白酶,保温搅拌4 h后,灭酶,制得紫苏籽肽酶解液;对紫苏籽肽酶解液离心,收集上清液并调节pH值至6.0~6.5,得到紫苏籽肽离心液;用陶瓷膜过滤紫苏籽肽离心液,收集过滤液,得到一级过滤液;用纳滤膜过滤一级过滤液,收集截留液,得到二级过滤液;紫苏籽肽二级过滤液减压浓缩,再将浓缩液用硅藻土过滤,灭菌、喷雾干燥后得到紫苏籽肽。
1.3.2 紫苏籽蛋白和紫苏籽肽基本理化性质分析
获得的紫苏籽蛋白和紫苏籽肽,依据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,用全自动凯氏定氮仪测定样品中蛋白质量分数;依据GB/T 22729—2008《海洋鱼低聚肽粉》测定样品中酸溶蛋白质量分数,并用高效液相色谱测定样品分子质量;依据GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》,利用氨基酸自动分析仪测定样品中氨基酸组成及质量分数。
1.3.3 大鼠造模及分组
实验动物经适应性喂养1 周后,称体质量,随机分为空白组、模型组、西地那非组、精氨酸组以及低、高剂量紫苏籽肽组和低、高剂量紫苏籽蛋白组。除空白组外,其余各组大鼠腹腔注射环磷酰胺20 mg/(kgmb·d),连续5 d[9],建立生殖损伤大鼠模型;空白组大鼠每天注射等体积生理盐水。造模结束后,西地那非组大鼠灌胃西地那非5 mg/(kgmb·d),精氨酸组大鼠灌胃精氨酸0.3 g/(kgmb·d),低、高剂量紫苏籽肽组大鼠分别灌胃紫苏籽肽0.3、0.6 g/(kgmb·d),低、高剂量紫苏籽蛋白组大鼠分别灌胃紫苏籽蛋白0.3、0.6 g/(kgmb·d),空白组和模型组大鼠每天灌胃等体积生理盐水,连续6 周。
1.3.4 大鼠血清生化指标检测
末次灌胃后,禁食12 h,称体质量,对大鼠眼眶取血,血液在4 ℃放置过夜后,于4 ℃、3 500 r/min条件下离心20 min,收集血清,-80 ℃保存备用。按照试剂盒说明书步骤操作,用ELISA法检测大鼠血清睾酮、游离睾酮浓度及LH、FSH、IL-2、IFN-γ、IgG质量浓度[10-11]。
大鼠脱颈处死后,取形态病理学观察实验剩余睾丸和肾脏组织,经液氮速冻后于-80 ℃保存,用于大鼠睾丸和肾脏组织MDA含量、SOD活力测定。
1.3.5 大鼠脏器指数测定
眼眶采血后,大鼠脱颈处死,收集胸腺、脾脏、睾丸和肾脏组织,称质量,按下式计算脏器指数[12]。
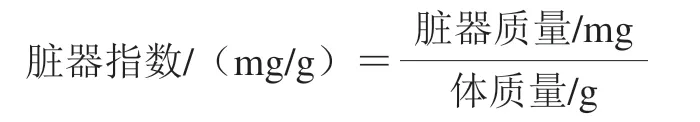
1.3.6 睾丸和肾脏组织形态病理学观察
大鼠脱颈处死后,分别切取合适大小的睾丸和肾脏组织,经4 g/100 mL多聚甲醛溶液固定,用苏木精-伊红(hematoxylin-eosin,HE)染色,观察大鼠睾丸和肾脏组织形态变化。
1.3.7 实时荧光定量PCR检测大鼠睾丸组织P450scc、3β-HSD、StAR和SF-1mRNA相对表达量
大鼠脱颈处死后,取形态病理学观察实验剩余睾丸组织,经液氮速冻后于-80 ℃保存,用于实时荧光定量PCR检测。用试剂盒提取组织中总RNA,PCR条件为:95 ℃孵育10 min;95 ℃变性15 s,55 ℃退火30 s,60 ℃延伸30 s,40 个循环。以GAPDH为内参,计算大鼠睾丸中睾酮合成相关的细胞色素P450胆固醇侧链裂解酶(P450 cholesterol side-chain lyase,P450scc)、3 β-羟基类固醇脱氢酶(3 β-hydroxysteroid dehydrogenase,3β-HSD)、类固醇急性反应蛋白(steroidogenic acute regulatory protein,StAR)和类固醇生成因子1(steroidogenic factor-1,SF-1)mRNA相对表达量。所用引物序列如表1所示。
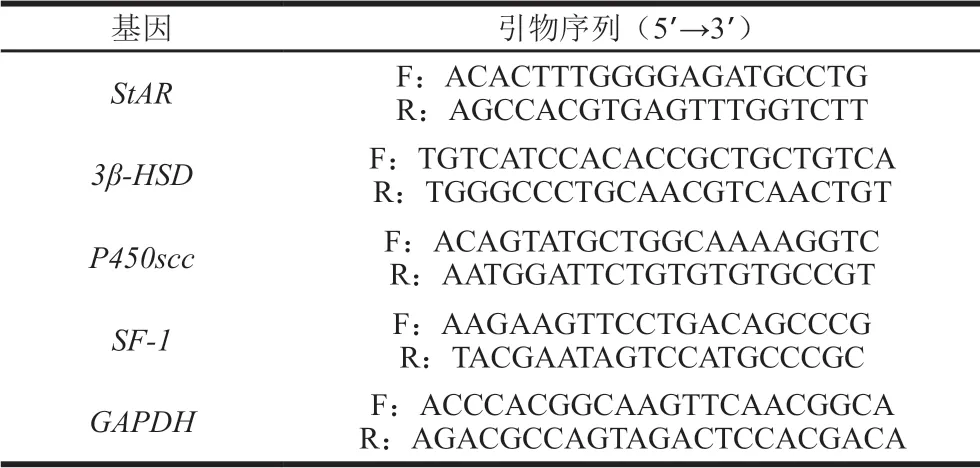
表 1 实时荧光定量PCR引物序列Table 1 Primer sequences used for qPCR
1.4 数据处理与分析
采用SPSS 25.0软件处理数据,结果以平均值±标准差表示;采用组间t-检验进行显著性差异分析,P<0.05表示具有显著性差异;采用Origin 2018软件作图。
2 结果与分析
2.1 紫苏籽蛋白和紫苏籽肽的基本理化性质分析结果
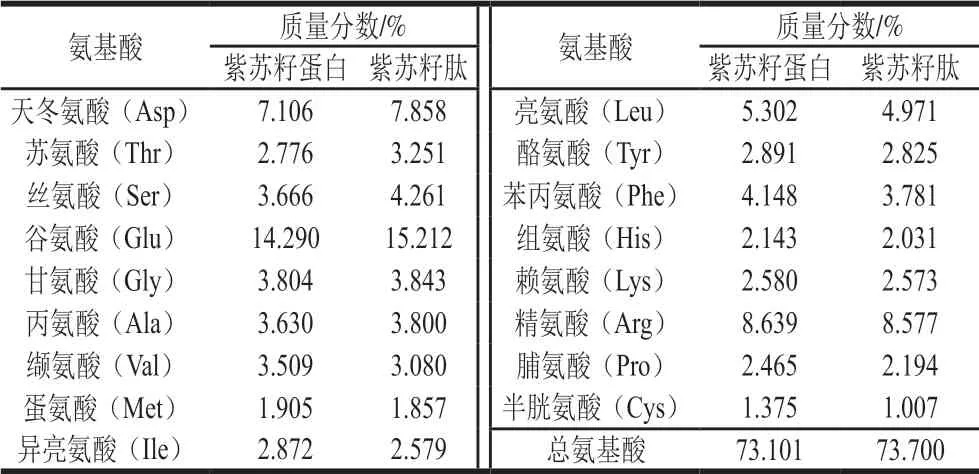
表 2 紫苏籽蛋白和紫苏籽肽的氨基酸组成Table 2 Amino acid compositions of Perilla seed protein and peptide prepared in this study
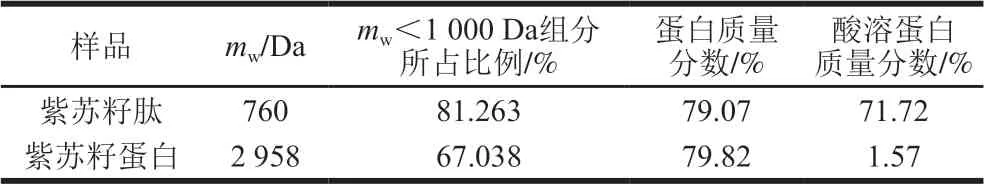
表 3 紫苏籽蛋白和紫苏籽肽的蛋白含量与分子质量分布Table 3 Protein contents and molecular mass distribution of Perilla seed protein and peptide
由表2、3可知,紫苏籽肽和紫苏籽蛋白中富含天冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、缬氨酸、亮氨酸、苯丙氨酸、精氨酸等人体必需氨基酸或功能性氨基酸;紫苏籽肽与紫苏籽蛋白中蛋白质量分数相当,但紫苏籽肽中酸溶蛋白质量分数明显较高,mw<1 000 Da组分所占比例相比于紫苏籽蛋白明显提高。
2.2 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠体质量的影响
由图1可知,紫苏籽蛋白和紫苏籽肽灌胃6 周期间,各组大鼠体质量增加无显著差异;灌胃结束时,精氨酸组大鼠体质量增长量较其余各组明显较高,但并无统计学意义(P>0.05)。
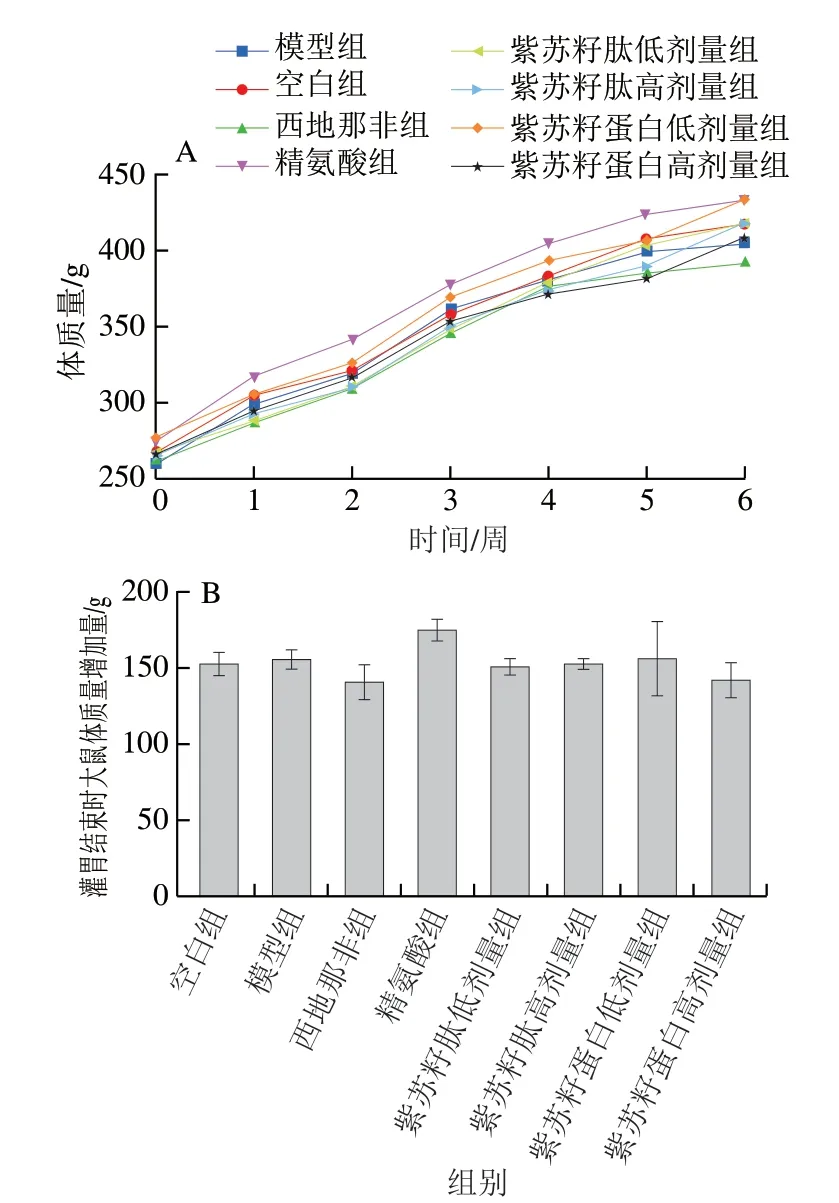
图 1 紫苏籽蛋白和紫苏籽肽灌胃处理期间性功能损伤大鼠体质量变化Fig. 1 Changes in body mass of rats with impaired sexual function during intragastric administration of Perilla seed protein and peptide
2.3 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠血清IL-2、IFN-γ、IgG质量浓度的影响
IL-2和INF-γ是机体重要的免疫调节因子,IgG是血清中主要的免疫球蛋白,通过ELISA法检测大鼠血清中上述指标可以评价大鼠的免疫功能。由图2可知,灌胃结束时,与空白组相比,模型组大鼠血清IL-2、IFN-γ、IgG质量浓度均显著降低(P<0.05),分别为空白组的28.07%、66.22%和92.38%;与模型组相比,西地那非和精氨酸组大鼠血清IL-2、IFN-γ、IgG质量浓度出现不同程度的升高;与模型组相比,除紫苏籽肽低剂量组大鼠血清IFN-γ质量浓度外,其余各处理组大鼠上述指标也均出现不同程度升高。紫苏籽蛋白和紫苏籽肽灌胃6 周后,紫苏籽肽高剂量组大鼠血清IL-2、IFN-γ、IgG质量浓度分别是模型组的1.56、1.15、1.23 倍;紫苏籽蛋白高剂量组大鼠血清IL-2、IFN-γ、IgG水平分别是模型组的2.10、1.31、1.62 倍。由此可知,紫苏籽蛋白和紫苏籽肽能够不同程度地提高环磷酰胺致性功能损伤大鼠血清IL-2、IFN-γ、IgG质量浓度,从而调节大鼠机体免疫。这可能与紫苏籽蛋白和紫苏籽肽中富含苏氨酸、谷氨酸、甘氨酸、亮氨酸、精氨酸等可参与免疫球蛋白合成或可调节机体免疫的氨基酸有关。
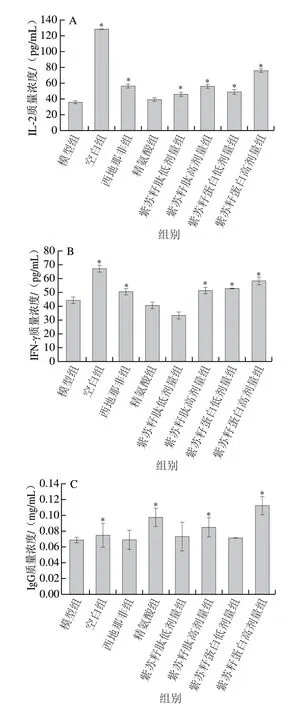
图 2 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠血清IL-2(A)、IFN-γ(B)、IgG质量浓度(C)的影响Fig. 2 Effects of Perilla seed protein and peptide on serum IL-2 (A),IFN-γ (B) and IgG concentrations (C) in rats with impaired sexual function
2.4 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠血清睾酮和游离睾酮浓度的影响
睾酮是雄性动物体内最重要的雄激素,游离睾酮被运送到目标细胞后与雄激素受体结合进而发挥雄激素作用。由图3可知,灌胃结束时,与空白组相比,模型组大鼠血清睾酮和游离睾酮浓度均显著下降(P<0.05),分别是空白组的81.52%和63.99%;与模型组相比,西地那非和精氨酸组大鼠血清睾酮和游离睾酮浓度均显著升高(P<0.05);与模型组相比,除紫苏籽蛋白高剂量组外,其余各处理组大鼠血清睾酮和游离睾酮浓度也均显著升高(P<0.05)。紫苏籽蛋白和紫苏籽肽灌胃6 周后,紫苏籽肽高剂量组睾酮和游离睾酮浓度分别是模型组的1.21 倍和2.01 倍(P<0.05),表明紫苏籽肽可显著提高环磷酰胺致性功能损伤大鼠血清中雄激素水平。这可能与紫苏籽肽中丰富的酪氨酸、丝氨酸、谷氨酸和精氨酸以及支链氨基酸的促睾酮分泌活性有关[13-14]。
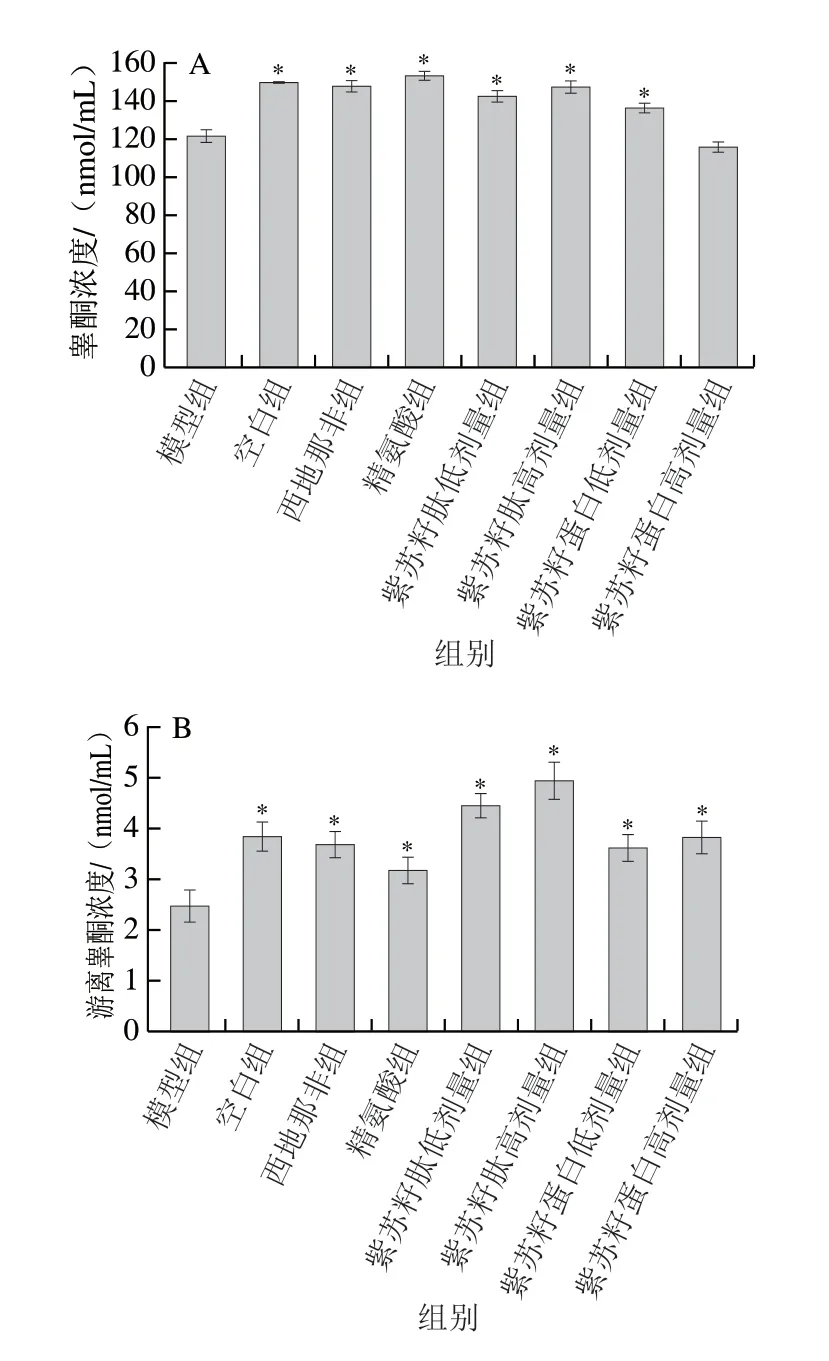
图 3 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠血清睾酮(A)和游离睾酮浓度(B)的影响Fig. 3 Effects of Perilla seed protein and peptide on serum testosterone (A)and free testosterone concentration (B) in rats with impaired sexual function
2.5 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠血清LH和FSH质量浓度的影响
LH和FSH可以促进睾酮的合成和精子产生,对二者联合检测可以判断睾丸功能。由图4可知,灌胃结束时,与空白组相比,模型组大鼠血清LH和FSH质量浓度显著下降(P<0.05),分别是空白组的28.54%和86.49%;与模型组相比,西地那非和精氨酸组大鼠血清LH质量浓度出现不同程度的升高,FSH质量浓度没有显著变化(P>0.05)。紫苏籽蛋白和紫苏籽肽灌胃6 周后,与模型组相比,紫苏籽肽低、高剂量组大鼠血清LH和FSH质量浓度均显著升高(P<0.05),紫苏籽肽高剂量组大鼠血清LH和FSH质量浓度分别是模型组的3.93 倍和1.16 倍;与模型组相比,紫苏籽蛋白低、高剂量组大鼠仅血清LH质量浓度显著升高(P<0.05),且提升效果弱于高剂量紫苏籽肽,血清FSH质量浓度没有显著变化(P>0.05),这可能与支链氨基酸维持和提高中枢神经兴奋,促进激素分泌有关[14]。
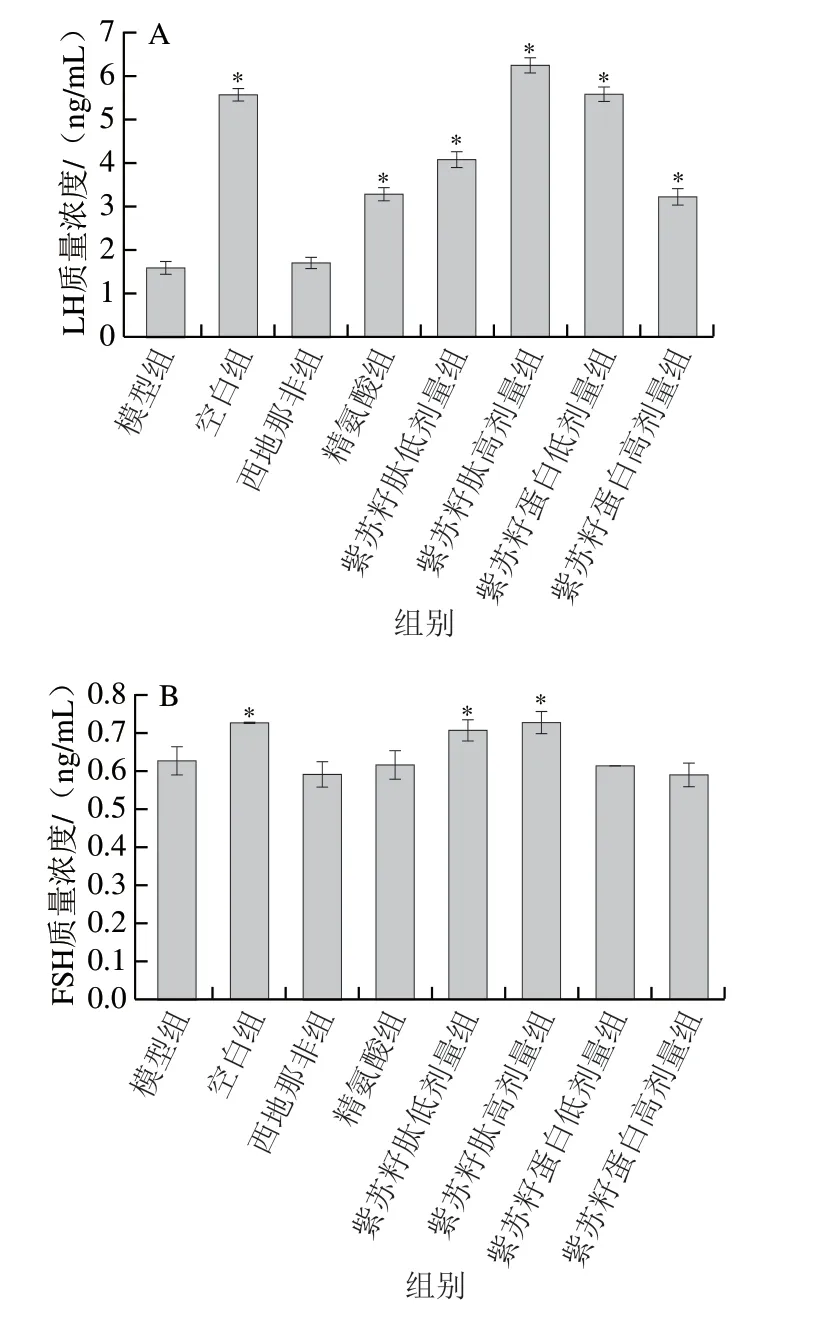
图 4 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠LH(A)和FSH(B)质量浓度的影响Fig. 4 Effects of Perilla seed protein and peptide on serum LH (A) and FSH (B) concentration in rats with impaired sexual function
2.6 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠肾脏和睾丸SOD活力和MDA含量的影响
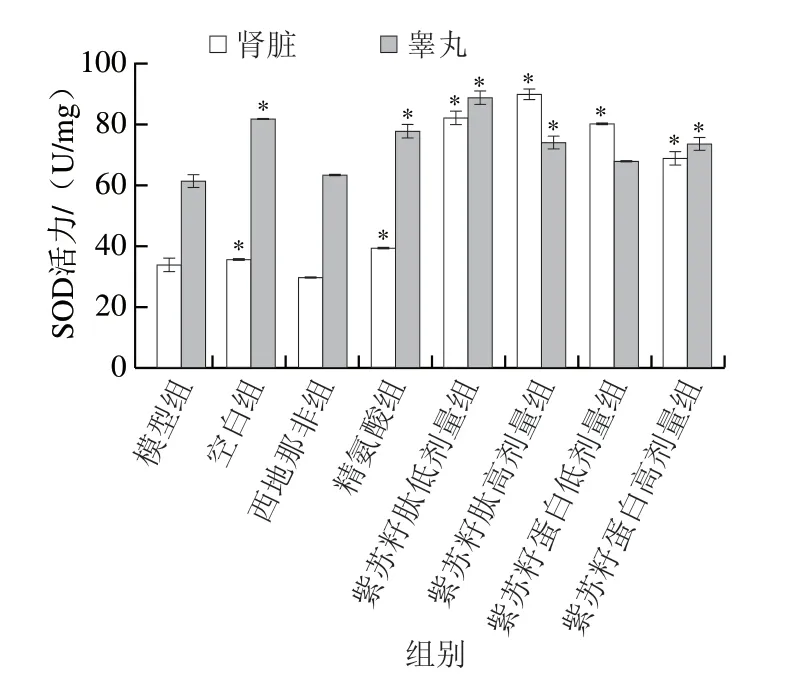
图 5 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠肾脏和睾丸SOD活力的影响Fig. 5 Effects of Perilla seed protein and peptide on SOD activity in kidney and testis of rats with sexual function impairment
SOD活力和MDA含量是机体重要的抗氧化指标,可以反映机体的抗氧化能力和氧化损伤程度。由图5可知,灌胃结束时,与空白组相比,模型组大鼠肾脏和睾丸中SOD活力均显著降低(P<0.05),分别是空白组的94.55%和75.25%;与模型组相比,精氨酸组大鼠肾脏和睾丸SOD活力均显著提高(P<0.05),但西地那非组大鼠SOD活力并无显著变化(P>0.05)。紫苏籽蛋白和紫苏籽肽灌胃6 周后,与模型组相比,各处理组大鼠肾脏和睾丸SOD活力均出现不同程度提高,其中紫苏籽肽高剂量组大鼠肾脏和睾丸的SOD活力分别是模型组的2.65 倍和1.20 倍,紫苏籽蛋白高剂量组大鼠肾脏和睾丸SOD活力分别是模型组的2.03 倍和1.19 倍,表明高剂量的紫苏籽蛋白和紫苏籽肽均可显著提高环磷酰胺致性功能损伤大鼠肾脏和睾丸的SOD活力(P<0.05),增强大鼠机体抗氧化能力,这可能与精氨酸对SOD活性的激活作用有关[15]。
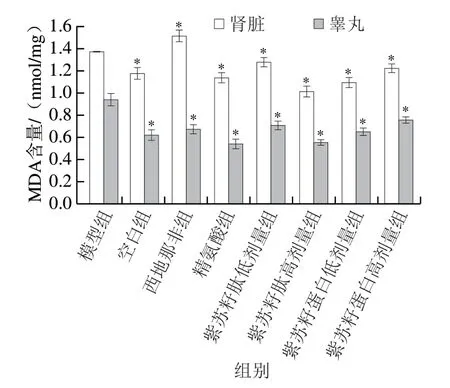
图 6 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠肾脏和睾丸MDA含量的影响Fig. 6 Effects of Perilla seed protein and peptide on MDA contents in kidney and testis of rats with sexual function impairment
由图6可知,灌胃结束时,与空白组相比,模型组大鼠肾脏和睾丸中MDA含量均显著增加(P<0.05),分别是空白组的1.17 倍和1.52 倍;与模型组相比,精氨酸组大鼠肾脏和睾丸中MDA含量均显著降低(P<0.05),而西地那非组大鼠睾丸中MDA含量相比于模型组显著降低,但肾脏中MDA含量却显著升高(P<0.05)。紫苏籽蛋白和紫苏籽肽灌胃6 周后,与模型组相比,各处理组大鼠肾脏和睾丸中MDA含量均显著降低(P<0.05),其中紫苏籽肽高剂量组大鼠肾脏和睾丸MDA含量分别是模型组的0.74 倍和0.58 倍,紫苏籽蛋白高剂量组大鼠肾脏和睾丸MDA含量分别是模型组的0.80 倍和0.69 倍,表明紫苏籽蛋白和紫苏籽肽均可显著降低环磷酰胺致性功能损伤大鼠肾脏和睾丸中MDA含量,减轻脂质过氧化程度,这可能与紫苏籽蛋白和紫苏籽肽中半胱氨酸、精氨酸、亮氨酸等参与自由基清除反应,以及谷氨酸、精氨酸等极性氨基酸通过侧链螯合作用抑制自由基氧化反应有关[16]。
2.7 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠睾丸组织P450scc、3β-HSD、StAR和SF-1 mRNA表达量的影响
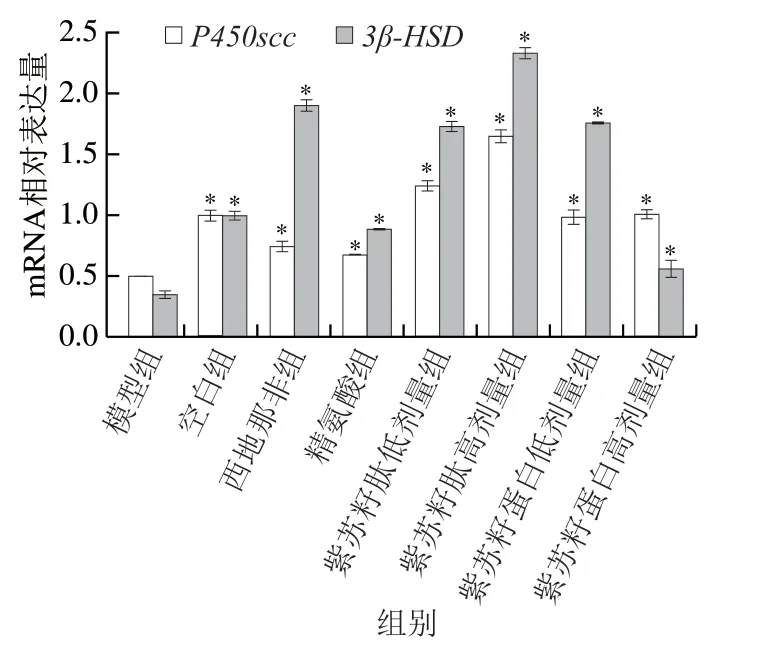
图 7 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠睾丸组织P450scc和3β-HSD mRNA相对表达量的影响Fig. 7 Effects of Perilla seed protein and peptide on relative expression of P450scc and 3β-HSD mRNA in testis tissue of rats with impaired sexual function
由图7可知,灌胃结束时,与空白组相比,模型组大鼠睾丸中P450scc和3β-HSDmRNA相对表达量均显著降低(P<0.05),分别是空白组的50.17%和34.88%;与模型组相比,西地那非和精氨酸组大鼠睾丸中P450scc和3β-HSDmRNA相对表达量均显著升高(P<0.05);紫苏籽蛋白和紫苏籽肽灌胃6 周后,与模型组相比,各处理组大鼠睾丸中P450scc和3β-HSDmRNA相对表达量也均显著升高(P<0.05),其中紫苏籽肽高剂量组大鼠睾丸中P450scc和3β-HSDmRNA相对表达量分别是模型组的3.30 倍和6.71 倍,紫苏籽蛋白虽然也能够提高这2 种基因的表达水平,但作用效果弱于紫苏籽肽,说明紫苏籽蛋白和紫苏籽肽均可通过提高睾酮生成过程中关键酶的mRNA表达水平,从而促进睾酮合成。
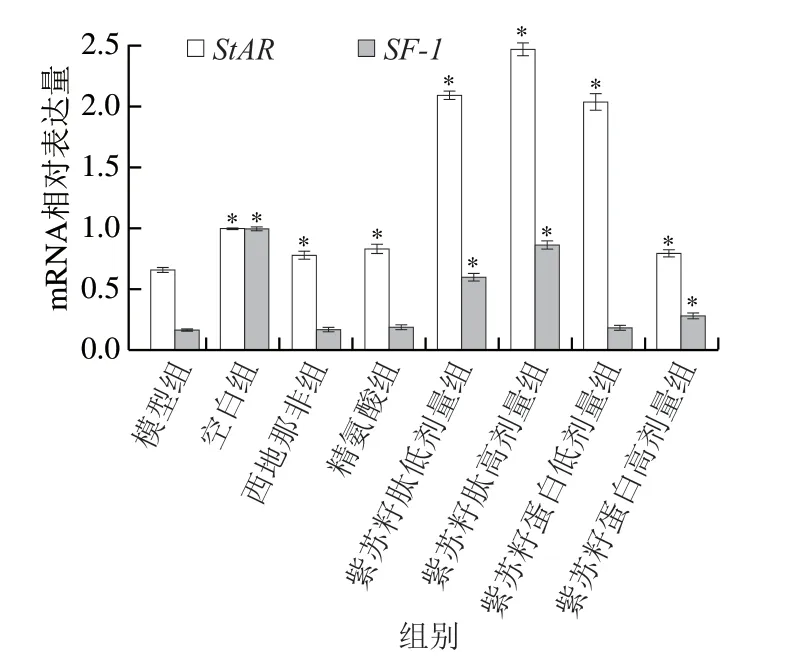
图 8 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠睾丸组织StAR和SF-1 mRNA相对表达量的影响Fig. 8 Effects of Perilla seed protein and peptide on relative expression of StAR and SF-1 mRNA in testis tissue of rats with impaired sexual function
由图8可知,灌胃结束时,与空白组相比,模型组大鼠睾丸中StAR和SF-1mRNA相对表达量均显著降低(P<0.05),分别是空白组的66.06%和17.17%;与模型组相比,西地那非和精氨酸组大鼠睾丸中StARmRNA相对表达量均显著升高(P<0.05),但SF-1mRNA相对表达量无显著变化;紫苏籽蛋白和紫苏籽肽灌胃6 周后,与模型组相比,各处理组大鼠StARmRNA相对表达量均显著升高(P<0.05),其中紫苏籽肽高剂量组大鼠睾丸中StAR和SF-1mRNA相对表达量分别是模型组的3.74 倍和5.50 倍。紫苏籽蛋白虽然也能够提高这2 种基因的表达水平,但作用效果弱于紫苏籽肽。
2.8 紫苏籽蛋白和紫苏籽肽对性功能损伤大鼠脏器指数的影响
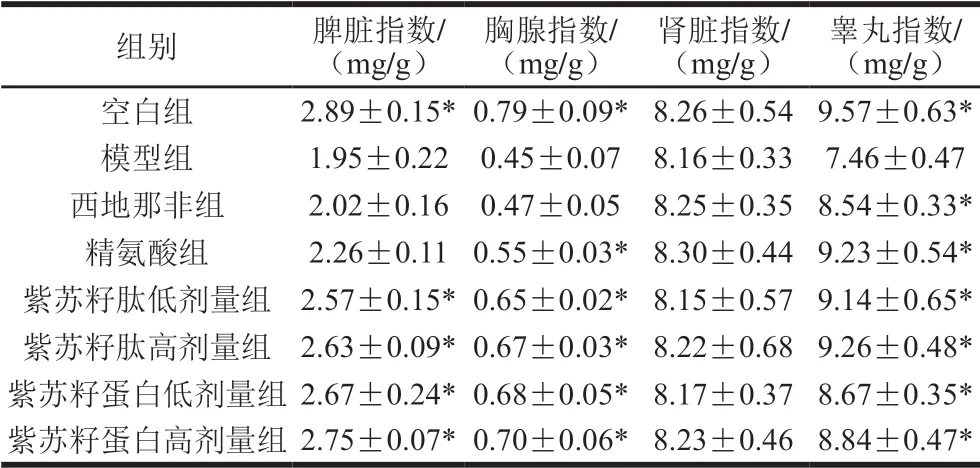
表 4 紫苏籽蛋白和紫苏籽肽处理对性功能损伤大鼠脏器指数的影响Table 4 Effects of Perilla seed protein and peptide on organ indexes in rats with impaired sexual function
由表4可知,灌胃结束时,与空白组相比,模型组大鼠的脾脏、胸腺和睾丸指数均显著降低(P<0.05),分别为空白组的67.47%、56.96%和77.95%,肾脏指数无显著变化;与模型组相比,西地那非组大鼠仅睾丸指数显著提高,而精氨酸组大鼠除睾丸指数外,胸腺指数也显著提高(P<0.05);紫苏籽蛋白和紫苏籽肽灌胃6 周后,与模型组相比,紫苏籽肽和紫苏籽蛋白均可显著提高大鼠免疫器官(脾脏和胸腺)指数(P<0.05),且高剂量灌胃下的作用效果较为显著,其中紫苏籽肽高剂量组大鼠脾脏和胸腺指数分别是空白组的91.00%和84.81%;紫苏籽蛋白高剂量组大鼠脾脏和胸腺指数分别是空白组的95.16%和88.61%,表明紫苏籽蛋白和紫苏籽肽均可通过提高免疫器官指数调节机体免疫。此外,各处理组大鼠肾脏指数与模型组相比均没有显著变化。高、低剂量的紫苏籽肽均可以显著提升性功能损伤大鼠睾丸指数,分别达到空白组的95.51%和96.77%,紫苏籽蛋白的提高效果略弱于紫苏籽肽,表明紫苏籽蛋白和紫苏籽肽均可通过提高睾丸指数调节环磷酰胺致性功能损伤大鼠的睾丸功能。
2.9 HE染色观察大鼠肾脏和睾丸形态学变化
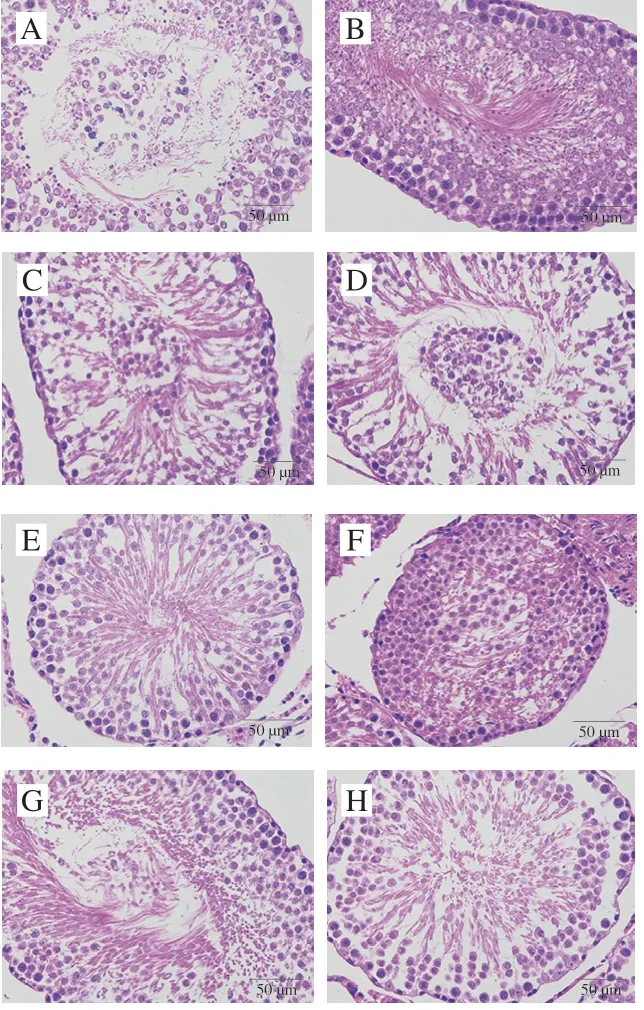
图 9 紫苏籽蛋白和紫苏籽肽处理大鼠睾丸HE染色图像Fig. 9 HE stained image of testis tissue of rats treated with Perilla seedprotein and peptide
由图9可知,空白组大鼠生精小管基膜完整,生精上皮较厚,生精细胞层次和数量丰富,大量生精细胞和支持细胞排列紧密有序,形态规则正常,管腔形状规则,管腔中可见大量精细胞;模型组大鼠生精小管的生精上皮变薄,生精细胞数量锐减,支持细胞排列稀疏,部分生精细胞脱落至管腔中,管腔中形成明显空腔,精细胞和成熟精子数量明显减少;紫苏籽肽和紫苏籽蛋白低、高剂量组大鼠生精小管损伤情况明显得到改善,生精细胞大量增加,排列紧密整齐有序,空腔明显减小。
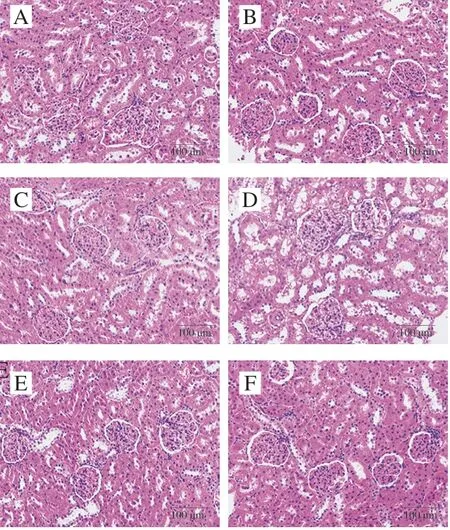
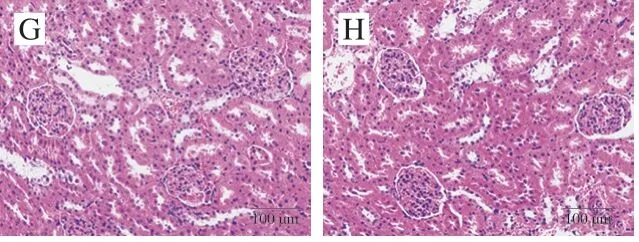
图 10 紫苏籽蛋白和紫苏籽肽处理大鼠肾脏HE染色图像Fig. 10 HE stained image of kidney tissue of rats treated with Perilla seed protein and peptide
由图10可知,空白组大鼠肾小囊腔明显,血管球形态正常,基膜完整,球旁细胞和致密斑明显,肾小管形态正常;模型组大鼠肾小体肿胀增大变形,球内细胞增加,肾小囊腔变小,毛细血管间隙增大;紫苏籽肽和紫苏籽蛋白低、高剂量组大鼠肾小体肿大变形得到一定程度的改善,但仍与空白组有差异。
3 讨 论
食物蛋白在酶解过程中可以产生一些小肽,除作为营养因子外,还具有调节机体生理功能的作用。肽的吸收速率快、耗能低、不易饱和,且不同肽之间的运转无竞争性与抑制性[17]。肽的结构特性如链长、氨基酸组成等决定了其功能活性[18]。此外,肽还具有较好的酸、热稳定性、水溶性等优点,适宜作为功能因子应用于不同食品[19]。
本实验制备的紫苏籽肽和紫苏籽蛋白富含某些功能性氨基酸。例如,天冬氨酸可以参与核苷酸代谢,促进细胞周期进程[20];苏氨酸是免疫球蛋白中最丰富的必需氨基酸[21];谷氨酸可用于合成参与免疫反应的蛋白以及作为核苷酸合成的能量底物;甘氨酸可以减轻炎症反应,调节机体免疫[22];亮氨酸及其代谢产物可通过提高血清中IgG和IgM水平,降低可溶性分化簇4和分化簇8含量,增强机体特异性免疫;精氨酸通过精氨酸酶途径和NO合成途径参与免疫调控以及精子生成[23-24];脯氨酸通过其代谢产物5-吡咯啉羧酸调控细胞增殖和DNA合成,并影响促进精子生成的多胺类物质的合成。紫苏籽肽的分子质量远小于其蛋白,蛋白中的活性序列在酶解过程中得到充分释放,更有利于机体吸收和发挥作用。
由于环磷酰胺在产生生殖毒性的同时还可以造成免疫抑制,本实验检测了大鼠血清IL-2、IFN-γ、IgG质量浓度。IL-2是调节机体免疫功能最主要的淋巴因子之一。INF-γ是活化T淋巴细胞产生的一种细胞因子,对免疫系统具有重要的调节作用[25]。IgG是血清中含量最高的免疫球蛋白[26]。ELISA法检测结果显示,紫苏籽肽和紫苏籽蛋白均能显著改善环磷酰胺致性功能损伤大鼠血清IL-2、INF-γ、IgG质量浓度以及脾脏和胸腺指数的降低,说明紫苏籽肽和紫苏籽蛋白可能具有增强免疫的作用。
睾丸受到多种细胞因子的调控,具有精子生成和睾酮合成两大功能[27]。睾丸间质细胞经一系列活动合成睾酮[28],睾酮合成以胆固醇为原料,StAR可以加速胆固醇从线粒体膜外转运到膜内[29-30],随后在P450scc和3β-HSD等酶的催化下转变为睾酮[31]。SF-1可控制类固醇基因的特定转录[32]。紫苏籽肽和紫苏籽蛋白均可改善环磷酰胺致性功能损伤大鼠睾丸中睾酮合成相关基因StAR、P450scc、3β-HSD和SF-1表达水平下降的状况,且紫苏籽肽的作用效果更加明显。睾酮负责维持男性的精子生成和第二性征,血清睾酮水平不足可造成肌肉质量下降、体质量增加、勃起功能障碍、疲劳程度加剧和性欲低下等症状[33]。紫苏籽肽可显著提高性功能损伤大鼠血清中雄激素水平,且紫苏籽肽的作用效果较紫苏籽蛋白明显。睾丸中LH与其受体结合[34],作用于睾丸间质细胞,刺激睾酮合成;FSH作用于支持细胞,促进精子形成[35]。FSH和LH是睾丸功能必不可少的调节因子[36]。紫苏籽肽可显著提高大鼠血清LH和FSH浓度,改善大鼠睾丸功能低下的状况。
机体中过量的活性氧自由基可导致细胞损伤及线粒体功能障碍,还可与精子膜脂质中的多不饱和脂肪酸发生脂质过氧化反应,损伤精子膜,引起精子核DNA损伤,使精子活力下降甚至功能丧失[37];还可以破坏类固醇生成途径的组成部分[38],造成肌肉力量下降和性欲下降。SOD是细胞清除超氧阴离子自由基的特异性酶,MDA是脂质过氧化反应的最终产物,MDA含量可以间接反映细胞和机体的脂质过氧化程度[39]。紫苏籽肽可显著提高大鼠睾丸和肾脏中SOD活力,降低MDA含量,紫苏籽蛋白作用效果略低于紫苏籽肽。HE染色结果显示,紫苏籽肽和紫苏籽蛋白还可以改善大鼠睾丸和肾脏组织的病理状况,进而维持其正常生理功能。
综上所述,干预期间紫苏籽肽和紫苏籽蛋白对大鼠体质量没有显著影响,可以改善环磷酰胺致性功能损伤大鼠睾丸和肾脏的病理状态,提高脏器指数,显著改善肾脏、睾丸的氧化应激状态和睾丸功能。紫苏籽肽可以提高大鼠睾丸中睾酮生成相关基因mRNA表达水平,提高血清中雄激素水平,表明紫苏籽肽可以改善大鼠生殖损伤状况,从而达到改善大鼠性功能损伤的作用。紫苏籽蛋白的作用效果普遍低于紫苏籽肽,这与紫苏籽肽的分子质量小、易于被机体吸收以及活性序列得到充分释放有关。另外,紫苏籽肽和紫苏籽蛋白还显示出一定的免疫改善作用,提示其可能具有增强免疫的作用,需要进一步验证和讨论。
