两种乳酸杆菌对肥胖小鼠的干预作用
2021-03-31张保杰文佳嘉胡婕伦聂少平谢明勇
王 苗,张保杰,文佳嘉,胡婕伦,聂少平,谢明勇
(南昌大学 食品科学与技术国家重点实验室,中国-加拿大食品科学技术联合实验室,江西 南昌 330047)
肥胖是一种由多种危险因素(包括遗传)引起的体内脂质过多的代谢综合征[1]。近几年,肥胖的发病率快速增加,大量流行病学调查显示,肥胖是多种慢性疾病(如2型糖尿病、高血压、心脑血管疾病、子宫内膜癌、乳腺癌等)的潜在诱因,全球死于肥胖及其继发慢性代谢性疾病的人数与日俱增[2-4]。肥胖发生过程历时较长,主要原因在于机体长期的能量摄入过多和代谢水平降低,继而对脂肪的利用能力下降并导致脂肪在体内蓄积[5]。
目前干预和治疗肥胖的方法主要有以下几种:轻度肥胖时,可通过膳食干预(调整饮食结构)和运动干预(有效减少热量的摄入以及通过一些运动等方式使能量的支出增加),这是临床上和生活中尤为基础的方法[6]。当肥胖症状严重到一定程度时,即体质量指数(body mass index,BMI)超过27 kg/m2或30 kg/m2且伴随肥胖并发症时,需要使用药物进行辅助治疗[7]。此外,肥胖外科手术也是减肥治疗的一种常见方式,如国际糖尿病联合会建议,对于BMI在30~35 kg/m2之间且一般药物不能控制的人群,可采用外科手术方法[8]。随着科技进步和经济发展,近年来也出现一些比较新颖的减肥手段,如基因定向治疗、靶点治疗、粪菌移植等[9-10]。以上的减肥方式均存在一定的风险和不确定性。例如传统的药物治疗会对人的神经系统及肾脏造成一定的损伤[11];减肥手术存在一定的风险,且对身体影响较大;有些新颖的减肥方式缺乏充足的临床实验,安全性还有待进一步深究。因此,科学的膳食搭配加上适当的运动是目前较有效地维持和减轻体质量的健康生活方式[12]。
益生菌是活的微生物(在大多数情况下是细菌),这些细菌通常也被称为友善的、有益的或健康的细菌,与人类肠道中发现的有益微生物相似,可以帮助预防和治疗某些疾病。含有益生菌的食物、饮料(果汁、大豆饮料)和膳食补充剂(例如胶囊、片剂和散剂)等已被人们广泛利用[13-14]。随着对一些乳酸杆菌(例如嗜酸乳杆菌、保加利亚乳杆菌、鼠李糖乳杆菌、植物乳杆菌、罗伊氏乳杆菌、干酪乳杆菌、双歧乳杆菌)研究的深入,乳酸杆菌不仅在发酵食品和膳食补充剂中得以广泛应用,而且也被用于治疗和预防多种疾病和病症[15-16],包括预防肥胖和糖尿病的发生[17-18]。以往的研究表明,双歧杆菌、鼠李糖乳杆菌、加氏乳杆菌、植物乳杆菌、副干酪乳杆菌等益生菌均能发挥降脂缓解肥胖作用[19-21]。同时,不同类型益生菌干预肥胖的研究结果可能会因实验方法、摄入剂量、持续时间和干预人群等不同而存在差异性[22]。因此,本实验以C57BL/6J小鼠为研究对象,利用高脂饮食诱导的肥胖模型,探讨干酪乳杆菌NCU011054(Lactobacillus caseiNCU011054)以及嗜酸乳杆菌NCU433(Lactobacillus acidophilusNCU433)对高脂饮食诱导肥胖小鼠的干预作用,以期为肥胖人群的饮食策略提供新的思路和参考依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级6 周龄雄性C57BL/6J小鼠(动物使用许可证号:SYXK(赣)2015-0001)、普通维持饲料购自湖南斯莱克景达实验动物有限公司;45%高脂饲料D12451购自美国Research Diets公司;两种乳杆菌菌粉(Lactobacillus caseiNCU011054、Lactobacillus acidophilusNCU433)取自南昌大学食品科学与技术国家重点实验室。
4 mm研磨珠(氧化锆)武汉塞维尔生物科技公司;磷酸盐缓冲液(phosphate buffered saline,PBS)片剂北京索莱宝生物科技有限公司;质量分数4%多聚甲醛固定液(含焦碳酸二乙酯(diethyl pyrocarbonate,DEPC))、小鼠胆固醇(cholesterol,TC)、甘油三酯(triglyceride,TG)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malonic dialdehyde,MDA)、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒南京建成生物科技有限公司;小鼠瘦素、脂联素测定试剂盒上海抚生实业有限公司。
1.2 仪器与设备
AB-104电子天平 瑞士梅特勒-托利多公司;3K15高速冷冻离心机 德国Sigma公司;ACCU-CHEK Performa血糖仪、配套血糖试纸 瑞士Roche公司;高速组织研磨仪 武汉赛维尔生物科技有限公司;BS500型全自动生化分析仪 深圳迈瑞生物医疗电子股份有限公司;多功能酶标仪美国Thermo Scientific公司。
1.3 方法
1.3.1 菌株的制备
将两种乳杆菌粉末通过平板计数法计算活菌数后,将其稀释在无菌生理盐水中至指定剂量(1×109、1×1010CFU/mL)。
1.3.2 动物实验设计与分组
72 只C57BL/6J小鼠适应1 周后,随机分为6 组,分别为正常饮食组(ND)、高脂饮食对照组(HFD)、Lactobacillus caseiNCU011054低剂量组(LCL)、Lactobacillus caseiNCU011054高剂量组(LCH)、Lactobacillus acidophilusNCU433低剂量组(LAL)、Lactobacillus acidophilusNCU433高剂量组(LAH)。低剂量组菌粉剂量为1×109CFU/mL,高剂量组菌粉剂量为1×1010CFU/mL。小鼠饲养期间自由采食饮水,每天按10 mL/kgmb给小鼠灌胃菌粉悬浮液,ND和HFD组小鼠则用对应体积的生理盐水灌胃。9 周后处死小鼠,取样。
1.3.3 样品采集和检测
1.3.3.1 常规指标的测定
每周称量一次小鼠体质量,计算出实验期间小鼠体质量增量,小鼠处死后测量小鼠体长(体长为鼻尖至肛门的距离),并记录数据。解剖小鼠后,取出附睾脂肪、腹腔脂肪、肝脏、肾脏等称质量,分别按公式(1)、(2)计算Lee’s指数及相应的器官指数。

1.3.3.2 空腹血糖浓度的测定
第9周时,采用血糖仪测定各组小鼠的空腹血糖浓度。
1.3.3.3 血清生化指标水平的测定
灌胃期结束后,眼眶取血,在4 ℃条件下3 000 r/min离心15 min,取上层血清,得到血清样本。取各组小鼠血清样本,采用全自动生化仪测定TC、TG、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,L D L-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(glutamic-pyruvic transaminase,AST)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、肌酐(creatinine,CREA)、尿酸(uric acid,UA)、尿素的水平。
1.3.3.4 血清瘦素和脂联素质量浓度的测定
灌胃期结束后,眼眶取血,在4 ℃条件下3 000 r/min离心15 min,取上层血清并采用相应试剂盒检测小鼠血清中瘦素和脂联素的质量浓度。
1.3.3.5 脂肪组织病理学分析
取小鼠白色脂肪组织约50 mg,置于质量分数4%多聚甲醛固定液中固定24 h以上,常规石蜡包埋和切片,并采用苏木精-伊红染色,随后显微镜观察白色脂肪细胞形态以及细胞分化情况。
1.3.3.6 肝脏甘油三酯和胆固醇含量测定
称取小鼠肝脏40 mg,加入4 mm研磨珠(氧化锆),按1∶9(m/V)的比例加入预冷的PBS,高速研磨后3 000 r/min离心15 min,取出上清液,采用试剂盒进行测定。
1.3.3.7 肝脏抗氧化水平测定
将肝脏制成10%的组织匀浆,采用试剂盒依次检测肝脏组织匀浆中GSH-Px、SOD、CAT活力、MDA水平和T-AOC。
1.3.3.8 粪便短链脂肪酸水平测定
取50 mg结肠内容物,置于冰浴,按1∶9(m/V)加入超纯水,漩涡振荡直至混匀,超声5 min,4 ℃下4 800×g离心20 min,取上清液,沉淀物按1∶7(m/V)加入超纯水,漩涡混匀后超声5 min,4 ℃下4 800×g离心20 min,合并上清液,测定pH值,上清液用于测定短链脂肪酸(short-chain fatty acids,SCFAs)。参照Hu Jielun等[23]的方法进行测定。
1.4 数据统计分析
实验数据采用GraphPad Prism 6.01软件进行数据分析以及图像处理,数据以平均值±标准差表示,组间显著性差异分析采用单因素方差分析法,组间的两两比较采用Tukey’s法,P<0.05定义为存在显著性差异。
2 结果与分析
2.1 两种乳杆菌对肥胖小鼠表观肥胖度的影响
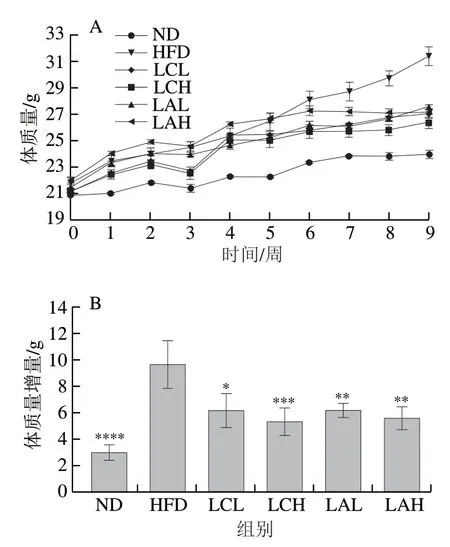
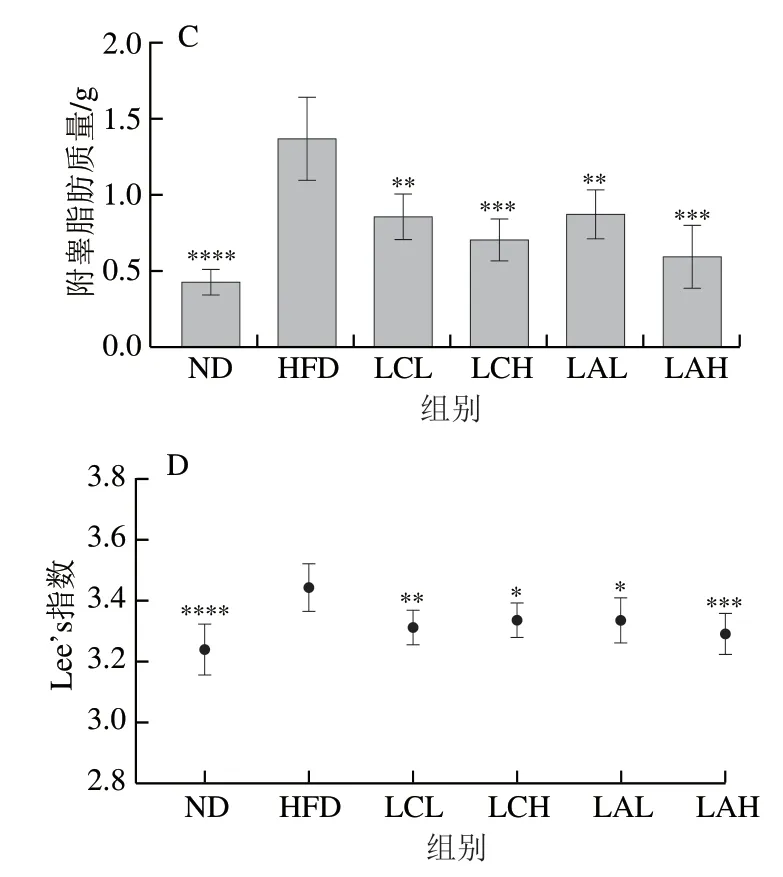
图 1 两种乳杆菌对肥胖小鼠体质量变化趋势(A)、体质量增量(B)、附睾脂肪质量(C)和Lee’s指数(D)的影响Fig. 1 Effect of Lactobacillus strains on body mass (A), body mass gain (B),epididymal fat mass (C) and Lee’s index (D) of obese mice
由图1A可知,与ND组相比,HFD组体质量增长趋势呈稳步上升趋势。与HFD组相比,菌粉组的体质量增长速率较慢。由图1B可知,到实验周期结束时,ND、LC、LA各剂量组的体质量增量显著低于HFD组,HFD组的平均体质量增量比ND组高6.645 g(超出20%),这表明本研究中的肥胖模型建模成功。此外,两菌粉高剂量组的体质量增量比低剂量组小。由图1C可知,ND、LC、LA组的附睾脂肪质量都显著低于HFD组,且两菌粉组还呈现一定的剂量依赖性,由此可见,这两株乳酸杆菌能较好地抑制由高脂饮食引起的附睾脂肪组织增长作用。Lee’s指数是一项评价动物肥胖程度的指标,其越大表明动物的肥胖程度越高。由图1D可知,HFD组的Lee’s指数显著高于ND组和LC、LA组,其中LAH组和ND组的Lee’s指数更接近,表明LAH组更趋于正常。此外,研究表明Lactobacillus paracaseisubsp.paracaseiM5及Lactobacillus coryniformissubsp.torquensT3L能显著降低小鼠体质量、体脂率及Lee’s指数[24],这与本研究结果一致。
2.2 两种乳杆菌对肥胖小鼠空腹血糖和血脂的影响
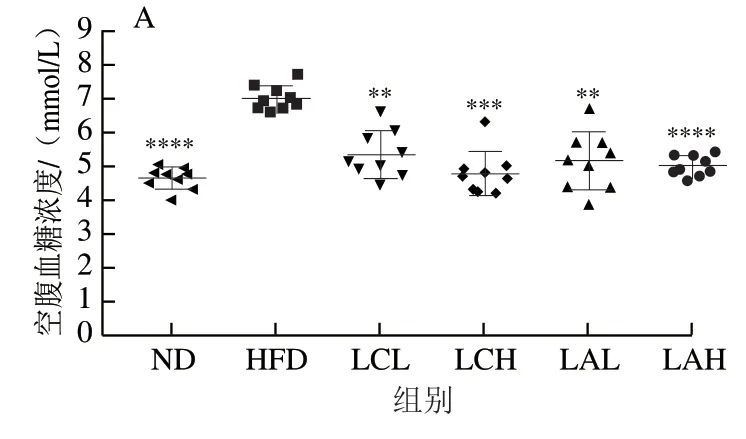
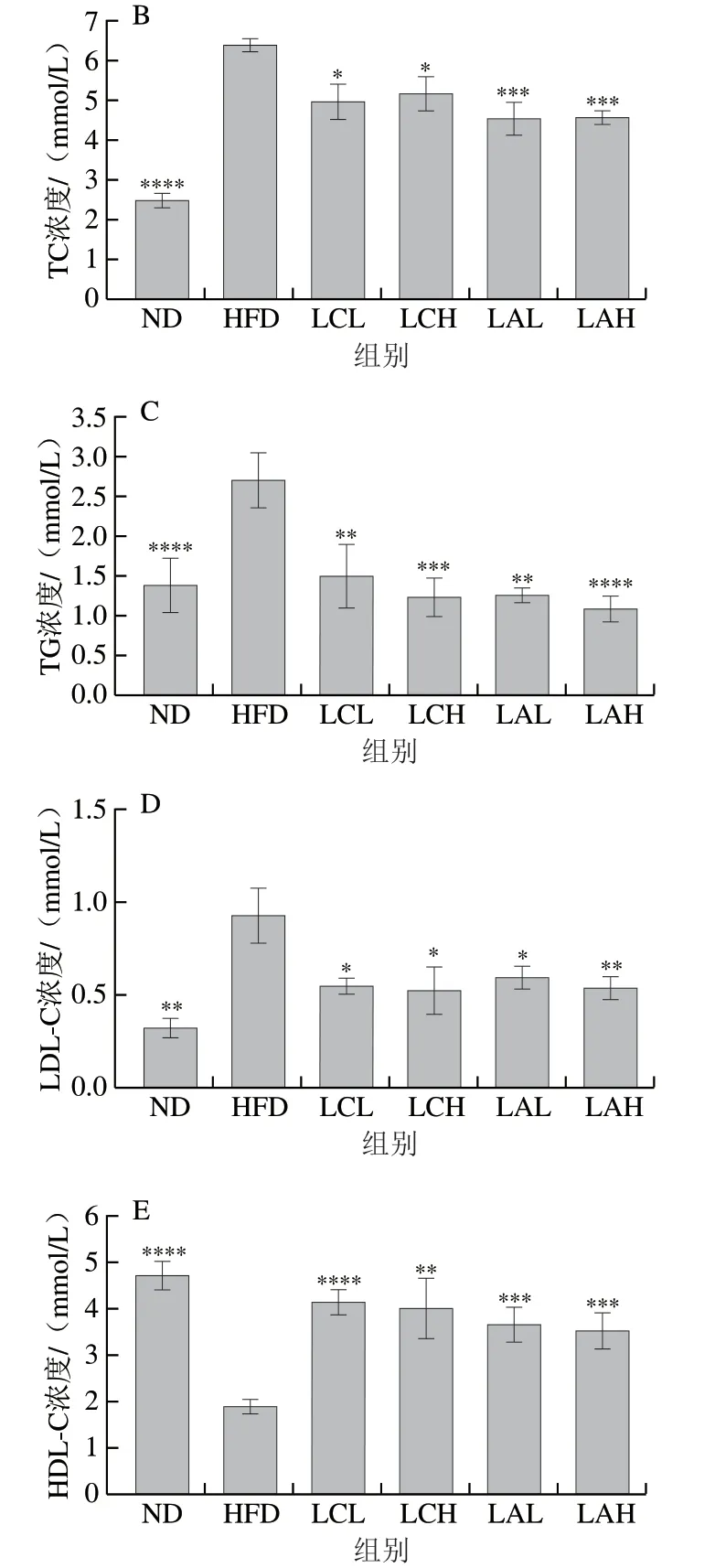
图 2 乳杆菌对肥胖小鼠空腹血糖(A)、TC(B)、TG(C)、LDL-C(D)和HDL-C(E)浓度的影响Fig. 2 Effect of Lactobacillus strains on fasting blood glucose (A),TC (B), TG (C), LDL-C (D) and HDL-C (E) in obese mice
长期摄入高脂膳食使机体处于肥胖状态会引起机体糖脂代谢紊乱,初步表现为机体空腹血糖浓度升高,血清TC、TG、LDL-C水平升高,HDL-C水平下降。由图2A可知,灌胃菌粉9 周后,HFD组小鼠的空腹血糖浓度显著高于ND组和LC、LA各剂量组,其中LC、LA菌粉组均呈现一定的剂量依赖性,且LAH组的空腹血糖浓度与ND组最接近。此外,HFD组的血清TC、TG、LDL-C水平均显著高于ND组,而HDL-C水平显著低于ND组,与此同时,LC、LA两菌粉组的血清TC、TG、LDL-C浓度均显著低于HFD组,HDL-C水平显著高于HFD组(图2B~E);整体结果显示菌粉组对肥胖小鼠的空腹血糖浓度和血脂有很好的干预作用,且菌粉LCH和LAH组能将血清TG和LDL-C降至和ND组相近水平。LAH组的空腹血糖浓度以及血清TG和LDL-C水平与ND组接近,且LAH组能改善小鼠血清TC和HDL-C水平。由此可知,菌粉组的效果呈现一定剂量依赖性,两株菌粉对肥胖小鼠的空腹血糖浓度和血脂水平都有一定的调节作用,Zhao Xin等[25]的研究结果显示植物乳杆菌CQPC02能够降低肥胖小鼠血清TC、TG、LDL-C水平,升高HDL-C水平,这与本研究结果一致。
2.3 乳杆菌对肥胖小鼠肝脏和肾脏功能的影响
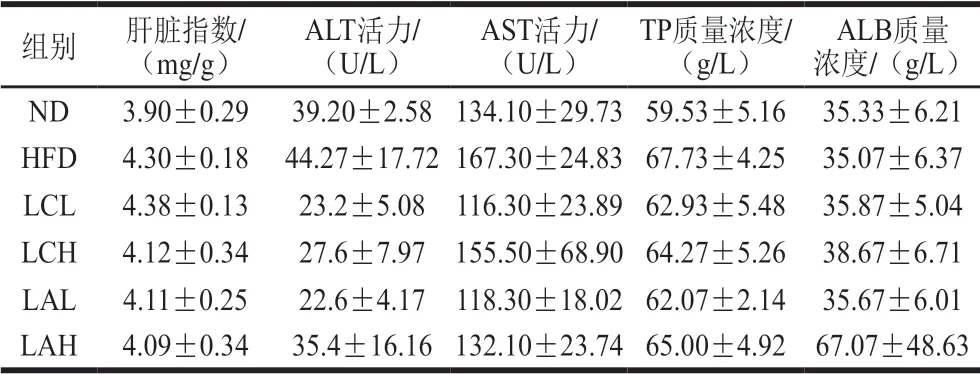
表 1 乳杆菌对肥胖小鼠肝脏指数及肝功能指标的影响Table 1 Effect of Lactobacillus strains on liver index and liver function in obese mice
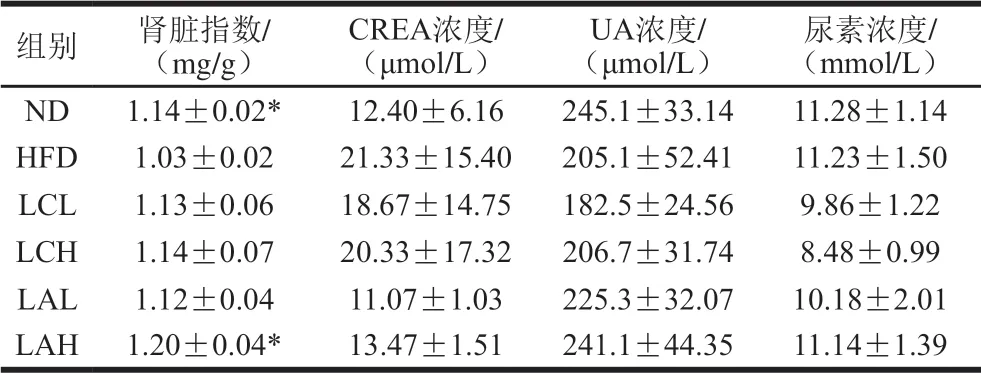
表 2 乳杆菌对肥胖小鼠肾脏指数及肾功能指标的影响Table 2 Effect of Lactobacillus strains on kidney index and kidney function in obese mice
器官指数能在一定程度上反映动物的健康状态。高脂膳食诱导的肥胖十分严重时也会造成机体脏器功能发生紊乱。由表1、2可知,两菌粉组的肝脏指数与ND组接近,其中LA组与ND组更接近,但均与HFD组无显著性差异。ND、LAH组的肾脏指数与HFD组相比有显著差异(P<0.05)。LCL、LCH、LAL组虽然与HFD组没有显著差异,但趋于正常。LC、LA两菌粉组血清中肝功能相关的ALT、AST、TP、ALB指标以及肾功能相关的CREA、UA、尿素各项指标水平介于ND组和HFD组之间,且各组之间无显著性差异,这可能是本实验肥胖周期不够长而导致的各组之间肝功能和肾功能没有显著差异。
2.4 乳杆菌对肥胖小鼠血清瘦素和脂联素含量的影响
肥胖的发生常常和瘦素、脂联素水平的波动密切相关。研究者发现,肥胖往往会伴有高瘦素血症,而肥胖者体内的脂联素脂肪因子会出现下调[26]。由图3A可知,两菌粉组小鼠的血清瘦素水平和ND组十分接近,都低于HFD组,且均与HFD组有显著性差异,其中LC组小鼠血清瘦素质量浓度低于LA组。由图3B可知,ND组和两菌粉组的小鼠血清脂联素质量浓度都显著高于HFD组,且LA组小鼠血清瘦素水平高于LC组,ND、LA、LC组与HFD组相比均呈现显著性差异,其中LC组呈现了一定的剂量依赖性。有研究结果表明,Lactobacillus rhamnosusLS-8和Lactobacillus crustorumMN047能够抑制由高脂膳食导致的血清瘦素水平的增加和脂联素水平的下降[27],与本研究结果类似。以上结果提示,这两株乳酸杆菌能有效地改善小鼠由肥胖引起的血清瘦素水平升高并控制脂联素分泌水平,从而起到较好的抗肥胖作用。
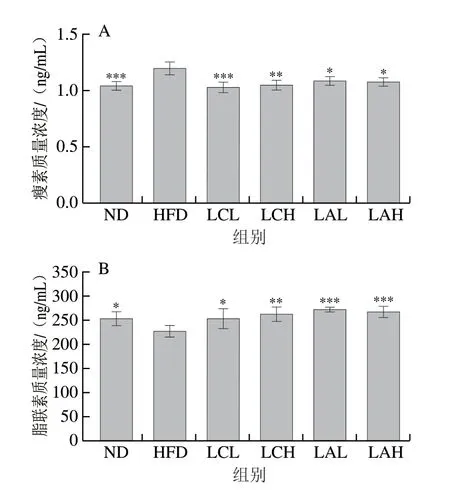
图 3 乳杆菌对肥胖小鼠血清瘦素(A)、脂联素(B)质量浓度的影响Fig. 3 Effect of Lactobacillus strains on serum leptin (A) and adiponectin (B) levels in obese mice
2.5 脂肪组织病理切片观察结果
有研究表明一些乳酸菌Lactobacillus plantarum9-41-A、Lactobacillus fermentumM1-16、Lactobacillus reuteri能够减小肥胖小鼠白色脂肪组织的细胞大小和减少细胞数量[28-29]。同时,本实验进行了脂肪组织病理切片观察,以探究Lactobacillus caseiNCU011054和Lactobacillus acidophilusNCU433是否也有抑制肥胖小鼠白色脂肪组织细胞大小和减少细胞数量的作用。
由图4可知,ND组的脂肪细胞形态完整、排列整齐紧密、整体细胞大小相当,细胞边界清晰,而HFD组脂肪细胞形态不完整,大小不均匀,绝大部分细胞体积变大,排列也不规则,出现严重的分化现象。两菌粉组的脂肪细胞较HFD组相比,脂肪细胞排列整齐、尺寸均一,少数细胞出现体积变大充脂分化现象,且菌粉组与ND组细胞病理形态更接近。其中,LC组的低剂量和LA组高剂量的脂肪细胞排列整齐,少数细胞体积偏大,出现充脂分化的现象,整体细胞与ND组细胞大小相似,甚至同视野下细胞数目比ND组更少。以上结果表明,这两株乳酸杆菌还可通过减轻脂肪的积累来抑制肥胖的发展,这与前面抑制小鼠体质量增量和附睾脂肪质量增加的结果一致;因此,两株乳酸杆菌对体质量增加的抑制作用可能与减少脂肪积累量有关。
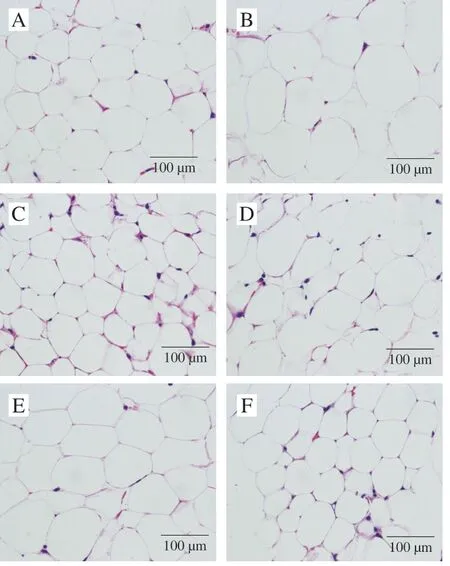
图 4 不同组脂肪组织HE染色图(400×)Fig. 4 Histological sections of adipose tissues in different groups at (400 ×)
2.6 乳杆菌对肥胖小鼠肝脏质量、胆固醇和甘油三酯含量的影响
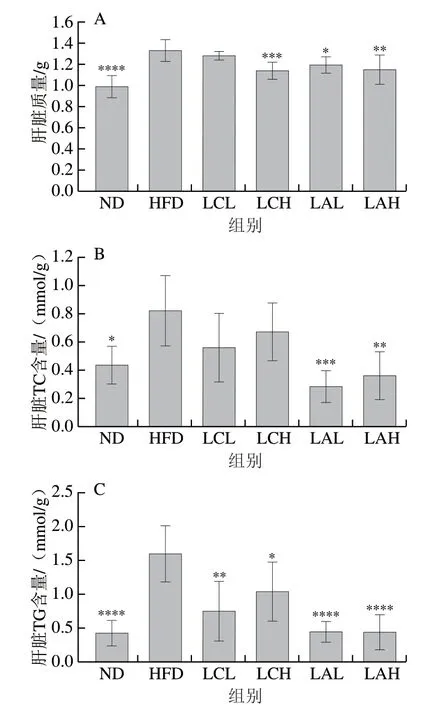
图 5 乳杆菌对肥胖小鼠肝脏质量(A)、肝脏TC(B)和TG(C)含量的影响Fig. 5 Effect of Lactobacillus strains on liver mass (A), and TC (B) and TG (C) contents in liver of obese mice
肥胖的发生往往伴随着肝脏功能异常,如肝脏肿大以及肝脏脂质代谢紊乱等。长期的高脂膳食会导致肝脏中脂肪酸水平异常,进而导致TC、TG含量升高,严重时会导致脂肪肝[30]。由图5A可知,ND组和两菌粉组的肝脏质量都低于HFD组,但LCL组与HFD组之间无显著性差异,其他各组与HFD组相比均有显著性差异,因此乳杆菌能缓解肥胖小鼠的肝脏肿大现象,LA组比LC组的效果更好。由图5B、C可知,两株乳杆菌对调节肝脏的脂质代谢都有一定的缓解作用,如图5B所示,与HFD相比,LCL和LCH组的TC含量虽然较低但是没产生显著性差异,ND、LAL和LAH组都显著低于HFD组。如图5C所示,ND组和两菌粉组的TG含量都低于HFD组,且与HFD组都有显著性差异,其中,LA组与ND组更接近,降TG的效果优于LC组。结果表明,这两株菌粉能够降低由肥胖引起肝脏中脂质的堆积,对肝脏的脂代谢有一定调节作用。此外,也有研究表明,Lactobacillus plantarumKY1032和Lactobacillus curvatusHY7601能够改善肝脏脂质代谢和抑制由高脂饮食诱导的小鼠肥胖[31],这与本研究结果一致。
2.7 乳杆菌对肥胖小鼠肝脏抗氧化能力的影响
长期高脂膳食会导致机体产生过多的自由基,造成机体氧化损伤。GSH-Px、T-SOD、CAT等抗氧化酶可以协同清除机体产生的过多活性氧自由基。另外,MDA是机体多不饱和脂肪酸过氧化物的降解产物,机体MDA含量越高,表明机体损伤越严重,而T-AOC反映了机体抗氧化能力的总水平[32]。
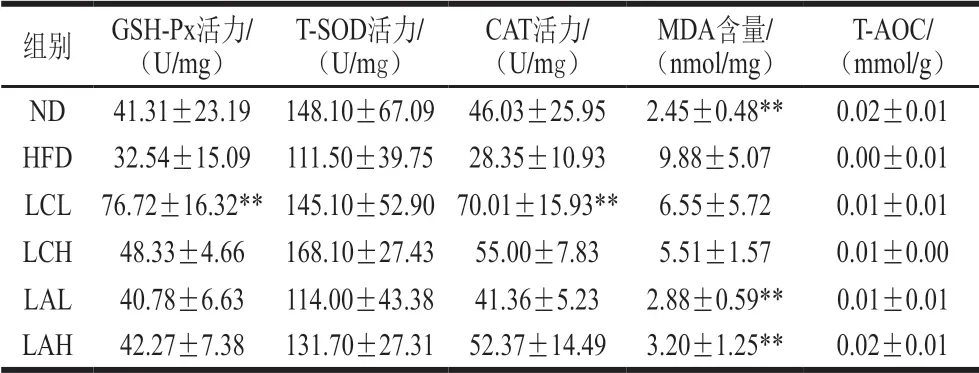
表 3 乳杆菌对肥胖小鼠肝脏抗氧化水平的影响Table 3 Effect of Lactobacillus strains on oxidative stress in liver ofobese mice
由表3可知,HFD组小鼠的GSH-Px活力低于其余各组,且LCL组极显著高于HFD组(P<0.01),LC两剂量组的GSH-Px活力均高于LA组的两个剂量组;此外,各组小鼠肝脏的T-SOD活力、T-AOC与HFD组相比均无显著性差异,但HFD组的T-SOD活力、T-AOC均低于ND组和两菌粉组;各组小鼠肝脏CAT活力均高于HFD组,但没有显著性差异,LCL组小鼠肝脏中的CAT活力极显著高于HFD组(P<0.01),LC组的CAT活力高于LA组;ND、LAL、LAH组的小鼠肝脏中MDA水平极显著低于HFD组(P<0.01),其他各组也低于HFD组,但没有显著性差异,LA组低于LC组。以上结果表明,这两株乳酸杆菌能提高肥胖小鼠肝脏内抗氧化酶活力,降低具有细胞毒性的MDA含量,提高肥胖小鼠总抗氧化的水平。综合以上结果,LC和LA菌株有良好的抗氧化效果,可以抑制由肥胖引起的肝脏氧化损伤。有研究表明Lactobacillus paracaseisubsp. paracaseiM5和Lactobacillus coryniformissubsp. torquensT3有很好的抗氧化效果,可以较好地抑制高脂膳食诱导的肥胖引起的肝脏损伤[26],这与本实验结果一致。
2.8 乳杆菌对肥胖小鼠粪便短链脂肪酸的影响
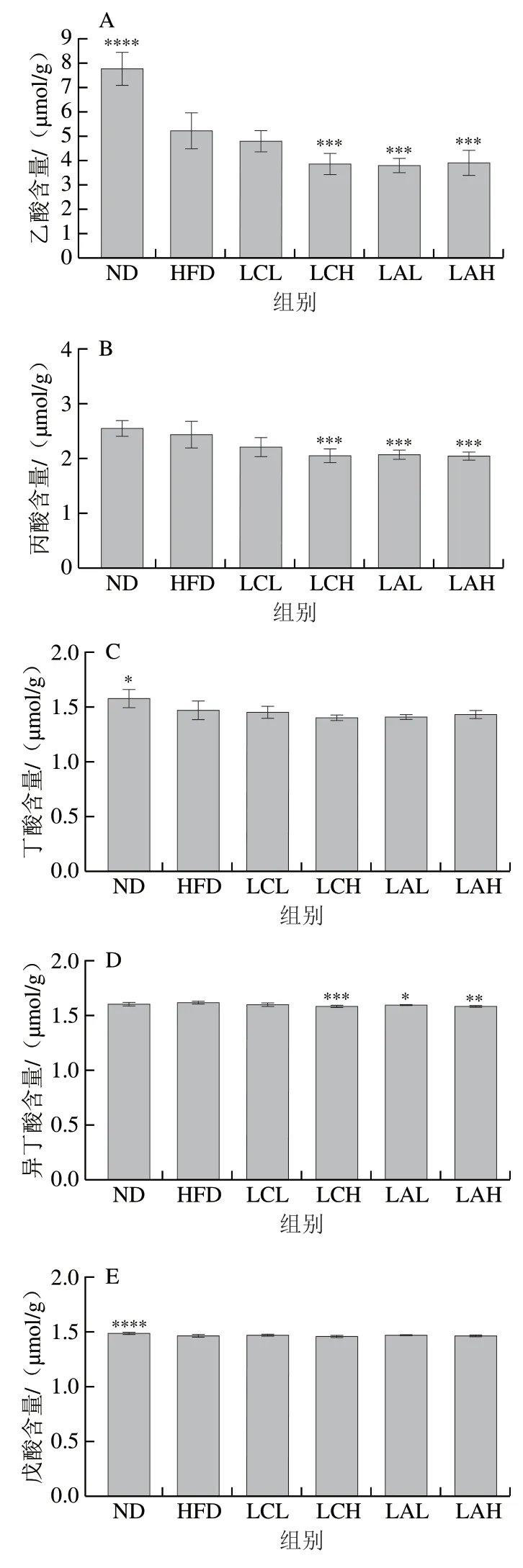
图 6 乳杆菌对肥胖小鼠粪便SCFAs的影响Fig. 6 Effect of Lactobacillus strains on short-chain fatty acids in feces of obese mice
研究表明,遗传性肥胖的啮齿类动物和超重成年人的粪便SCFAs含量比同类正常体质量的粪便SCFAs含量高[33-34]。然而,也有研究报道,在饮食诱导的肥胖小鼠中,其粪便中的SCFAs(乙酸和丙酸)含量降低[35]。在本研究中,HFD组小鼠粪便中乙酸、丁酸、戊酸含量显著低于ND组,丙酸含量低于ND组。由图6可知,ND组和LCH、LAL、LAH组肥胖小鼠粪便中乙酸含量与HFD组相比有显著性差异(P<0.05),但是ND组高于HFD组,菌粉组都低于HFD组;此外,LCH、LAL、LAH组肥胖小鼠粪便中的丙酸含量与HFD组有显著性差异(P<0.05),且菌粉组都低于HFD组;另外,丁酸、戊酸、异戊酸的分析结果显示,菌粉组与HFD组相比均没有显著性差异,但LCH、LAL、LAH组肥胖小鼠粪便中的异丁酸水平却显著低于HFD组(P<0.05)。本研究中,灌胃两株乳杆菌组的小鼠粪便SCFAs含量均低于HFD组,这可能是由于灌胃乳酸杆菌株引起肠道环境中其他代谢产物的代偿性变化。
3 讨 论
本实验在建立高脂饮食诱导肥胖模型的基础上,探讨了Lactobacillus caseiNCU011054、Lactobacillus acidophilusNCU433对肥胖小鼠的调节作用。结果表明,两株乳杆菌有效抑制了小鼠肥胖症状及小鼠血糖血脂的升高程度,与已有的研究报道的结果[36-37]一致。同时,乳杆菌能显著降低小鼠血清瘦素水平,升高血清脂联素的水平,这与宋晨[26]的研究结果相同。脂肪组织切片结果提示菌乳杆菌能有效抑制肥胖小鼠的脂肪累积及脂肪细胞分化,与已报道的研究结果[38]一致。此外,乳杆菌有效降低了小鼠肝脏质量,改善了小鼠肝脏肿大的症状,明显降低了肥胖小鼠肝脏中TC、TG的含量,较好调控了肝脏中脂质积累和代谢,这与Wang Jingjing等[39]的研究结果相一致。本实验还发现乳杆菌降低了乙酸、丙酸和丁酸的水平,这可能是由于乳杆菌间接提高了肠道里面其他代谢物的水平[14]。综上所述,两种乳杆菌L a c t o b a c i l l u s c a s e iNCU011054和Lactobacillus acidophilusNCU433能有效调控肥胖引起的血糖血脂代谢紊乱、调节血清瘦素和脂联素水平、改善肝脏肿大症状和肝脏TC和TG的堆积、抑制肥胖小鼠脂肪细胞增大和分化、降低脂肪累积和体质量增量,对肥胖小鼠起到较好的干预作用,这将为这两种乳杆菌未来应用于肥胖的饮食干预提供参考和基础数据。
