基于斑马鱼模型研究鱿鱼生殖腺磷脂抗MPTP诱发帕金森病的活性
2021-03-31董俊凡季秀娜李晓彬刘可春
董俊凡,宋 扬,季秀娜,李晓彬,刘可春,靳 梦,
(1.齐鲁工业大学(山东省科学院)生物研究所,山东 济南 250103;2.齐鲁工业大学(山东省科学院)生物工程学院,山东 济南 250353)
帕金森病(Parkinson’s disease,PD)是一种由多因素诱发的神经退行性疾病[1],病人临床症状表现为运动缓慢、肌肉僵直和震颤。PD发病机制较为复杂,至今尚未明确,主要病理学特点是大脑黑质中多巴胺神经元大量死亡和α-突触核蛋白(α-synuclein,α-Syn)异常聚集导致Lewy小体的形成[2]。也有研究表明,PD的发病与E3泛素连接酶Parkin、PTEN诱导假定激酶1(PTEN-induced putative kinase 1,Pink1)[3]和酪氨酸羟化酶(tyrosine hydroxylase,Th)[4]基因表达异常有关。th的表达下降会造成多巴胺神经元受损[5];α-syn的过度表达[6-7]和parkin、pink1的表达水平异常都会导致线粒体受损[8-9],影响线粒体的自噬功能[10]。多巴胺神经元和线粒体受到损伤都会导致PD的发生。
斑马鱼因体外受精,胚胎发育速度快,胚胎和幼鱼身体透明等特点,更适用于形态学观察。斑马鱼作为一种常见的脊椎动物,与人类基因组同源性高达87%,信号通路调控也与人类有很高的相似性[11]。α-syn、parkin、pink1、th等在斑马鱼中均可找到相应的同源基因[3]。基于以上原因,利用斑马鱼建立PD模型已逐渐成为研究热点[12]。1-甲基-4-苯基-1,2,3,6-四氢吡啶盐酸盐(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)是一种可以诱导PD发生的神经毒性物质[13]。研究发现MPTP在斑马鱼体内的作用机制与人类基本相同,都是通过产生的1-甲基-4-苯基-吡啶活性离子(1-methyl-4-phenylpyridinium,MMP+)作用于线粒体产生大量自由基,导致线粒体发生氧化损伤,引发线粒体功能障,最终导致PD病征[14-16]。因此,本实验利用MPTP诱导斑马鱼PD模型,通过观察其多巴胺神经元、脑血管发育情况和行为学变化,研究鱿鱼生殖腺磷脂是否具有抗PD活性。Vmat、Fli1分别在斑马鱼多巴胺神经元与血管中特异性表达[17-18],因此,利用转基因斑马鱼Vmat:GFP、Fli1:GFP观察多巴胺神经元和脑部血管的发育情况。
鱿鱼生殖腺中含有丰富的磷脂[19],与从大豆中提取的磷脂相比,从鱿鱼生殖腺中提取磷脂的支链脂肪酸是以二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA)为主的多不饱和脂肪酸。DHA和EPA能够通过激活Nrf2-ARE信号通路,缓解PD小鼠症状[20]。鱿鱼生殖腺中的磷脂主要为磷脂酰胆碱,磷脂酰胆碱是乙酰胆碱的前体,神经细胞之间均需依靠乙酰胆碱传递信息,在脑神经元之间建立稳定的联系[21]。磷脂酰胆碱在体内水解为胆碱,胆碱能够提高机体的抗氧化能力,对线粒体产生保护作用,维持线粒体功能正常[22]。基于以上原因,本研究探究鱿鱼生殖腺磷脂是否具有抗PD活性。
1 材料与方法
1.1 动物、材料与试剂
转基因斑马鱼Vmat:GFP、转基因斑马鱼Fli1:GFP和野生型斑马鱼AB由山东省科学院生物研究所提供;成年雌、雄斑马鱼于斑马鱼循环水养殖系统中分开培养,给予照明14 h/黑暗10 h交替的周期光照,28 ℃养殖,并于每日10∶00、15∶00和20∶00分3 次喂食颗粒状饵料和刚孵出的卤虫无节幼体。
鱿鱼生殖腺由蓬莱海洋(山东)股份有限公司提供。
Pronase E北京索莱宝科技有限公司;MPTP、1-苯基-2-硫脲(1-phenyl-2-thiourea,PTU)、亚甲基蓝美国Sigma公司;RN2802 RNA试剂盒北京艾德莱生物科技有限公司;RR036A反转录试剂盒、RR091A荧光定量PCR试剂盒日本Takara公司。
1.2 仪器与设备
斑马鱼水养殖系统北京爱生科技公司;实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,qPCR)仪 罗氏诊断(上海)有限公司;超微量分光光度计 香港基因有限公司;C1000 Touch梯度PCR仪美国Bio-Rad公司;体视荧光显微镜 德国Carl Zeiss公司;Zebrabox斑马鱼行为分析仪 法国Viewpoint公司。
1.3 方法
1.3.1 鱿鱼生殖腺磷脂的制备
参考戴志威[23]的方法,并作修改。称取100 g鱿鱼生殖腺,用1 000 mL体积分数95%乙醇溶液搅拌提取3 次,每次提取5 h;提取液过滤后,蒸干,溶于50 mL体积分数95%乙醇溶液,再用400 mL正己烷萃取,收集正己烷层浓缩后干燥称质量。然后用正己烷配制质量浓度0.5 g/mL的样品溶液,加入10 倍体积丙酮混匀,静置24 h,沉淀干燥后即得鱿鱼生殖腺磷脂样品。用鱿鱼生殖腺磷脂样品质量除以原料质量,计算得到样品得率为3.75%。采用钼蓝比色法[24]测定得到鱿鱼生殖腺磷脂样品中总磷脂质量分数为91.3%。
1.3.2 斑马鱼胚胎的制备
选择性成熟斑马鱼按雌雄比例1∶1,于17∶00—18∶00分开放入带隔板的产卵缸中;次日上午8∶30抽取隔板,2 h后收取受精卵,用新鲜养鱼水反复冲洗3 次,移入含2 mg/L亚甲基蓝的新鲜养殖水中[25],再置于28 ℃培养箱中孵化。
1.3.3 实验流程及分组
将提取得到的褐色膏状鱿鱼生殖腺磷脂通过超声辅助溶于水中,配制成质量浓度20 mg/mL的母液。用斑马鱼建立PD模型,通过分析受精后不同时间不同实验组转基因斑马鱼Vmat:GFP多巴胺神经元与转基因斑马鱼Fli1:GFP脑血管的发育情况,以及野生型斑马鱼AB行为学变化、PD相关基因(α-syn、parkin、pink1、th)表达情况,研究鱿鱼生殖腺磷脂是否具有抗PD活性,初步解释其抗PD活性的机制。实验流程如图1所示。
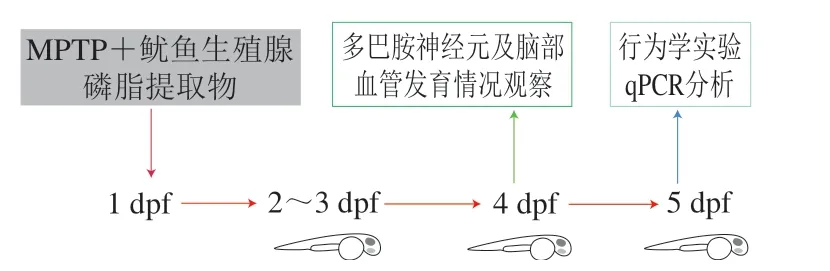
图 1 实验流程图Fig. 1 Flow chart of the experimental procedure adopted in this study
受精后1 d(day post fertilization,dpf)时,转基因斑马鱼Vmat:GFP、Fli1:GFP胚胎和野生型斑马鱼AB胚胎用1 mg/mL Pronase E进行脱膜处理[26],然后用新鲜养鱼水清洗3 遍后放于6 孔板中,每孔30 条幼鱼,分别设置:空白对照组:5 mL新鲜养鱼水处理;MPTP处理组:5 mL 50 μmol/L MPTP溶液处理;5 mL不同终质量浓度(3、10、20 μg/mL)鱿鱼生殖腺磷脂与终浓度50 μmol/L MPTP共处理组。转基因斑马鱼Vmat:GFP、Fli1:GFP幼鱼用含0.03 mg/mL PTU的新鲜养鱼水配制给药溶液,以抑制黑色素生成[27],便于观察多巴胺神经元和脑血管荧光。给药后放入28 ℃培养箱培养,每24 h换水重新给药。
1.3.4 多巴胺神经元及脑血管发育情况观察
4 dpf时,在不同实验组转基因斑马鱼Vmat:GFP、Fli1:GFP中分别随机选取8 条幼鱼,分别用体视荧光显微镜观察转基因斑马鱼Vmat:GFP幼鱼多巴胺神经元与转基因斑马鱼Fli1:GFP幼鱼脑血管的发育情况,拍照并记录。使用Image-Pro Plus 5.1软件分析荧光显微镜所得神经元图像,用Length工具测定多巴胺神经元区域长度,用IOD工具测定多巴胺神经元区域荧光密度总和。多巴胺神经元区域相对长度、相对荧光密度和分别按式(1)、(2)计算。


1.3.5 行为学实验
5 dpf时,在不同实验组野生型斑马鱼AB中分别随机选取8 条幼鱼,放入48 孔板中,每孔各放1 条,加入1 mL新鲜养鱼水,将48 孔板放入Zebrabox斑马鱼行为分析仪暗箱中15 min,使幼鱼适应环境后进行行为学检测。用Zeblab软件采集20 min内斑马鱼的运动轨迹,并导出数据,计算游动总距离和平均速率。
1.3.6 qPCR检测PD相关基因的表达
5 dpf时,参照RNA试剂盒说明书对20 条不同实验组野生型斑马鱼AB幼鱼的总RNA进行提取,用超微量分光光度计测定不同实验组RNA浓度,检测结果A260nm/A280nm应在2.0~2.5之间;参照反转录试剂盒说明书步骤用梯度PCR仪反转录为cDNA;以cDNA为模板,加入相关引物用qPCR仪扩增各目的基因。扩增结束后,以rpl13a为内参基因,用2-ΔΔCt相对定量法计算各基因的相对表达量。引物序列如表1所示。

表 1 实验所用引物及其序列[28]Table 1 Primers sequences used in this study[28]
1.4 数据处理与统计分析
使用Graphpad Prism 7.0软件对实验结果进行单因素方差分析检验,结果以平均值±标准误表示,P<0.05表示数据具有统计学意义。
2 结果与分析
2.1 鱿鱼生殖腺磷脂对斑马鱼PD模型多巴胺神经元发育的影响
由图2 A可知,4 dpf 时,转基因斑马鱼Vmat:GFP幼鱼多巴胺神经元已基本发育完整[29]。由图2B、C可知,相较于对照组,MPTP处理组多巴胺神经元区域相对长度高度显著降低(P<0.001),相对荧光密度总和极显著降低(P<0.01),多巴胺神经元明显缺失;而不同质量浓度(3、10、20 μg/mL)鱿鱼生殖腺磷脂与MPTP共处理后,转基因斑马鱼Vmat:GFP幼鱼多巴胺神经元区域相对长度和荧光密度总和较MPTP处理组均有不同程度地增加。本实验结果表明,鱿鱼生殖腺磷脂可以降低斑马鱼多巴胺神经元缺失比列。
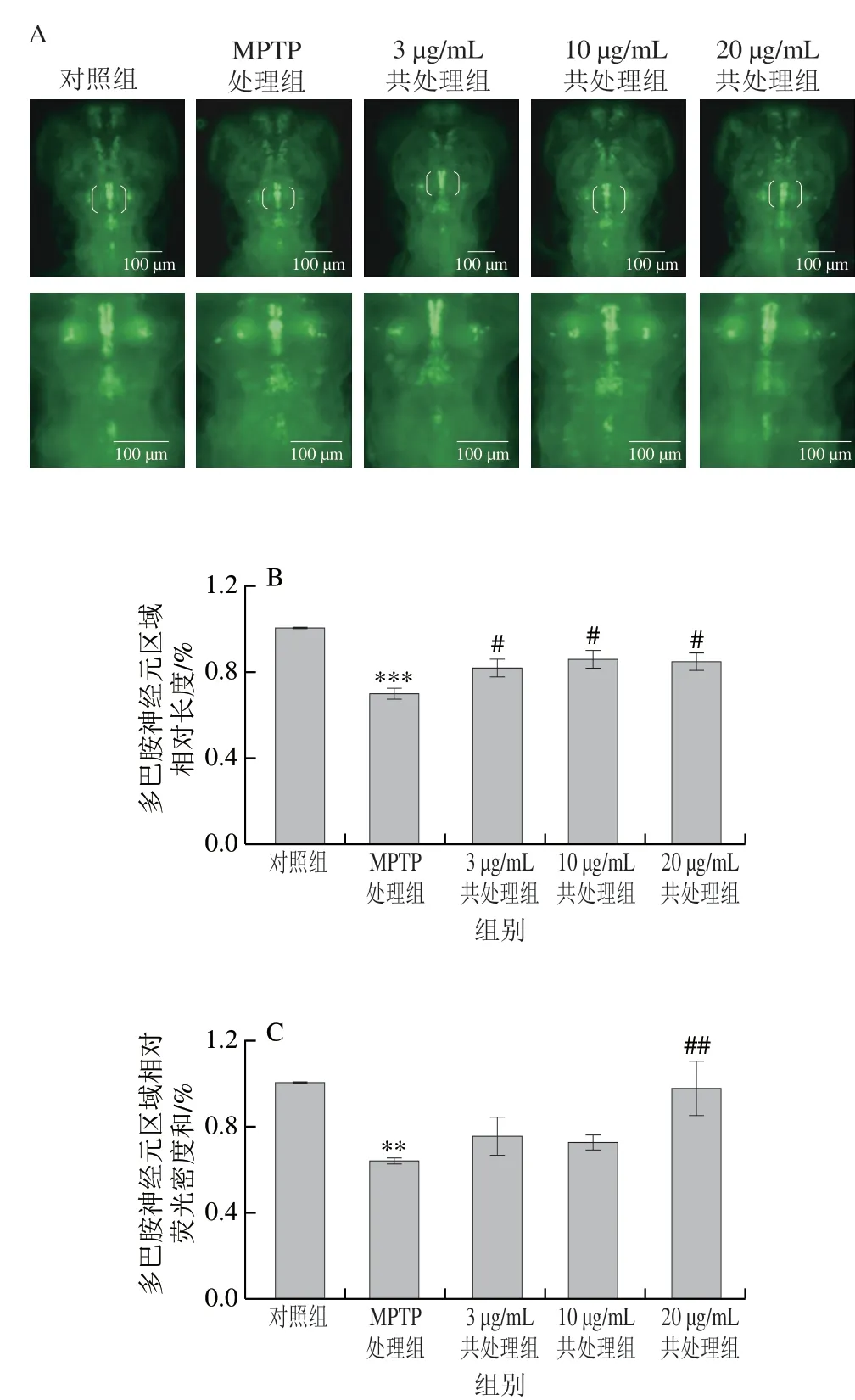
图 2 鱿鱼生殖腺磷脂对斑马鱼PD模型多巴胺神经元的保护作用Fig. 2 Neuroprotective effect of squid gonadal phospholipids on dopamine neurons in zebrafish model of PD
2.2 鱿鱼生殖腺磷脂对斑马鱼PD模型脑血管发育的影响
由图3可知,4 dpf时,对照组中转基因斑马鱼Fli1:GFP幼鱼脑血管已清晰可见且较为完整;MPTP处理组较对照组而言,脑血管损伤严重,数量显著减少;相较于MPTP处理组,不同质量浓度(3、10、20 μg/mL)鱿鱼生殖腺磷脂与MPTP共处理组中转基因斑马鱼Fli1:GFP幼鱼脑血管数量不同程度地增加。本实验结果表明,鱿鱼生殖腺磷脂可以减轻由MPTP引起的脑血管损伤。
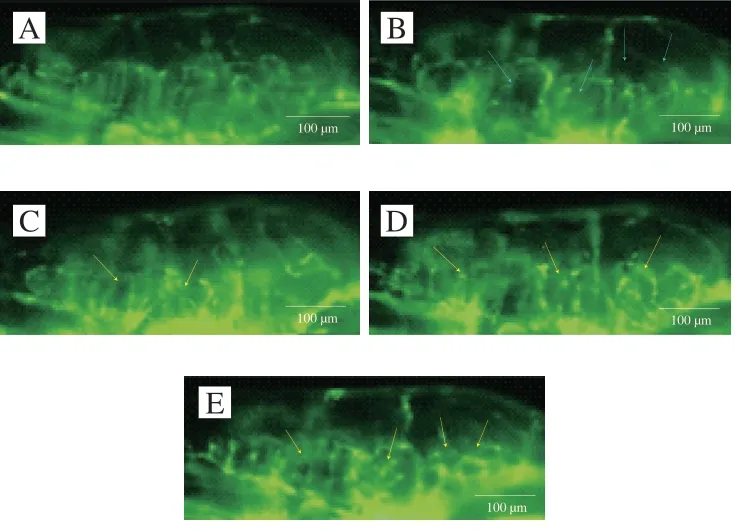
图 3 鱿鱼生殖腺磷脂对斑马鱼PD模型脑血管的保护作用Fig. 3 Protective effect of squid gonadal phospholipids on blood vessels in the brain of zebrafish model of PD
2.3 鱿鱼生殖腺磷脂对斑马鱼PD状行为的影响
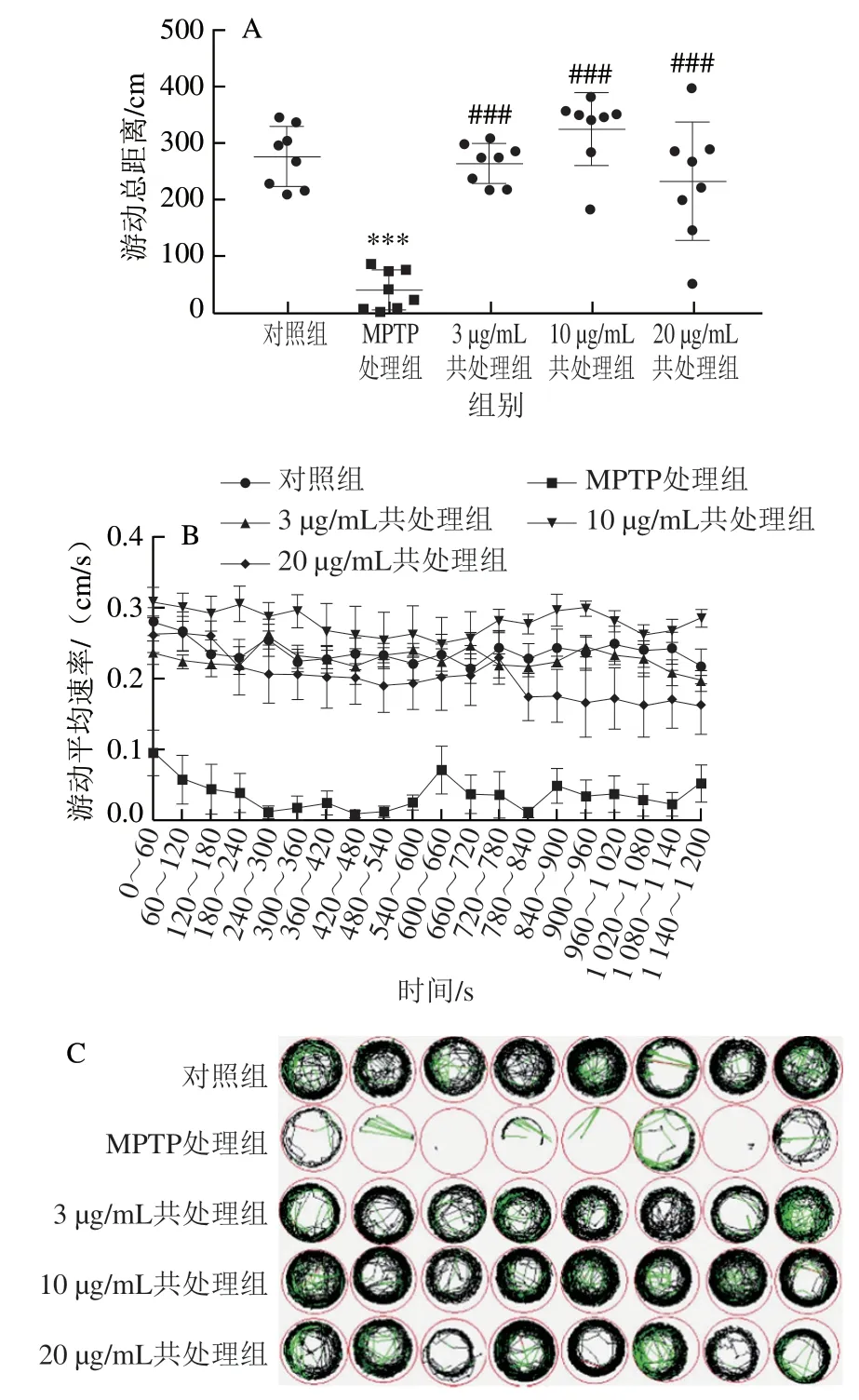
图 4 鱿鱼生殖腺磷脂对斑马鱼PD状行为的抑制作用Fig. 4 Inhibitory effect of squid gonadal phospholipids on PD-like behavior of zebrafish
本研究对不同实验组5 dpf时野生型斑马鱼AB进行行为学检测,结果见图4。相比于对照组,MPTP处理组斑马鱼出现PD状行为,表现为游动总距离高度显著减少(P<0.001),游动平均速率明显变慢,且运动迟缓;与MPTP处理组比较,不同质量浓度(3、10、20 μg/mL)鱿鱼生殖腺磷脂与MPTP共处理组斑马鱼的游动总距离高度显著增加(P<0.001),游动平均速率明显变快,运动能力恢复。本实验结果表明,鱿鱼生殖腺磷脂可以显著改善斑马鱼PD状行为。
2.4 鱿鱼生殖腺磷脂对PD相关基因表达的影响
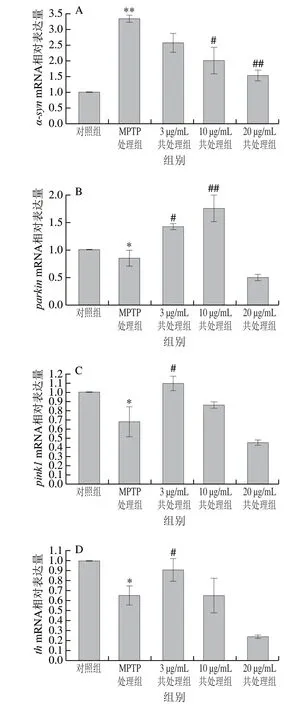
图 5 鱿鱼生殖腺磷脂对斑马鱼PD相关基因表达的影响Fig. 5 Effect of squid gonad phospholipids on PD-related gene expression in zebrafish
为研究鱿鱼生殖腺磷脂抗PD活性的机制,用qPCR检测不同实验组野生型斑马鱼AB幼鱼PD相关基因α-syn、parkin、pink1、th的表达水平。由图5可知,与对照组相比,MPTP处理组α-synmRNA相对表达量极显著上调(P<0.01),parkin、pink1、thmRNA相对表达量显著下调(P<0.05)。与MPTP处理组相比,3、10、20 μg/mL鱿鱼生殖腺磷脂与MPTP共处理组α-synmRNA相对表达量均下降,且具有浓度依赖性。与MPTP处理组相比,parkinmRNA相对表达量在3 μg/mL和10 μg/mL鱿鱼生殖腺磷脂与MPTP共处理组中显著上升(P<0.05、P<0.01),但在20 μg/mL共处理组中无显著变化;pink1和thmRNA相对表达量均在3 μg/mL共处理组中显著上升(P<0.05),在10 μg/mL和20 μg/mL共处理组中无显著变化。本实验结果表明,鱿鱼生殖腺磷脂能够调控MPTP诱导的PD相关基因的异常表达。
3 讨 论
本研究采用斑马鱼建立PD模型,经MPTP处理后斑马鱼表现出多巴胺神经元缺损、脑部血管数量明显减少、运动能力明显下降,这与王荣春等[30]报道一致,表明MPTP成功诱导了斑马鱼PD模型。本研究结果表明,鱿鱼生殖腺磷脂可以改善斑马鱼PD模型上述一系列PD症状,说明鱿鱼生殖腺磷脂具有良好的抗PD活性。进一步研究鱿鱼生殖腺磷脂对PD相关基因的调控,探究鱿鱼生殖腺磷脂的抗PD作用机制。从本实验结果可知,MPTP诱导PD相关基因α-synmRNA表达水平极显著上调,parkin、pink1、thmRNA表达水平显著下调。α-syn的过度表达可以使α-Syn异常聚集,导致线粒体损伤,引起PD的发生和发展[31]。Pink1和Parkin蛋白能够维持线粒体的正常功能,当线粒体受到损伤时,Pink1会在线粒体外膜堆积,并聚集到线粒体,从而促进受损线粒体降解和再循环,维持健康的线粒体库[32-33]。本实验中MPTP使parkin、pink1mRNA表达水平下调,从而影响Pink1/Parkin途径,使受损的线粒体不能被降解,致使MPTP组斑马鱼表现出PD症状。Th是参与多巴胺合成的限速酶,本实验中MPTP使thmRNA表达水平降低,可导致多巴胺含量减少,诱发PD[34]。
与MPTP处理组相比,α-synmRNA表达水平在3、10、20 μg/mL鱿鱼生殖腺磷脂与MPTP共处理组中均显著下降,有效减少了α-Syn聚集,提示鱿鱼生殖腺磷脂可缓解MPTP诱发PD症状。且随鱿鱼生殖腺磷脂质量浓度升高,α-synmRNA表达水平趋于正常。与MPTP处理组相比,3 μg/mL鱿鱼生殖腺磷脂可以使parkin和pink1的mRNA表达水平显著升高,这可能有助于维持Pink1/Parkin途径的正常作用,促进受损线粒体降解;20 μg/mL鱿鱼生殖腺磷脂共处理组parkin、pink1mRNA表达水平均无显著变化,推测鱿鱼生殖腺磷脂在此质量浓度时可以很好地保护线粒体免受损伤,不需要激活Pink1/Parkin途径,因此parkin和pink1的表达水平均未受影响。与MPTP处理组相比,3 μg/mL鱿鱼生殖腺磷脂可以使thmRNA表达水平显著上升,多巴胺神经元有所恢复,与张智敏等[5]研究结果相符。10 μg/mL和20 μg/mL质量浓度下,鱿鱼生殖腺磷脂对多巴胺神经元具有恢复作用,且效果较3 μg/mL鱿鱼生殖腺磷脂更明显(图2),张智敏等[5]的研究中thmRNA表达水平升高,但本研究中thmRNA表达水平与MPTP处理相比并无明显变化,推测其原因可能是10 μg/mL和20 μg/mL鱿鱼生殖腺磷脂对线粒体功能的保护作用较强,从而导致MPTP诱导的多巴胺神经元凋亡不显著[35],因此th表达水平未受影响。已有研究证实,多种化合物都能够通过防止线粒体损伤改善PD症状。艾地苯醌可以通过激活电子传递系统加速腺苷三磷酸的生成,改善线粒体功能障碍,保护线粒体DNA,缓解MPTP诱导的小鼠PD状行为[36]。雷帕霉素能够显著提高由MPTP引起的PD小鼠线粒体膜电位和线粒体复合物I活性的降低,进一步改善PD小鼠的运动功能,提高PD小鼠的黑质多巴胺含量[37]。异鼠李素-3-O-葡萄糖苷可以逆转由MPP+引起的线粒体膜电位降低,阻断MPP+导致的线粒体分裂,抑制线粒体损伤,减少神经细胞株PC12细胞凋亡[38]。本实验结果已初步确定鱿鱼生殖腺磷脂具有抗PD活性,但是其具体内在机制仍需进一步研究与讨论,特别是通过直接检测线粒体指标,如测定线粒体膜电位和腺苷三磷酸含量等,阐述鱿鱼生殖腺磷脂是否可以保护线粒体免受损伤从而发挥抗PD活性。
本研究结果显示,鱿鱼生殖腺磷脂可以有效减少多巴胺神经元损伤、保护脑部血管、改善PD状行为,提示其具有抗PD活性。通过检测PD相关基因α-syn、parkin、pink1、th表达水平,推测其作用机制可能是鱿鱼生殖腺磷脂可以保护线粒体免受损伤,维持其正常功能,从而发挥抗PD作用。
