欧前胡素对人前列腺癌PC3细胞增殖 凋亡及RhoA/ROCK1信号通路的影响
2021-03-30刘明娟韩瑞霞李江涛
刘明娟,韩瑞霞,李 铁,李江涛
(1.河北省第七人民医院泌尿外科,河北 保 定 073000 2.河北省老年病医院泌尿外科,河北 石家庄 050000)
前列腺癌(PC)是我国男性中最常见的癌症之一,也是癌症相关死亡率的第二大诱因,2019年我国新诊断前列腺癌病例为22万例,与癌症相关的死亡为月3万例[1]。伞形科植物白芷的干燥根提取的欧前胡素具有多种生物活性,据报道欧前胡素可抑制癌细胞增殖和诱导其凋亡。先前的研究表明欧前胡素通过抑制细胞周期调节蛋白的表达来调节乳腺癌细胞周期和凋亡[2]。Rho关联含卷曲螺旋结合蛋白激酶1(ROCK1)是Ras同源基因家族成员A(RhoA)的关键下游效应子。在一系列恶性肿瘤中,例如乳腺癌、前列腺癌和胃癌,已经检测到ROCK1表达升高,其与预后不良相关,RhoA水平升高与PC风险增加相关[3]。RhoA也可能增加PC细胞的体外增殖,而反义介导的RhoA表达抑制可抑制体内肿瘤生长并阻止PC细胞侵袭性[4]。激活的ROCK1通过有丝分裂原激活的蛋白激酶(MAPK)/磷脂酰肌醇-3-激酶(PI3K)/丝苏氨酸蛋白激酶(Akt)途径使信号磷酸化。这些信号在PC细胞增殖和凋亡抑制中起重要作用[5]。目前关于RhoA/ROCK1信号通路与PC细胞侵袭机制的研究较少,因此,本研究拟探讨欧前胡素对人前列腺癌PC3细胞增殖、凋亡及RhoA/ROCK1信号通路的影响,为欧前胡素治疗前列腺癌提供理论依据。
1 材料与方法
1.1主要药物、试剂及仪器:欧前胡素(陕西永源生物技术有限公司,原料药,纯度98%,批号YYI-062);5-氟尿嘧啶(武汉远城科技发展有限公司,原料药,纯度99%,批号TY0987-01);DMEM培养基(美国Gibco公司,批号26140-063);胎牛血清(美国Invitrogen公司,批号WS12052);二甲基亚砜、TRIzol试剂(碧云天生物科技有限公司,批号FCFC012、SE-36584);噻唑蓝(MTT)试剂盒(美国Promega公司,批号LE23696);Transwell腔室系统(美国Corning Costar公司,批号TY1236);膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)检测试剂盒(美国BD公司,批号LI21458-R);反转录试剂盒、SYBR Premix Ex Taq荧光定量PCR试剂盒(日本Takara公司,批号RR149B、DRR057A);放射免疫沉淀裂解缓冲液、二辛可宁酸蛋白质定量试剂盒(德国默克公司,批号159696、K36514);硝酸纤维素膜、超敏ECL化学发光试剂盒(密理博中国有限公司,批号RF-36545、FT-6584);RhoA、ROCK1、GAPDH单克隆抗体(武汉艾美捷科技有限公司,批号H00000387-M04、JT-58574、JS-10033);兔抗人二抗(美国Santa Cruz Biotechnology公司,批号YU-3654);ELx800型全自动酶标仪(美国BioTek公司);SD-98型倒置显微镜(日本奥林巴斯公司);FACScan型流式细胞仪(美国通用公司);ABI7900型实时荧光定量PCR(qRT-PCR)仪(美国ABI公司);SmartView Pro 2000型凝胶成像仪(北京金恒祥仪器有限公司)。
1.2细胞培养及分组:人前列腺癌PC3细胞购自美国典型培养物保藏中心,批号CSTC-2020010307,将PC3细胞在含有10%胎牛血清的DMEM培养基中培养,细胞培养环境为:37℃、5%CO2、2% O2、93%N2。 分组设计:PC3细胞组:细胞浓度为5×106/mL的人前列腺癌PC3细胞液在10%胎牛血清的DMEM培养基中培养;5-氟尿嘧啶组:人前列腺癌PC3细胞培养方法同PC3细胞组,并加入浓度为100μg/mL的5-氟尿嘧啶[6];欧前胡素低、高剂量组:人前列腺癌PC3细胞培养方法同PC3细胞组,各组分别加入浓度为60μg/mL、120μg/mL的欧前胡素[7]。以上各组每孔设6个平行样,培养72h。
1.3细胞增殖水平测定:将每孔2×103个PC3细胞接种到96孔微量滴定板中,于37℃在5%CO2环境中培养48h。将10μL MTT试剂(5 mg/mL)添加到100μL培养基中,并在37℃下孵育4h。除去培养基,并加入二甲基亚砜(150μL/孔)。使用酶标仪测量490 nm处的吸光度OD值,存活率=(实验组OD值- PC3细胞组OD值)/(实验组OD值-空白对照组OD值)×100%。孔中含有培养基,但没有细胞用作空白对照。
1.4细胞侵袭迁移水平测定:各组人前列腺癌PC3细胞培养结束后,将细胞重悬于无血清培养基中(细胞密度为8×103/mL)。将每组总共200μL细胞悬液添加到Matrigel包被的Transwell腔室系统中,并向基底外侧室中添加含有100mL/L胎牛血清的培养基。培养48h后,将剩余的细胞用乙醇固定并用结晶紫染色,将室的基底膜风干并在倒置显微镜下检查,并随机选择六个视野以获取侵袭细胞数量的平均值并拍摄照片。
1.5细胞凋亡水平测定:各组人前列腺癌PC3细胞培养结束后,将细胞用胰蛋白酶消化并用PBS缓冲液洗涤两次。然后将细胞用70%的冰冷乙醇固定,使用Annexin V-FITC/PI试剂盒进行分析。使用流式细胞仪通过荧光激活细胞分选分析染色的细胞后,生成细胞凋亡直方图。FACS生成的直方图由Cell Quest(Becto-Dickinson)分析,以确定每个阶段中细胞的百分比。
1.6细胞RhoA、ROCK1 mRNA水平测定:使用TRIzol试剂提取总RNA,并使用反转录试剂盒合成cDNA,采用SYBR Premix Ex Taq荧光定量PCR试剂盒通过qRT-PCR仪进行扩增。引物由武汉金开瑞生物工程有限公司合成,使用引物序列:RhoA正向:5'-GCAGTTGTGCTCCTGAAGAA-3',RhoA反向:5'-CGGGCGGCCAGAAACTACTG-3';ROCK1正向:5'-GTGCCCAAAGAAAGGTGCTG-3',ROCK1反向:5'-AGGAGGGGAGCCATCCATAG-3';GAPDH正向:5'-GTAAAGACCTCTATGCCATCA-3',GAPDH反向:5'-GGACTCATCGTACTCCTGCTG-3'。GAPDH基因用作标准化对照。PCR总反应体系(10μL)为:SYBR Premix Ex Taq 4 μL,cDNA模板 1μL,正向引物0.5 μL,反向引物0.5 μL,去离子水4 μL。热循环参数为:95℃ 60s,95℃ 20s,57℃ 30s,70℃ 40s,78℃ 20s,共30个循环。采用2-△△Ct法计算RhoA、ROCK1 mRNA相对表达水平。
1.7细胞RhoA、ROCK1蛋白水平测定:各组人前列腺癌PC3细胞培养结束后,将细胞用放射免疫沉淀裂解缓冲液在冰上裂解30min,并在4℃下以10000×g离心10min。使用二辛可宁酸蛋白质定量试剂盒来测量蛋白质浓度。取总共30μg总蛋白用于十二烷基硫酸钠聚丙烯酰胺凝胶电泳,然后转移到硝酸纤维素膜上,并用Tween 20制备的5%脱脂奶粉封闭1.5h。然后将膜与RhoA(1∶1000)、ROCK1(1∶1000)、GAPDH(1∶1000)一抗在4℃孵育过夜,然后将兔抗人二抗(1:5000)与膜在室温下孵育2h,通过增强化学发光试剂盒显色并由凝胶成像仪拍照。使用Quantity One软件分析蛋白质条带的灰度值。
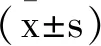
2 结 果
2.1各组人前列腺癌PC3细胞OD值、存活率比较:与PC3细胞组比较,5-氟尿嘧啶组、欧前胡素低、高剂量组OD值、存活率降低(P<0.05);与5-氟尿嘧啶组比较,欧前胡素低、高剂量组OD值、存活率升高(P<0.05);与欧前胡素低剂量组比较,欧前胡素高剂量组OD值、存活率降低(P<0.05)。见表1。
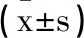
表1 各组人前列腺癌PC3细胞OD值存活率比较
2.2各组人前列腺癌PC3细胞侵袭迁移能力比较:与PC3细胞组比较,5-氟尿嘧啶组、欧前胡素低、高剂量组穿膜数降低(P<0.05);与5-氟尿嘧啶组比较,欧前胡素低、高剂量组穿膜数升高(P<0.05);与欧前胡素低剂量组比较,欧前胡素高剂量组穿膜数降低(P<0.05)。见表2、图1。

图1 各组人前列腺癌PC3细胞穿膜数数目比较(结晶紫染色,200倍)注:A:PC3细胞组,B:5-氟尿嘧啶组,C:欧前胡素低剂量组,D:欧前胡素高剂量组
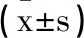
表2 各组人前列腺癌PC3细胞侵袭迁移能力比较
2.3各组人前列腺癌PC3细胞凋亡率比较:与PC3细胞组比较,5-氟尿嘧啶组、欧前胡素低、高剂量组凋亡率升高(P<0.05);与5-氟尿嘧啶组比较,欧前胡素低、高剂量组凋亡率降低(P<0.05);与欧前胡素低剂量组比较,欧前胡素高剂量组凋亡率升高(P<0.05)。见表3、图2。
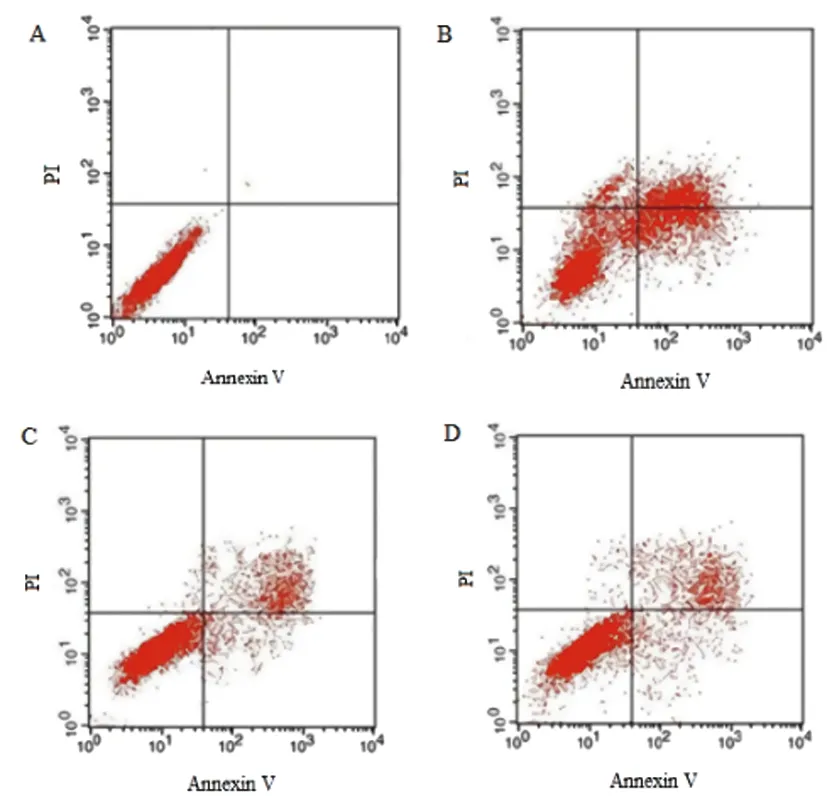
图2 各组人前列腺癌PC3细胞凋亡率流式细胞图注:A:PC3细胞组,B:5-氟尿嘧啶组,C:欧前胡素低剂量组,D:欧前胡素高剂量组
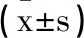
表3 各组人前列腺癌PC3细胞凋亡率比较
2.4各组人前列腺癌PC3细胞RhoA、ROCK1mRNA表达水平比较:与PC3细胞组比较,5-氟尿嘧啶组、欧前胡素低、高剂量组RhoA、ROCK1 mRNA表达水平降低(P<0.05);与5-氟尿嘧啶组比较,欧前胡素低、高剂量组RhoA、ROCK1 mRNA表达水平升高(P<0.05);与欧前胡素低剂量组比较,欧前胡素高剂量组RhoA、R71.1mm。80.8mm(+28.2mm,94.7mm)〗51.1mm。80.9mm(+8.2mm,3.7mm)〗OCK1 mRNA表达水平降低(P<0.05)。见表4。
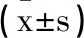
表4 各组人前列腺癌PC3细胞RhoA ROCK1 mRNA表达水平比较
2.5各组人前列腺癌PC3细胞RhoA、ROCK1蛋白表达水平比较:与PC3细胞组比较,5-氟尿嘧啶组、欧前胡素低、高剂量组RhoA、ROCK1蛋白表达水平降低(P<0.05);与5-氟尿嘧啶组比较,欧前胡素低、高剂量组RhoA、ROCK1蛋白表达水平升高(P<0.05);与欧前胡素低剂量组比较,欧前胡素高剂量组RhoA、ROCK1蛋白表达水平降低(P<0.05)。见表5、图3。
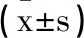
表5 各组人前列腺癌PC3细胞RhoA ROCK1蛋白表达水平比较

图3 各组人前列腺癌PC3细胞RhoA、ROCK1蛋白表达水平印迹图注:A:PC3细胞组 B:5-氟尿嘧啶组 C:欧前胡素低剂量组 D:欧前胡素高剂量组
3 讨 论
草药及其提取物可提供具有多种生物学功能的多种植物化学物质。在这些植物化学物质中,欧前胡素涉及不同细胞系统的生物化学反应,在植物生物化学和生理学中起着重要作用,包括抗氧化剂,酶抑制剂和有毒物质的前体[8]。在其多种生物学特性中,其抗肿瘤活性和抗增殖作用已得到广泛研究和报道。本研究中,与PC3细胞组比较,5-氟尿嘧啶组、欧前胡素低、高剂量组OD值、存活率、穿膜数降低,凋亡率升高;这说明,欧前胡素能明显抑制人前列腺癌PC3细胞增殖、侵袭,促进其凋亡。有研究表明,欧前胡素在肿瘤细胞系中显示出较强细胞毒性活性,欧前胡素对肺癌细胞系具有显著的抗增殖活性[9]。这与本研究结果一致。
侵袭-转移级联的初始步骤包括细胞间粘附的丧失、侵袭局部微环境、血管内渗入血液和淋巴管系统以及渗入远处组织的实质。该过程由上皮-间质转化(EMT)控制,通过该过程,上皮细胞丧失其上皮特征并获得间充质细胞的许多属性,包括与上皮细胞片的结合丧失以及获得细胞运动性、侵袭性和抗凋亡性[10]。EMT程序涉及上皮蛋白表达的上调,特别是RhoA。RhoA是上皮表型的下游效应子,并且是EMT诱导因子抑制的靶标,当RhoA过表达时,会触发许多与EMT相关的表达[11]。EMT可能仅涉及癌细胞的一小部分-少数位于癌细胞内上皮和基质之间的界面。实体瘤的进展涉及EMT在空间和时间上的发生,从而肿瘤细胞获得更具侵袭性和转移性的表型。RhoA的上调是转移性癌症中最常报道的现象之一,ROCK1在乳腺癌中具有促进作用[12]。生物信息学分析显示ROCK1是RhoA的潜在靶目标[13]。体外细胞学研究表明,ROCK1与乳腺癌细胞的体外迁移能力呈正相关[14]。相比较具有低转移能力和低表达ROCK1的乳腺癌MCF-7细胞,高表达ROCK1可使这些细胞获得更高的转移潜能。在乳腺癌MDA-MB-231细胞中,ROCK1低表达显著抑制了细胞迁移能力。ROCK1能够抑制原代星形胶质细胞中caspase-3的活性。研究发现抑制RhoA和ROCK1的表达能够诱导白血病细胞凋亡[15]。本试验研究结果显示,与PC3细胞组比较,5-氟尿嘧啶组、欧前胡素低、高剂量组RhoA、ROCK1 mRNA和蛋白表达水平降低;且欧前胡素高剂量组RhoA、ROCK1 mRNA和蛋白表达水平低于欧前胡素低剂量组。说明欧前胡素可抑制人前列腺癌PC3细胞侵袭迁移、促进其凋亡水平,其机制可能与欧前胡素可抑制人前列腺癌PC3细胞RhoA、ROCK1 mRNA和蛋白表达进而抑制RhoA/ROCK1信号通路的激活有关。
综上所述,欧前胡素能明显抑制人前列腺癌PC3细胞增殖、侵袭,促进其凋亡,其机制可能与欧前胡素可抑制人前列腺癌PC3细胞RhoA、ROCK1 mRNA和蛋白表达进而抑制RhoA/ROCK1信号通路的激活有关。
