制药车间布局设计若干问题的探讨
2021-03-25姚玉成
姚玉成
(正大天晴药业集团股份有限公司,江苏连云港 222062)
1 问题的提出
当前中国药厂正取得蓬勃发展,但是,伴随着大量的药厂建设,制药车间厂房在前期设计方案中同时也暴露出若干问题,其中一大部分是由于在具体的布局设计过程中存在考虑不周、设计不当、设计不足或过度设计等原因造成的。众所周知,从事药品生产活动,应当遵守药品生产质量管理规范及相关法律法规[1],本文主要针对如何通过合适的制药车间布局设计,最大限度地降低使用该厂房生产药物药品的产品质量风险,确保药物药品的生产质量,同时提高生产效率,关于其他常规的消防、安全、环保、节能等设计注意事项未着重展开论述。
制药车间布局设计首先要关注药品生产质量,最大限度地降低药品的污染、交叉污染、混淆和差错风险。在药品生产领域,质量源自设计QbD(Quality by Design)理念指出,药品质量首先是设计出来的,然后是生产出来的,不是靠最终检验出来的。QbD将质量控制重心前移,强化前期的系统全盘设计,预估出拟生产产品的质量,并严格生产过程以达到预期的药品质量。
药厂厂房、设施、设备、工艺等方面的设计是否科学、合理、精心,将在潜移默化中对药品生产质量产生基础性、支撑性、持久性的重要影响。良好的药厂厂房工艺布局设计,能带来药品生产质量的提升,提高药厂的生产效率,加大安全、环保水平,减少不必要的厂房建设、运营等成本支出。
制药工程设计工作的好坏,从大的方面来说,可以直接影响到药品的生产质量,也关乎用药患者的生命健康;从小的方面而言,影响到药品生产厂房的使用效率,如果厂房前期设计方案把关不严,项目建设实施时,轻则导致小改小修,重则造成较大返工浪费,影响到药厂的初期建设投入及日常运营成本,事关药厂的市场竞争力。
2 问题的分析
GMP 早在1963 即诞生,催生于真实发生的重大药品生产质量事故灾难。如今,GMP 已获得国内外制药产业界公认,符合药品生产质量管理的基本规律,代表了现代药品生产质量管理的方向,它注重管理理念与科学技术的有机结合,极端重视药品的生产质量、安全和受控,全面规范影响药品生产质量的硬件、软件、人员、物料等各方面的每一个因素,但是其严格严谨却不机械教条,奉行基于科学知识、基于实验数据、基于风险评估的持续改进(Continual Improvement)精神。当然,基于风险评估的内涵不能理解错,它是基于科学知识、实验数据和丰富经验的风险分析,不是乱作决定。
随着网络的发达,资讯的互通有无,国内制药人的消化吸收,许多先进的药品生产理念出现在国内药厂设计方案中。比如:装配式模块化操作间(厂房)设计;立体化重力流固体制剂车间布局;无尘化密闭化生产及物料转移,防止粉尘交叉污染理念;通过核心操作区的隔离器技术(Isolator Technology)降低无菌药品生产背景区域的环境条件;通过核心操作区的吹灌封技术(Blow/Fill/Seal Technology)降低无菌药品生产背景区域的环境条件;重视夹层和/或技术层的检修操作,采用穿墙式、穿楼板式设计,尽量减少对洁净区的不利干扰;重视车间主要操作工序参观检查面的设计,让人们不用经过繁琐更衣就可直观了解关键工序现场操作情况;对于高效能、高活性HPAPIs(Highly Potent)药品的密闭化、绿色化生产,单向流理念,保护质量保护人员保护环境一体化;集生产、存储、质检、公用工程和辅助设施等功能于一体的超大体量联合厂房思想;空调分区化,布局分区化理念;精准投料、用料等精细化生产思想;洁净室排水的空气阻断(Air Break)等。制药工程设计需要先进性和实用性,制药工程设计者应不断学习,与时俱进,尽量做到设计理念国内领先、国际先进。
但是,在具体的国内制药厂房设计领域,失败或欠缺的设计案例也不乏其例,常见的设计不足或缺陷有:
(1)人流、物流路线不流畅,松散不紧凑,路线设计臃肿,经常出现“走冤枉路”的情况。特别是针对大宗物料人工转移的物流路线,物料输送路程简捷是非常重要的,如果不必要的路线过长,不仅增加操作工的劳动负担,延长了劳动时间,降低了工作效率,而且增加了物料在沿途受到污染,发生混淆差错的风险。例如,在具体的药厂车间物流路线设计时,可以采用U 型布置长条式流水线操作,优化人流、物流路线,尽量减少物料特别是大宗物流的转移距离。在人流、物流路线设计上,“厂区和厂房内的人、物流走向应当合理”[2],不能机械地理解人物流不交叉,通常在布局设计时,将厂房“总的人流口”与“总的物流口”分开且相互保持一定距离防止产生不利干扰,但是不能教条地认为所有人流物流都分开,否则没法解释人带物转移的问题。GMP 关注的是人物流的路线设计应首先要确保,原辅料、包材、中间产品、成品等在建筑内部及建筑之间周转通过时防止受到污染[3],制药车间厂房人物流路线设计要抓住这个关键点,否则会事倍功半。
(2)洁净区面积臃肿,或B 级区臃肿,洁净区(室)“虚胖”,造成空调、设备、能耗等产生不必要的浪费。同一个洁净操作间内安装多套同功能工艺设备,考虑到某个特定工序生产操作,在不能证明其是完全密闭的情况下,同一个洁净室内不能同时生产两个不同的产品品种,如果单个工序操作间面积过大,虽然面积上能够满足多个产品同时生产,但是却只能同时生产同一个产品,势必造成操作间、面积、设备等资源闲置浪费。另外,对于生产含HPAPIs 物料暴露的区域,如果不能证明同一洁净区内人员、物料流动是无交叉污染的,则同一洁净区内不能同时生产两个不同的含HPAPIs 物料的药品品种。如果同一洁净区面积过大,当生产某个HPAPIs 产品时,此洁净区内由于不能同时生产其他品种,同理也造成不必要的洁净区(室)、设备等资源闲置浪费,降低了使用效率。在药厂洁净区布局设计时,不仅要避免单个洁净室面积过大,而且要避免洁净室数量过多。众所周知,药厂洁净室均要进行洁净度定期确认验证和日常环境监测,多一个洁净室即多一份QC 洁净度检测成本。这在纯化水、注射用水等使用点设置上也是同理,多一个用水点即多一份QC 水质检测成本。因此,减少不必要的洁净室,减少不必要的纯水点和注射水点,“瘦身”才能提高活力和竞争力。
(3)同一栋厂房内的空调房、水处理等公用工程房间、库房等与生产车间设计时相互穿插,须综合考虑,方案设计时不予注意,实施生产操作时就易发生串岗。空调、制水等公用工程正常的操作、检修工作的进出通道与车间正常工艺生产操作的进出,存在妨碍干扰。“应当采取适当措施,防止未经批准人员的进入。生产、贮存和质量控制区不应当作为非本区工作人员的直接通道。”[2]如果将各区适当独立分区设计,则会给日常运行维护带来诸多便利性,更重要的是尽量减少对车间正常生产操作带来的负面影响。
(4)在生产工艺流程中处于相邻工序的操作间,本来可以相邻安排,但是在车间内部工艺布局设计时,却予以拆散分离,“工艺流线松散,不紧凑,没有压实”。导致上下游工序物料输送、转移,相隔甚远,距离过大,大大牺牲了生产效率,给药品生产质量带来不必要的负面影响,增加了额外的质量风 险。
(5)口服固体制剂车间OSD(Oral Solid Dosage)洁净区“洁净走廊不洁净”。在常规的OSD 车间设计上,洁净走廊被广泛采用,通过洁净走廊可以打通进出多个工序操作间,极大地方便了生产操作。为了有效降低粉尘交叉污染,特别是单走廊设计的OSD 车间,洁净走廊通常是正压差最大的,理论上讲,正压最大的洁净走廊可以有效分隔开两侧洁净操作间的空气交叉污染,使得易产尘操作间的空气不能扩散、流出到其它房间。但是这样的洁净走廊也是OSD 车间粉尘污染的“命门”。试想,如果洁净走廊被污染了,势必会污染到所有固体车间洁净室。这样就理解了,为什么易产生粉尘暴露的洁净操作间与洁净走廊之间不宜直接开门连通。与洁净走廊相连的易产尘、易产生污染的操作间增加必要的缓冲前室,不是“多此一举”,而是有效降低粉尘交叉污染的“明智之举”。
(6)“滥用洁净走廊”。可能是设计人员在固体制剂车间洁净区设计思路约定俗成了,不管碰到什么洁净区,首先想到了设置洁净走廊。于是药厂不仅有了D 级走廊,而且还有众多的C 级走廊,B 级走廊。首先,要摆脱思维定式,药厂车间布局设计时洁净走廊不是必须的,设置洁净走廊的初衷应该是便于生产操作,打通同一洁净区内不同工序的操作间进出通道,或者是用来打通某一工序的多个不同产品操作间。如果在某个特定洁净区设计时,仅针对某一个特定工序且同时只生产某一个产品,例如在设计冻干粉针车间时,将其C 级配液工序独立设计,自成一体,其人员净化用室、物料净化用室均单独设置,其他辅助房间如清洗间、存放间、称量间等均可直接对着配液室开门,为了配液洁净区的紧凑集中布局,如果再设置C 级走廊就是“画蛇添足”了。同理,在冻干车间的B+A 级灌装机房间,也不需要把胶塞灭菌柜、工器具灭菌柜出口单独设计成灭菌后室,然后再通过B 级走廊与灌装间相连。考虑到目前灭菌柜设备制造技术成熟,均带有灭菌、干燥、降温等功能,双扉灭菌柜在出口门开启时不再有热气蒸腾的现象,不会对灌装间洁净环境产生不利影响,故完全可以将灭菌柜出口直接安装在灌装间内,取消灭菌后室和B级走廊,这样不仅节约了B 级洁净区的面积,而且还可以有效缩短灭菌后物品转移至灌装机的路线长度,降低灭菌后的无菌物品因为转移而再次被染菌等污染风险。
(7)对于相互之间有开门或开有传递孔(Transfer Hole or Mousehole)的相连房间“跨级别”理解机械化、教条化。在药厂洁净室布局设计时,机械地认为只有C 级洁净室才能和B 级洁净室相连,只有D 级洁净室才能和C级洁净室相连;当人(或物)进入洁净区时,机械地认为只有先从非洁净区进入D 级洁净室后才能再进入C 级洁净室,只有先进入C 级洁净室后才能再进入B 级洁净室;同理,当人(或物)退出洁净区时,机械地认为只有先从B 级洁净室退出到C级洁净室后,才能再从C级洁净室退出到D级洁净室,然后再从D 级洁净室才能退出到非净化区。这是一种典型的对GMP 洁净室壳式污染控制理念(Shell-like Contamination Control Concept)的死板教条理解。在实际洁净室布局设计中,应根据药厂生产产品的品种属性、产能情况、工艺特点、设备形式等因素综合考虑,具体问题具体分析。例如,人员可以从非净化区经过适当设计的更衣室后直接进入B 级洁净区,这种设计要注意更衣室的最后阶段在静态下应与其通向的洁净室的洁净度相同,未必非要设计成“先穿C级洁净服进入C 级洁净区后再套更、穿B 级洁净服进入B 级洁净区”的更衣模式。
另外,采用传递孔方式可以将已灌封好的最终灭菌无菌产品从C 级灌装间直接传至非洁净生产操作区,也可以采用传递孔方式将已灌封好的非最终灭菌无菌产品从B 级灌装间直接传至非洁净生产操作区。有些企业或洁净厂房设计人员担心,从高级别洁净区经传递孔通过传送带传输产品至低级别区域,因传递孔两侧区域压差较大,在低级别区域是否会产生空气涡流并对高级别洁净区造成污染?实际测试表明,涡流是随着气流向低级别区方向流动,不可能倒灌入高级别洁净区。对最终灭菌产品而言,从C 级区对非洁净生产操作区约有20 Pa 以上的正压差,已轧盖产品经传递孔通过传送带送往位于非洁净生产操作区的灭菌区,上述压差已经足够防止来自非洁净生产操作区的污染,不需要在C 级区与非洁净生产操作区之间设单独送风夹道,形成实际无人操作的“D级缓冲带”。对非最终灭菌产品而言,如需要经流通蒸汽热处理的安瓿产品,从传递孔传输到非洁净生产操作区时,由于产品已经在A 级区完成融封,可直接从B 级区的灌封间传出。如完全采用无菌工艺生产西林瓶灌装产品,轧盖在A 级区或A 级送风环境中完成,已轧盖西林瓶经传递孔可通过传送带从B级区传输到C 级区,或从C 级区传输到非洁净生产操作区的外包区,也可直接从B 级轧盖间或C 级的轧盖间传出[4]。
关于跨级别转移,欧盟无菌药品第2 版征求意见稿,删除了“通常来讲仅C 级洁净室可以与B 级无菌工艺区域相连”条款,增加了跨级别传递孔传递的条款,与FDA 有关规范保持了一致。两者均认为可以“使用传递孔来传递灌封密闭产品从无菌间至相邻的无级别房间”,着重强调了此处的气流流型试验应证明空气不会倒灌,传递孔两侧需要持续维持足够的正压差,即需要连续监测,以便确保压差出现过低时能够及时发现并采取纠偏措施,恢复无菌工艺间的洁净环境[5-6]。
(8)对洁净区废弃物传出通道的理解机械教条化。在药厂洁净室布局设计中,机械地认为每个洁净区都要设置独立的废弃物传出通道。GB 50457—2019《医药工业洁净厂房设计标准》关于废物通道的条款5.3.5:“医药洁净室产生的废弃物应有传出通道。易产生污染的废弃物应设置单独的出口。具有活性或毒性的生物废弃物应灭活后传出”。此条款的条文解释为:医药洁净室生产过程会产生各种废弃物,如废玻璃渣、废内包材、中间质量检查的废弃物、生物发酵或动物细胞培养产生的废液、废弃的组织细胞等。应根据生产工艺和生产规模以及废弃物的性质、数量等来确定是否需设置单独的出口。有些废弃物须及时传出生产区,以免对生产环境造成污染,如水针生产中安瓿拉丝封口后的废玻璃渣,废弃的动物细胞(如鸡胚)等,其数量多,污染大,不易密封,留在洁净区会造成环境污染,所以应设专用废弃物通道及时传出。有些生物制品生产过程产生的有毒和有活性的废弃物,必须灭活后传出,以免造成生物安全事故,对此必须配置相应的灭活设施(如蒸汽灭菌柜等)。对于规模不大、工艺简单、废弃物数量不多的生产,可结合平面布置及原辅料入口,综合考虑废弃物的传出通道。如可将生产过程中产生的少量废弃物妥善保存并密封包装,在生产结束后通过原料入口气锁或传递柜传出。对于无菌洁净室,如废弃物不多,包装良好,不会产生污染,也可通过相邻低级别区将废弃物传出,而不必从无菌洁净室直接对外设置专用的废弃物传递通道[7]。
(9)在具体洁净室内,回(排)风口及通风设备位置布局时,通常忽视室内风向的因素。在药厂选址、厂区规划布局时,通常会考虑风向要求,应远离空气污染源,如果不能远离的,空气污染源应位于厂区全年最大频率风向的下风侧,尽可能减少污染源对医药工业洁净厂房的影响。在具体的某个洁净室房间内,也应注意房间内的风向要求,如果洁净室内存在空气污染源,也应尽可能减少房间内空气污染源对该洁净室的空气污染,洁净室内的风向尽量让室内空气从相对干净的区域流向相对污染的区域,而不能让室内较脏的空气随意扩散;如果洁净室内存在无菌的A级区,应让无菌的空气流向非无菌的区域,不能让非无菌的空气流入无菌的区域。例如,在进入洁净区的“穿洁净服间”的回排风口设置时,回排风口应位于还未穿洁净服的一侧,不宜设置在已穿好洁净服的一侧。在进入B 级区的“穿B 级洁净服间”,考虑到是穿无菌服,在车间布局图设计上通常将双扉衣物灭菌柜出口设置在“穿B 级洁净服间”,但应注意衣物灭菌柜出口也宜设置在已穿好无菌服的一侧,不宜放在还未穿无菌服的一侧。研究表明,人体表面无时无刻不在产生大量的微粒,人员的呼吸、说话交流也会向空气中传播微生物,因此操作人员是无菌生产洁净室内的最大污染源,是对无菌产品的最大污染风险来源。设计中应合理设计无菌生产洁净室内风向及人流路线,避免穿越单向流保护的核心操作区,同时人员的站位必须合理设计,应处于室内气流的下风向,以防止对产品的污染。同样出于减少无菌生产洁净室内污染的考虑,不必要的人员、不必要的活动(如常规的中间检测)、不必要的房间(如洁具存放)等尽量避免设置。
(10)在制药厂房布局设计时,轻视产品的致敏性、致病性、毒性、活性等属性特征。我国药厂通常产品众多,且由于意识到研发创新的重要性,导致新产品层出不穷。为了节约投资,药厂车间、检验室通常会遇到属性不一的产品。特别是在生产车间布局设计上,为了便于人员总更衣管理,某些企业经常将普通属性产品和具有毒性活性产品的生产区采用一个集中总更衣布局,人员经过同一总更衣区穿上工作服后再分别进入各自的生产洁净区和包装间,理想地认为药品暴露是在净化区,净化区已经分开,就可以避免毒性活性产品对普通产品的污染。然而,细究起来,在药厂实际厂房布局及生产操作中,车间洁净区通常会在彩板墙上设计有传递孔,将洁净区与普通区包装线相连,含活性产品物质可能会从传递孔流出至包装间,如果产品外表面从洁净区出来时黏附有活性物质,也会将活性物质带出洁净区,另外如果含毒性活性产品在普通区包装时发生破损,也会污染到包装工人。当活性物质吸附在包装工人工作服上,包装工人在厂房内走动又可能将活性物质扩散至他处;活性产品车间维保人员可能因维修工艺设备或更换活性物质过滤器等而接触到活性物质,如果再到普通产品车间洁净区内从事维保工作,也可能导致活性物质扩散到普通产品车间内。故,根据产品属性特征,进行适当的分厂房布局(和/或)分区化布局,也不是多此一举,而是明智之举。
另外,在厂区、车间建筑物设计上是采用先外形后内在布局,还是先内后外的形式,是采用先总图后工艺,还是先工艺后总图的形式,即外形决定工艺布局,还是应该工序布局决定外形。设计人员要统筹、兼顾考虑,不能简单地就认定谁就决定谁,而是要结合厂房建设项目实际情况、规划要求等,具体问题具体分析。
制药车间设计深度很重要,大的注意事项容易把握,也易引起人们的重视,如同用“望远镜”观察一样,大概扫几眼感觉很好,过得去,差不多。但是制药车间设计的价值,最终要体现在生产使用上,需要具体的操作员工长期的、身临其境的、日复一日的操作使用,操作员工的使用感受,顺手不顺手,好用不好用,如同是在用“显微镜”观察。
在我国药厂工程建设中有一句口头禅“好的工程来自好的二次设计”,这句话也深刻反映了制药车间设计的尴尬——初始的设计深度不足,设计考虑不周,在药厂工程建设中经常需要进行“二次深化设计”。很多药厂车间建设项目由于设计深度不足,或由于设计需求不够明确清晰,设计需求发生变更等,而导致房间(区域)不是面积过小就是过大,层高不是过低就是过高,房间与设备没有高度融合,同专业及不同专业打架,本该预留的却没预留,预留不准,不好柔性扩展,虽然中规中矩但却不好用。另外,厂房是给人用的,这就涉及到人因工程学HFE(Human Factors Engineering),人因工程通常是隐形的,因其并无明确的技术指标,而是在外观形态,人机界面,色彩搭配等设计方面需要更多地考虑使用者的身心感受。对于具体的制药车间布局设计也不能照搬照抄,要结合药厂各自的实际具体情况,产品的具体品种、属性及产能要求,生产工艺的具体流程,兼顾工艺设备的选型装备水平,有针对性地进行设计工作,努力做到设计方案既科学合理又与客观条件相匹配(Scientific &Commensurate)。
3 示例说明
当下,全球畅销药榜单中大分子药物已经占据半壁江山以上,多数大分子药物由于不能口服,常为无菌药品,且不能高温灭菌,故其生产车间通常为采用除菌过滤的非最终灭菌无菌车间。在车间布局设计上,首先要梳理生产工艺,有的放矢,例如图1 是非最终灭菌卡式瓶注射剂车间流程简图,主要物流为原辅料称量、配液、除菌过滤、无菌灌封,灯检包装等,另外还有卡式瓶、胶塞、铝盖等的清洗灭菌。产品种类为非最终灭菌卡式瓶注射剂药品,主要工艺设备有卡式瓶洗灌封轧联动线,胶塞清洗灭菌机,免洗铝盖的灭菌机,工器具灭菌柜,药液配制及除菌过滤系统等。根据非最终灭菌无菌产品的相关规范要求,按洁净度从高到低将该车间大致分成3 个净化区域:用于产品无菌灌封的“B+A 级”的“灌装区”,用于药物配液的C 级“配制区”,用于瓶子、胶塞、铝盖、工器具、洁净服的洗灭的D 级“洗瓶区”。图2 是制药车间内部布局图示例(非最终灭菌卡式瓶无菌注射液)。
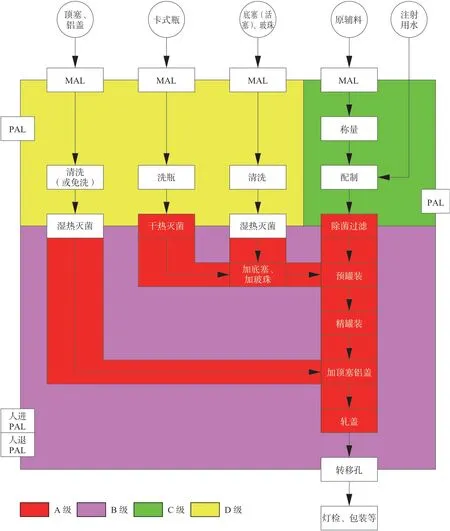
图1 非最终灭菌卡式瓶注射剂药品生产工艺流程简图Fig.1 Manufacturing process flow diagram of aseptic processing cartridge injection drug products
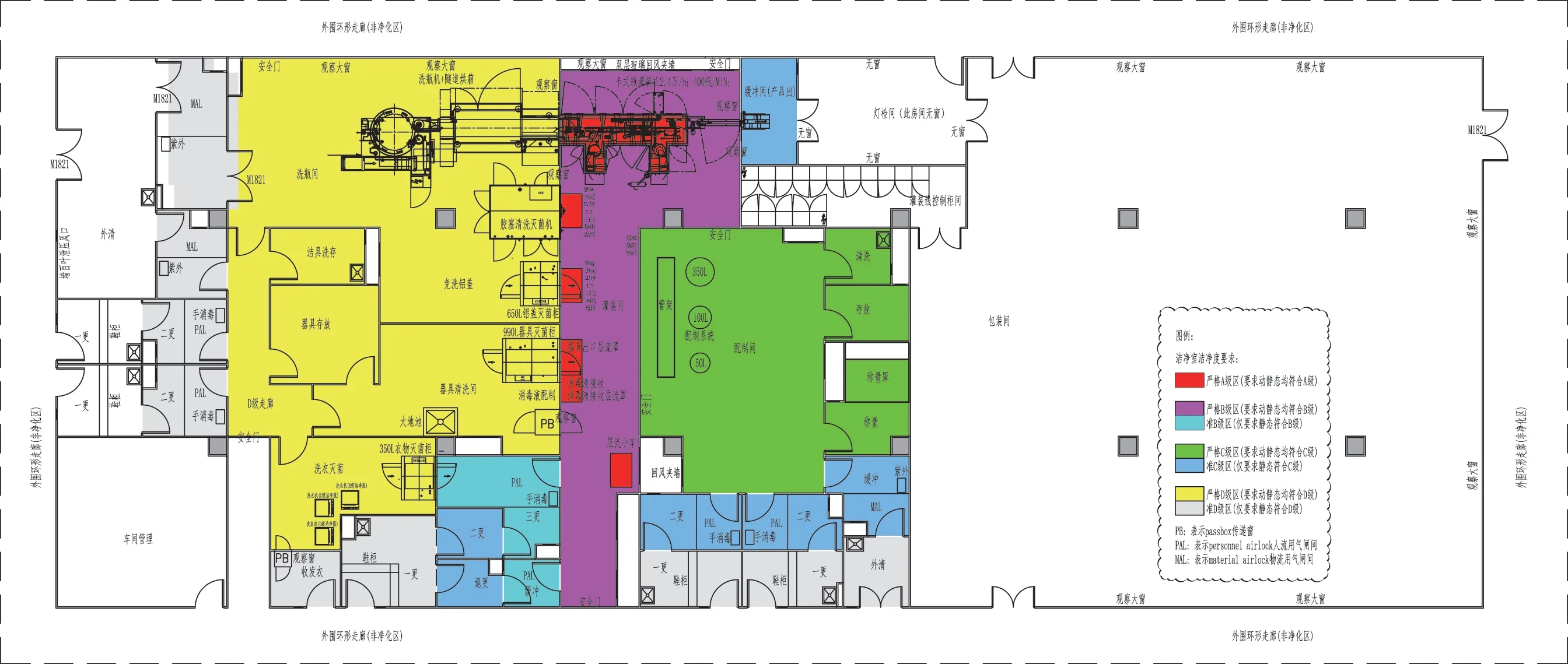
图2 制药车间内部布局图示例(非最终灭菌卡式瓶无菌注射液)Fig.2 Example diagram of pharmaceutical workshop interior layout(aseptic processing cartridge injection)
关于“灌装区”布局设计思路:为了便于灭菌后工器具、胶塞、铝盖等转移,减少不必要的开关门操作,没有单独设计灭菌后室或B 级洁净走廊,而是将产品灌装及无菌工器具、灭菌后铝盖胶塞的转移等区域设置成一个大的灌装间,该房间净化要求为B级背景的局部A 级。为了便于员工不用经过繁琐的无菌更衣就可以查看灌装间内的实际情况,灌装间采用可参观式设计布局,在靠近外围走廊处设置双层回风玻璃,既满足参观检查便捷要求也考虑风量较大的回风夹墙要求。操作人员进入灌装间采用从外围普通走廊直接更衣的方式,在三更间内穿无菌外衣,三更间设计成人员单向流动,无菌服双扉灭菌柜出口设置在三更间,尽量缩短无菌服的转移路线。考虑到穿无菌服时尽量减少对无菌服的污染,在三更间地面通过画线管理,穿衣前后严格分开,三更间回风口位于穿衣前的一侧,无菌服灭菌柜出口位于穿衣后的一侧,灭菌后的洁净服由已穿好无菌外衣的人员拿出,最大限度地减少对灭菌后无菌服的染菌污染风险。三更间的门设置成互锁状态,不能同时开启,并由验证数据确定三更间入口门关闭后,进入灌装间门可以开启的延迟时间。此三更间洁净度要求为静态条件下满足B 级要求。为了保障三更间的更衣无菌水平,三更间设计成只进不出的单向流动,灌装间人员退出通过单独的退更通道,用于脱掉洁净服,退更通道紧邻灌装间的房间设计成气锁间,此气锁间门不能同时被打开,并同理设有延时功能,防止其对灌装间洁净度产生不利影响,该室洁净度设定为静态条件下满足B 级要求即可。灌装间用过的工器具通过带有风淋装置的传递窗传出,在隔壁相邻的器具清洗间清洗灭菌后再传回灌装间使用。非最终灭菌卡式瓶注射剂
产品经轧盖密封后,从灌装机A 级区轧盖工位出来后进入B 级灌装间,为了便于输送线自动输送,在B 级灌装间通过传递小孔直接离开灌装间,进入“产品出缓冲间”,注意输送带在不同洁净度要求的区域应断开设置。产品出缓冲间,不是严格意义的洁净室,包装灯检人员可以穿着普通区工衣直接进入此房间,其洁净度设置为静态条件下满足C 级要求,该缓冲间顶部设置高效送风口,可以由灌装间净化空调箱一起送风,但是不宜从该缓冲间回风到灌装间的净化空调箱,此缓冲间可以采用只送不回、全排风的方式。灌装间与产品出缓冲间应设置实时压差监测装置,要求持续维持足够的正压,为了便于管控,可以将此处压差合格标准设成警戒限和行动限,例如,压差值警戒限设定成15~20 Pa,当低于警戒限值时,压差监控系统即声光报警并提示相关人员及时查找原因并提高压差恢复到合格范围;此处的压差值行动限设定成10~15 Pa,当低于行动限值时,不仅要报警及恢复,还要及时对灌装间进行洁净度确认。
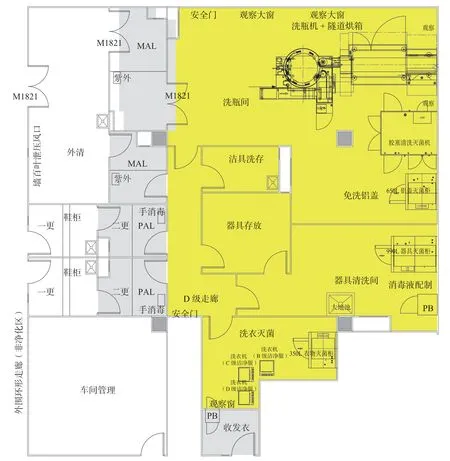
图3 图2 的局部放大图(洗瓶区)Fig.3 Local enlargement(bottle-washing area)of Fig.2
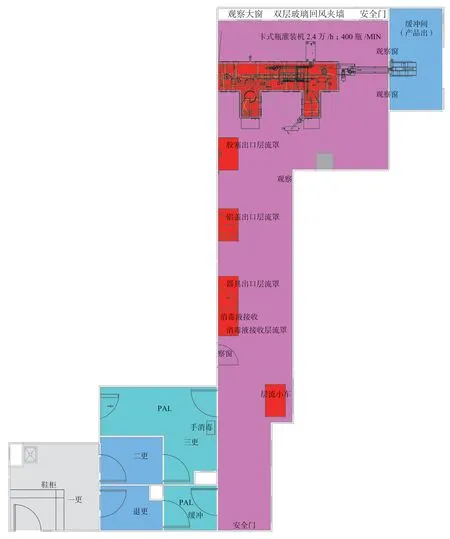
图4 图2 的局部放大图(灌装区)Fig.4 Local enlargement(filling area)of Fig.2
关于“配制区”布局设计思路:为了尽量缩短配制系统到灌装机的距离,配制罐定位布局时设计在紧邻灌装间的一侧,考虑到此配制区的功能比较单一,通常不会出现不同产品同时配制的情况,此车间洁净区布局没有设计C 级洁净走廊,而是采用大的主操作间——配制间,在配制间内开门设置一些小的功能套间,如清洗间,存放间,称量间。配制间及其相连的功能间均为严格意义的C 级洁净区。配制区的人流气锁间和物流气锁间设计成静态C 级。人流气锁间兼有穿洁净服功能,并在人流气锁间地面通过划线管理,严格区分出已穿洁净服的“后区”与未穿洁净服的“前区”,避免两区之间随意互窜。同理,物流气锁间兼有物品消毒功能,也采用划线管理,严格区分出物品已消毒的“后区”与还未消毒的“前区”,注意避免随意互窜。气锁间的回风口均设置在靠近较低洁净要求的一侧,确保气锁间内的室内风向是从干净区域流向相对脏区。另外,为了保护气锁间的洁净度,外围的“一更间”和“物品外清间”通常也采用高效空气过滤器送风,但是只送不回,采用全排风形式,其洁净度要求可以企业内控为仅静态时达到D 级即可。
关于“洗瓶区”布局设计思路:将洗瓶机、隧道烘箱、胶塞清洗灭菌机、铝盖灭菌机布局在一个大的洗瓶间内,瓶子、胶塞、铝盖通过单独设置的较大的物料气锁间直接进入洗瓶间,缩短大宗物流的转移距离,提高生产效率减少劳动强度。另外,用于灌装间传出工器具的传递窗,工器具灭菌柜,和消毒液配制操作均设计布局在器具清洗间,尽可能缩短工器具传出、清洗、灭菌和再次传入灌装间的转移路线长度。考虑到车间设计布局紧凑性,减少不必要的面积浪费,灌装区、配制区及洗瓶区的洁净服均设置在一个洗衣间集中洗衣,考虑到是不同洁净区使用的洁净服,宜采用三台洗衣机,即B 级洁净服的洗衣机,C级洁净服的洗衣机,D 级洁净服的洗衣机,分别清洗各自的洁净服,减少洁净服清洗验证的工作量。
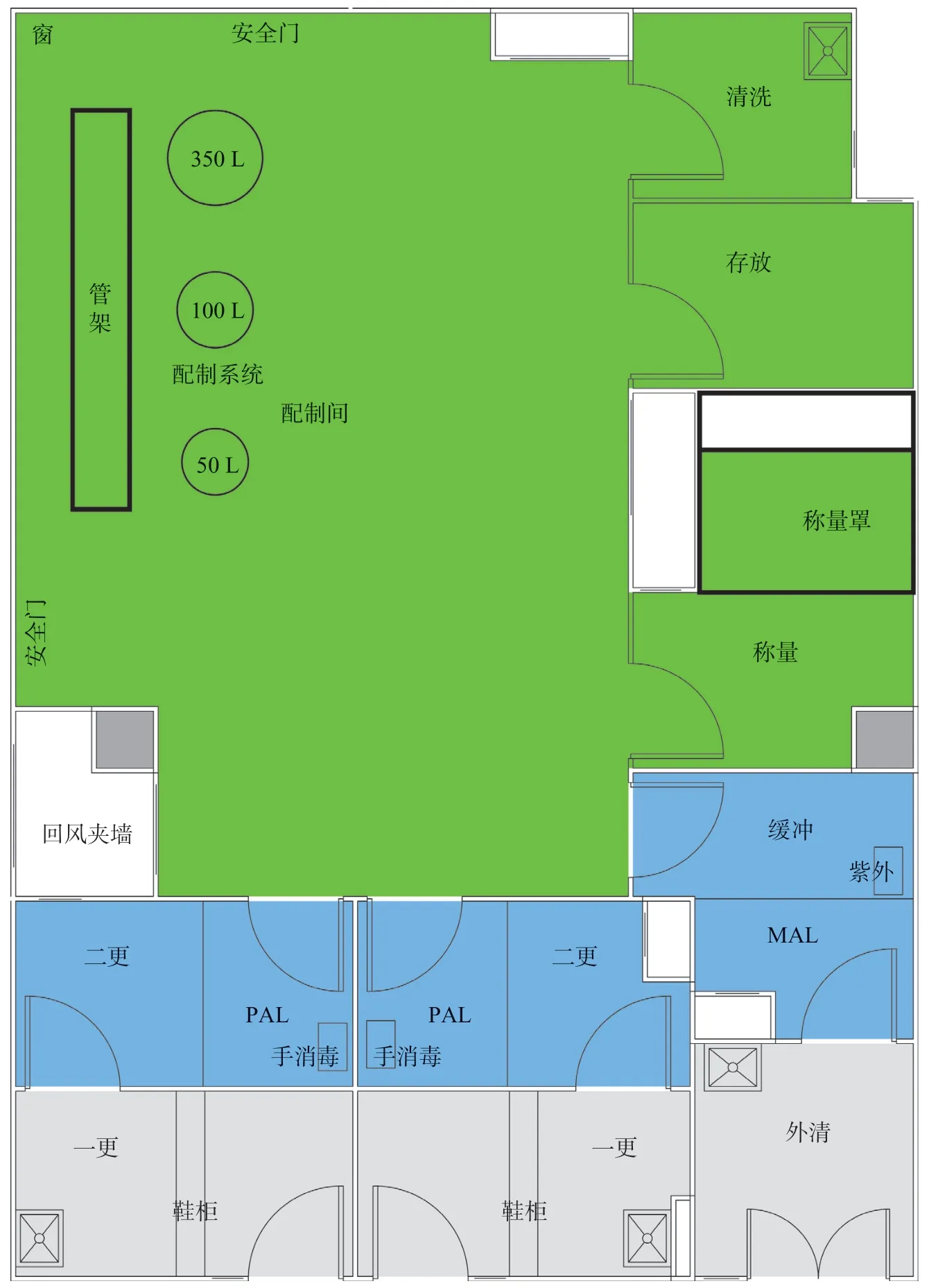
图5 图2 的局部放大图(配制区)Fig.5 Local enlargement(preparation area)of Fig.2
4 结束语
目前,全球制药业的发展相当迅猛,关于制药车间设计方面的理念、思路、规则、注意事项等越来越趋于成熟和完善,制药车间布局设计中遇到的许多问题、疑点通常不会是设计者初次碰到,有些制药车间布局设计问题,其实早就被国内外制药前辈、专家、学者细致考虑、分析过了,并提出了解决、完善或优化方案。故在制药车间布局方案设计时,需要大量、广泛、综合地检索、学习、思考国内外药品生产规范、相关设计标准、条文说明、专家解答、药厂案例等资料。例如,欧盟GMP 通常涵盖众多,包括药品通则(Basic Requirements for Medicinal Products)、 原料药通则(Basic Requirements for Active Substances used as Starting Materials)、GMP相关文件(GMP Related Documents);ATMPs 药品GMP 要求(GMP Requirements for Advanced Therapy Medicinal Products),和约20 个附录(Annexes),另有术语表(Glossary)及其它GMP 相关文件(Other Documents Related to GMP)。中国GMP 也有通则和众多附录、药品GMP 指南等,另外,中国经验丰富的学者、专家也曾给出了大量具体的GMP 实施解答。
为了保证药品生产质量,在制药车间布局设计时首先要系统地、广泛地、深入地学习GMP 相关法规、指南,做到“博学之、审问之、慎思之、明辨之、笃行之”。GMP 是舶来品,有许多先进的思路、理念、方法、案例等,值得设计人员学习借鉴。制药车间设计应该有唐僧取经的精神,师夷长技以自强,不仅要学习中国版GMP,还要学习国际原版GMP。在制药工程设计中,首先要学习、吃透GMP 知识、规范、指南,药政法规以及相关政策、设计标准、条款等,才能做到制药工程设计的合规性。另外,仅对规范条款死记硬背还远远不够,更重要的是亲身投入药厂工程技改项目实践,在具体实践中有所感悟、有所心得。同时,要广泛学习药厂的设计案例,做到制药工程设计的先进性、实用性。
当下,新冠疫情仍在全球肆掠,个别发达国家加大贸易、技术等摩擦,中国制药工业也受到一些不利影响,然而,危与机并存,从长远来看,立足于国内巨大的内需市场,将促进中国制药产业界自强不息,早日建成制药强国。细节决定成败。制药工程设计只有建立在对规范条款、工艺过程、设备等科学知识、法规政策的非常熟悉上,以及丰富的阅历和经验上,才能产生好的设计,既能满足合法性、合规性,又具有先进性、实用性,实现药品生产厂房的质量受控(减少药品生产的污染交叉污染混淆差错)、生产好用(易操作的高效性,可扩展的灵活性)、安全环保节能等方面的有机统一。要先熟悉生产工艺,再熟悉设备,然后再谈设计。在制药车间设计上,也要大力发扬工匠精神,对职业敬畏,对工作执着,对设计方案勇于担责,极其注重细节,精心设计,在持续改进的道路上永不停步。
