肺癌免疫治疗预测指标在非小细胞肺癌免疫治疗中的预测价值
2021-03-20周英吴宾刘红岗段鸿涛常宁张勇许天齐张艰
周英 吴宾 刘红岗 段鸿涛 常宁 张勇 许天齐 张艰
1空军军医大学第一附属医院呼吸与危重症医学科,西安710032;2空军军医大学第二附属医院胸外科,西安710032
肺癌免疫治疗不仅革命性地改变了癌症治疗的格局,而且也改变了癌症治疗的理念[1]。目前临床上最广泛、最成功使用的是免疫检查点抑制剂(i mmune checkpoint inhibitors,ICIs)[2],如细胞毒性T 淋巴细胞抗原4和PD-1/PD-L1。 “精准医疗计划”[3]是期望个体化治疗能为患者带来最大化临床获益,而生物标志物为个体化治疗的指明了方向。PD-L1 在免疫治疗中初露锋芒。研究发现,PD-L1高表达与ICIs治疗的高应答率及临床获益有关,PD-L1高表达者有更好的总生存期 (overall survival,OS)和无进展生存期 (progression-free survival,PFS)[4-6],但是免疫治疗未在所有PD-L1表达阳性的患者中获益[4]。有研究发现无论PD-L1表达水平如何,患者都表现出临床获益[7]。肿瘤突变负荷 (tu mour mutation burden,T MB)是另一种预测生物标志物。虽然大量临床研究结果显示,接受ICIs的肺癌患者中,高T MB具有更高的总体应答率、PFS 及持久的临床获益,甚至是OS[8-9],但是T MB成本高且耗时,需专业人士解读报告,缺乏标准化检测平台和统一的T MB 阈值。还有一些其他的生物标志物也都表现出一定的缺陷。
越来越多的研究结果证实系统性炎症反应与肿瘤的发生、发展有着千丝万缕的联系[10],而外周促炎状态与癌症患者较差的预后有关[11]。许多血液常规参数被认为是癌症患者潜在的炎性生物标志物,且与癌症的预后有关,如白细胞计数、绝对中性粒细胞计数、绝对血小板计数、乳酸脱氢酶(lactate dehydr ogenase,LDH)水平和白蛋白水平[12-14]。一些潜在的生物标志物,如中性粒细胞与淋巴细胞的比率 (neutr ophil to ly mphocyte ratio,NLR)[15-16]、衍生的中性粒细胞与淋巴细胞的比率[17-18]、Gustave Roussy免疫评分[19]、肺癌免疫预后指数[20-21]等与癌症的免疫治疗预后相关。
然而,以往的研究多集中在非肺癌或非免疫治疗方面,炎性生物标志物在非小细胞肺癌 (nons mall cell l ung cancer,NSCLC)免疫治疗中的预后和预测价值尚不完全清楚。因此本研究提出了简单、实用、经济、方便的肺癌免疫治疗预测指标(l ung cancer i mmunot herapy predictive index,IOPI),即NLR 联合LDH,用来预测接受ICIs治疗的NSCLC患者预后。
1 对象与方法
1.1 研究对象 本研究为多中心回顾性研究,纳入2018年1月至2019年7月就诊于空军军医大学第一附属医院(呼吸与危重症医学科及肿瘤科)和空军军医大学第二附属医院(呼吸内科、胸外科及肿瘤科)的88例确诊NSCLC并接受PD-1/PD-L1抑制剂治疗的患者,随访截至2020年7月。纳入标准:(1)18岁以上的成人患者;(2)组织学或细胞学证实的NSCLC;(3)至少一次根据实体瘤评估(response eval uation criteria in solid t u mors,RECIST)标准1.1对病灶进行评估[22]; (4)使用PD-1/PD-L1抑制剂治疗。排除标准:(1)治疗前1周内有持续非癌症相关炎症、免疫性疾病或终末期肝病或血液病;(2)既往有其他癌症或伴发其他癌症; (3)对免疫治疗过敏或不耐受 (图1)。本研究获得空军军医大学第一附属医院医学伦理委员会批准(KY20202077-C-1)。
1.2 临床资料收集 收集电子病例系统中NSCLC患者免疫治疗前的基线资料:性别、年龄、吸烟史、免疫组织化学染色结果、临床分期、转移部位及转移部位数、驱动基因突变状态、肿瘤细胞PDL1表达状态、体力状况评分、曾经治疗方案、免疫治疗线数、白细胞计数、中性粒细胞计数、淋巴细胞计数和LDH。
1.3 评价标准 每6周根据RECIST 1.1标准[22]对免疫治疗NSCLC患者进行一次疾病评估。完全缓解指所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,至少维持4周。部分缓解指靶病灶最大径之和减少≥30%,至少维持4周。疾病稳定指靶病灶最大径之和缩小未达完全缓解,或增大未达疾病进展。疾病进展指靶病灶最大径之和至少增加≥20%,或出现新病灶。客观缓解率指经治疗后获得完全缓解和部分缓解的病例数占整个可评价例数的百分比,即客观缓解率= (完全缓解+部分缓解)/总例数×100%。疾病控制率指经治疗后获得缓解和病变稳定的病例数占整个可评价例数的百分比,即疾病控制率= (完全缓解+部分缓解+疾病稳定)/总例数×100%。OS定义为从启动免疫治疗到任何原因导致死亡的时间或最后一次随访时间(删失),PFS 为从启动免疫治疗到疾病进展或任何原因导致死亡的时间。
1.4 观察指标 本研究观察的指标:(1)免疫治疗前NLR、LDH; (2)PFS 和OS。绘制NLR、LDH 的受试者工作特征曲线 (receiver operating characteristic cur ve,ROC),计算曲线下面积(area under the curve,AUC)得出NLR、LDH的截断值。根据NLR、LDH 的截断值分为低风险IOPI组(0或1个因素)和高风险IOPI组 (2个因素)。
1.5 统计学分析 数据分析采用IBM SPSS v.22软件和Graph Pad Pris m 8软件。患者基线资料中的计量资料若符合正态分布用x-±s 表示,组间比较采用t 检验;若符合偏态分布用M(QR)表示,组间比较用Wilcoxon秩和检验;计数资料用频数(%)表示,组间比较采用χ2检验或Fisher精确检验。绘制NLR、LDH 的ROC曲线,应用AUC确定截断值。单因素和多因素分析采用COX 风险比例回归模型,把单因素有统计学意义的变量纳入到多因素分析中,结果用风险比 (hazard ratios,HR )、95%置信区间 (confidence inter vals,CI)表示。生存分析采用Kaplan-Meier法和log-rank检验。P <0.05为差异有统计学意义。
2 结果
2.1 NLR 和LDH 的截断值 绘制NLR 和LDH的ROC,得出AUC 分别为0.671、0.649。NLR和LDH 的最大约登指数分别为1.34、1.30,对应指标数值分别为3.4、185,敏感度和特异度分别为75.0% 和58.8%、73.4% 和56.4%。因 此 得 出NLR 截断值为3.4,LDH 截断值为185 IU/L,根据NLR>3.4和LDH>185 I U/L 将患者分为低风险IOPI组(0或1个因素)和高风险IOPI组 (2个因素)。见图2、3。

图1 NSCLC患者免疫治疗研究流程图
2.2 免疫治疗人群基线资料 本研究共纳入88例接受免疫治疗的NSCLC患者,随访时间13.1 (5)个月。其中男74例 (84%),年龄 (61±11)岁,66例(75%)吸烟患者;46 例 (52%)腺癌,35例(40%)鳞癌,7例(8%)其他NSCLC。有26例(30%)患者检测PD-L1 表达量 (采用免疫组织化学法),其中20 例 (77%)阳性 (PD-L1≥1%),6例 (23%)阴性。低风险IOPI组63 例,高风险IOPI组25例,2组各项基线资料差异均无统计学意义(P 值均>0.05)。见表1。
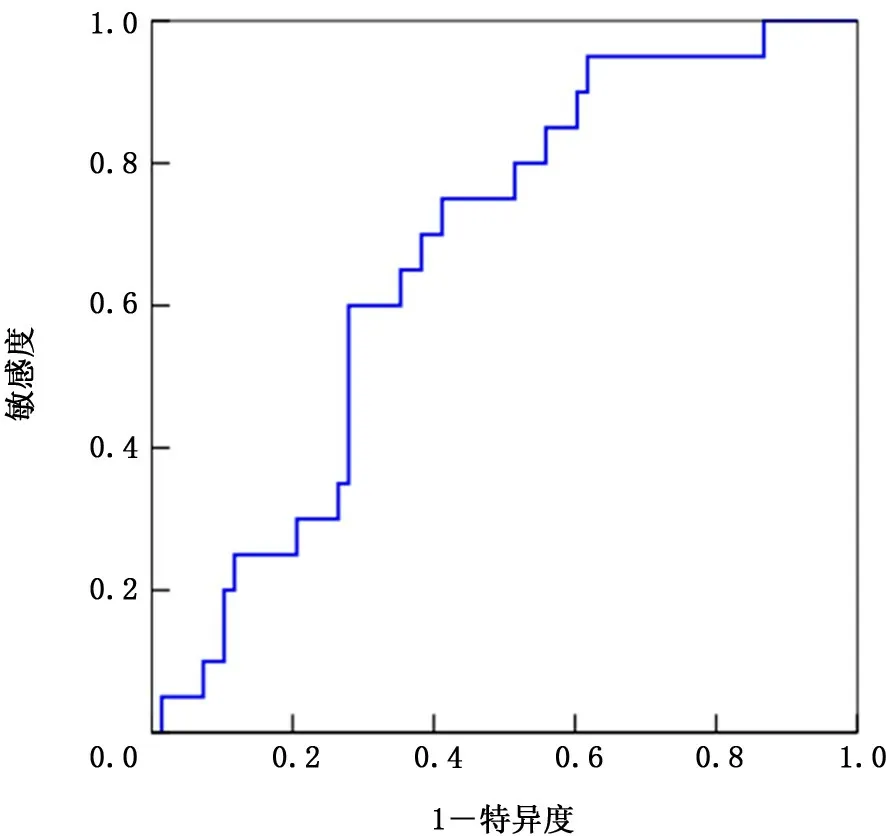
图2 中性粒细胞与淋巴细胞比率的受试者工作特征曲线
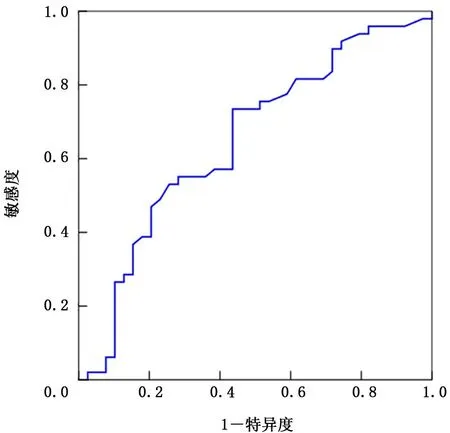
图3 乳酸脱氢酶的受试者工作特征曲线
2.3 预后危险因素及预后分析 88例接受免疫治疗的NSCLC 患者PFS 和OS 分别为11.4 (5.0)个月和12.1 (5.8)个月。通过单因素COX 风险回归模型分析年龄、吸烟史、转移脏器数、免疫治疗线数、病理分型、分期、NLR、LDH 及IOPI分组与PFS和OS的相关性(表2、3)。结果表明转 移 脏 器 数≥2 个、NLR ≥3.4 组、LDH ≥185 IU/L组及高风险IOPI组与接受免疫治疗的NSCLC 患者的较差PFS 相关 (P 值 均<0.05)(表2)。鳞癌患者、NLR≥3.4组、LDH≥185 IU/L组及高风险IOPI组与接受免疫治疗的NSCLC 患者的较差OS相关(P 值均<0.05)(表3)。
将单因素分析中P <0.05的变量纳入到多因素COX 风险回归模型中进行分析。PFS多因素分析模型1:将转移脏器数、NLR、LDH 纳入到多因素分析中,结果显示LDH≥185 IU/L组与较差的PFS显著相关 (HR =2.48,95%CI:1.30~4.70,P =0.006);PFS多因素分析模型2:将转移脏器数和IOPI分组纳入到多因素分析模型中,结果显示高风险IOPI 组与较差PFS 显著相关(HR =1.95,95% CI:1.08 ~3.53,P =0.026),见表2。OS多因素分析模型1:将病理分型、NLR、LDH 纳入到多因素分析中,结果显示鳞癌患者和LDH≥185 IU/L 组与较差的OS显著相关(HR =3.42,95%CI:1.22~9.64,P =0.020;HR =3.28,95%CI:1.15~9.33,P =0.026);OS 多因素分析模型2:将病理分型和IOPI分组纳入到多因素分析模型中,结果显示鳞癌患者和高风险IOPI组与较差的OS 显著相关(HR=3.12,95%CI:1.17~8.35,P=0.023;HR =3.22,95%CI:1.29~8.06,P =0.012),见表3。以上结果表明,LDH≥185 IU/L 组和高风险IOPI组的是NSCLC 免疫治疗疾病进展的独立危险因素,LDH≥185 IU/L 组、高风险IOPI组和鳞癌是死亡的独立危险因素。
进一步通过Kaplan-Meier 生存分析法和log-rank检验比较LDH 不同分组和IOPI不同分组对患者PFS 和OS 的影响。在88 例总人群中,LDH<185 IU/L组35例,LDH≥185 IU/L组53例。LDH <185 IU/L 组 的PFS 高 于LDH ≥185 IU/L组 [12.4 (8.2)个月比7.8 (7.5)个月],LDH<185 IU/L组1年的生存率高于LDH≥185 IU/L 组 (83.6%比56.6%),LDH≥185 IU/L组与LDH<185 I U/L组的PFS和OS比较,差异均有统计学意义 (P 值均<0.05)。低风险IOPI组的PFS高于高风险IOPI组 [11.2 (7.1)个月比7.6 (8.0)个月],低风险IOPI组1年的生存率高于高风险IOPI组 (77.7%比42.9%),低风险IOPI组与高风险IOPI组的PFS和OS比较,差异均有统计学意义 (P 值均<0.05),见图4。以上结果表明,LDH≥185 IU/L 组与高风险IOPI组与NSCLC免疫治疗患者的不良预后相关。

表1 88例免疫治疗非小细胞肺癌患者基线资料
3 讨论
越来越多的研究结果显示,全身炎症反应与肿瘤的发生、发展有着密不可分的关系[10],外周促炎状态与癌症患者不良预后有关[10,13,23]。多个系统性炎症反应的生物标志物 (如C-反应蛋白、白蛋白、LDH、中性粒细胞计数、淋巴细胞计数等)与癌症患者不良预后相关[12-14,24]。然而,这些生物标志物对肺癌免疫治疗效果的影响尚不清楚。
本研究共88 例NSCLC 患者接受免疫治疗,结果显示总人群的PFS 和OS 分别为11.4 (5.0)个月和12.1 (5.8)个月。总人群的中位OS与之前的研究基本一致[4,25-26],但是本研究的中位PFS较其它研究稍长,一是因为本研究一线使用免疫治疗人群比例高 (38%);二是因经济原因,部分患者自行延长了评估病情的间隔时间,远超过每6周评估1次。
本研究发现LDH≥185 IU/L 组是NSCLC 免疫治疗疾病进展和死亡的独立危险因素,LDH≥185 IU/L组比LDH<185 IU/L 组的疾病进展和死亡风险均明显增加 (HR =2.48,95%CI:1.30~4.70,P =0.006;HR =3.28,95%CI:1.15~9.33,P =0.026)。既往研究发现即使在有氧条件下,癌细胞为满足快速增长和增殖的需求,消耗高水平的葡萄糖,导致乳酸产量增加。这一过程被称为War bur g 效应,是由代谢酶LDH 催化的[27]。血清LDH 水平升高与许多实体肿瘤的不良预后有关,如黑色素瘤、肺癌等[27-29]。目前LDH没有统一的截断值,范围从200~1 000 IU/L 或1~2.5倍正常值高限。Mezquita等[21]发现接受免疫治疗的NSCLC 患者中LDH≥正常值高限的患者与较差的PFS 和OS 相关 (HR =1.43,95%CI:1.04~4.67,P =0.040;HR =1.36,95%CI:1.02~1.83,P=0.040),这与本研究结果基本一致。
本研究单因素结果显示NLR≥3.4组与较差的PFS和OS相关,但多因素分析结果显示NLR≥3.4组与PFS和OS无明显的相关性。NLR 的预后价值已经在不同类型的癌症中得到验证。在肺癌免疫治 疗 中,Bagley 等[15]和 Soyano 等[16]的研究显示高NLR与NSCLC免疫治疗中较差的OS和PFS相关。这与本研究结果稍有不同,可能由于样本量和截断值的问题。目前NLR 缺乏统一的截断值(2.0~5.0)[30],Jiang等[30]研究发现不同的NLR 截断值与OS获益之间无相关性,而Mei等[31]发现较高的NLR 截断值与更差的PFS相关。因此需要进一步扩大样本或开展前瞻性研究,明确NLR 在接受免疫治疗NSCLC的独立预后价值。

表2 88例免疫治疗非小细胞肺癌患者无进展生存期的单因素和多因素分析
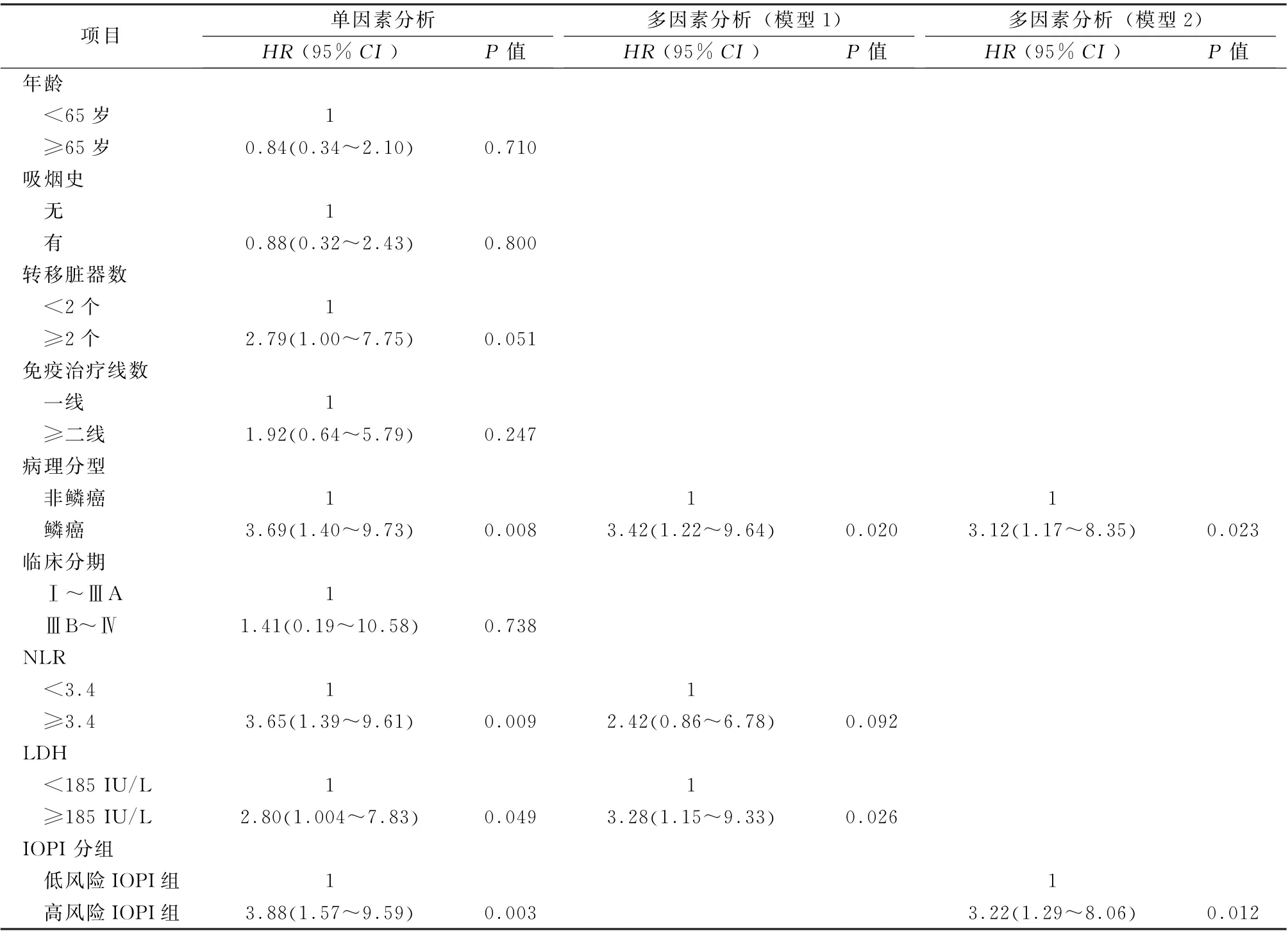
表3 88例免疫治疗非小细胞肺癌患者总生存期的单因素和多因素分析

图4 LDH、IOPI与无进展生存期和总生存期的关系 A:LDH 与无进展生存期的关系;B:LDH 与总生存期的关系;C:IOPI与无进展生存期的关系;D:IOPI与总生存期的关系
由于免疫系统的复杂性及动态变化的特性,完美的免疫治疗预测生物标志物难以确定,可以通过协同不同的生物标志物来进一步提高其预测能力。因此本研究将单因素分析有统计学意义的预后因素LDH≥185 IU/L 及NLR≥3.4合成高风险IOPI组,结果显示高风险IOPI组比低风险IOPI组的疾病进展和死亡风险明显增加 (P 值均<0.05)。既往研究也有很多类似的联合指标,如使用衍生的中性粒细胞与淋巴细胞的比率联合LDH 组成肺癌免疫预后指数[20-21],或使用NLR、LDH 联合C-反应蛋白组成Gustave Roussy 免疫评分[19],均与NSCLC免疫治疗的预后明显相关。
本研究依然存在一定的局限性。首先,本研究属于回顾性研究,因此小部分临床数据存在缺失或不完整的问题。其次,部分患者PD-L1 的表达状态未知,而已知状态的部分患者检测方法也未知。因为很多患者免疫治疗属于二线或后线治疗,PD-L1的检测并不是强制性要求的。而且有研究发现一些患者无论PD-L1表达水平如何甚至是阴性,都表现出临床获益[7]。综上所述,本研究表明高LDH 和高风险IOPI组为NSCLC免疫治疗患者不良预后的独立危险因素。而组合指标IOPI更可能成为NSCLC免疫治疗的预测因子,有助于临床医师筛选出无法从免疫治疗获益的患者,避免不必要的不良反应和花费。
利益冲突所有作者均声明不存在利益冲突
