三峡库区消落带水桦(Betula nigra)周期性水淹后的生理与结构响应
2021-03-19甘丽萍王立春
甘丽萍,任 立,李 豪,王立春
(1. 重庆三峡学院生物与食品工程学院,重庆 万州 404100;2. 重庆任甲生物科技有限公司,重庆 秀山 409999;3. 重庆市林业科学研究院,重庆 400000)
2019 年,三峡水库已连续10 a 完成175 m 蓄水目标。年复一年的季节性水位涨落形成30 m 的消落带区域,是水生生态系统和陆生生态系统交替存在的特殊地带 (图1)[1]。冬季的完全水淹和夏季的伏旱使消落区植被物种多样性呈下降趋势,水土流失较突出[2]。重新造林和植被重建是恢复这些新形成的河岸带的首要任务[3]。因此,筛选出能长期遭受水淹并能正常生长的植物十分重要。目前,与草本植物相比,在长期淹水中能够存活的木本植物相对较少,尤其是完全淹没的品种[4-5]。水桦(Betula nigraL.),属桦木科(Betulaceae)落叶乔木,树高18~25 m,具有抗病虫、抗寒、耐水淹、抗污染等特性[6]。三峡库区良木水桦(良种编号:渝R-ETS-BN-007-013)为重庆市林业科学研究院引自美国的树种[7],研究表明,消落带中高程170 m 处生长的水桦光合作用略强于高程175 m处,说明水桦可通过增强生长期的光合能力一定程度上补偿冬季蓄水对生长的负面影响,是三峡库区消落带植被恢复重建的适生树种[7]。当前,万州区消落带示范区水桦定植后已有5 a,以时间为轴的形态与生理生化指标变化等未见报道。本研究以三峡库区消落带溪口乡栽培的水桦为研究对象,调查水桦在经历周期性水淹后的生理指标的变化及解剖结构的恢复动态,为水桦的扩大栽培与品种选育提供理论依据。

图1 消落带水桦采样时间和地点Fig.1 Sampling time and place of Betula nigra
1 采样地概况
本试验取样点位于重庆市万州区溪口乡玉竹村(30°35′41.7″ N,108°19′39.4″ E)消落带内。万州区属亚热带季风湿润带,该区年平均温度17.7℃,最高温度41℃,最低温度−3.7℃。2014年,确定三峡库区万州溪口乡玉竹村1 社善溪沟长江消落带建立水桦植被恢复示范片,栽植面积13 340 m2,以3 年生种子繁殖苗(株高1.5 m 左右)为定植苗。栽植在高度为170~175 m 的消落带区域,原地块为农田区域。该区域为典型长江三峡库区干流消落区,植被恢复针对性强,立地条件较好,适宜湿地乔木生长,景观及示范性较强[7]。
2 研究方法
2.1 试验材料与试验设计
2014 年5 月至2018 年5 月,由重庆任甲生物科技有限公司牵头,每年在万州溪口乡玉竹村消落带示范基地172 m 高程区栽植株高为1.5 ± 0.2 m 的3 年生种子繁殖的水桦苗150 余株,共计近800 株。本高程万州段每年从10 月15 日左右开始蓄水,次年1 月15 日左右退水,分别经历过1~5 次周期性水淹。本次试验于2019 年4 月15 日取样,即为水淹90 ± 5 d、出水90 ± 5 d 的处理条件,其中,定植后2 a 以内的水桦植株株高没有超过3 m,在175 m 的水位线下,为全淹没。定植后3 a 的水桦植株株高超过了3 m,175 m 的水位线没有完全淹没,为半淹没,即植株高于3 m 的上部枝条一直在水面以上。分别在该高程水桦栽植区隔5 株取1 株,每轮淹水取5 株,共取25 株,测量生长指标,并分别采集最上部枝条顶端第1~3 片叶和当年生须根备用,同时以高程175 m以上没有水淹的露地同龄水桦栽植后1~5 a 的植株的相同部位作为对照。
2.2 测定指标
2.2.1 形态指标 采用直尺和卷尺测定水桦根茎部直径、株高,须根数为人工数第1 层主根上的数目,每个树龄测量5 株,取平均值。
2.2.2 生理指标测定 叶绿素含量参照Grace 等[8]的方法测定;可溶性蛋白含量采用考马斯亮蓝染色法测定;丙二醛(MDA)含量采用硫代巴比妥酸比色法[9]测定;超氧化物歧化酶(SOD)活性使用南京建成生物工程研究中心的黄嘌呤氧化酶法试剂盒测定。
2.3 根系切片
参照李和平[10]的方法,制作水桦叶片横切面石蜡切片。冲洗干净样品后,滤纸吸干表面水分,以福尔马林-乙酸-乙醇固定液固定。采用LERCA(GERMANY)全自动切片机制作高精度切片,番红染色,使用生物光学显微镜观察石蜡切片中根系解剖结构。本部分委托河南风桦教学仪器有限公司完成。后在重庆三峡学院OlympusBX51 光学显微镜上拍照。
2.4 数据处理与分析
用Microsoft Excel2010 及SPSS19.0 软件对实验数据进行分析处理和作图,采用单因素方差分析(one-way ANOVA),并用Tukey 多重比较检验各指标的差异显著性,显著水平为0.05 和0.01。
3 结果与分析
3.1 形态指标
与对照组相比,在消落区栽植并经历水淹,对水桦株高有较大影响,水淹1 次后株高有近70 cm的停滞生长,水淹2 次后株高与对照仍有差异,水淹3 次后,株高与对照没有差异,水淹5 次后,株高比对照增加,并且差异显著。从胸径看,水淹1 次后与对照差异不显著,水淹2 次和3 次后的水桦,胸径与对照均差异显著,水淹4 次以后与对照差异不显著。总体可见,水桦在消落区定植后第1 年株高受抑制,第2 年和第3 年胸径受抑制,经过3 a 的适应后,植株顶端不再被完全淹没,生长基本不再受影响,并且在第5 年开始有了较强的生长补偿效应 (表1、图2)。
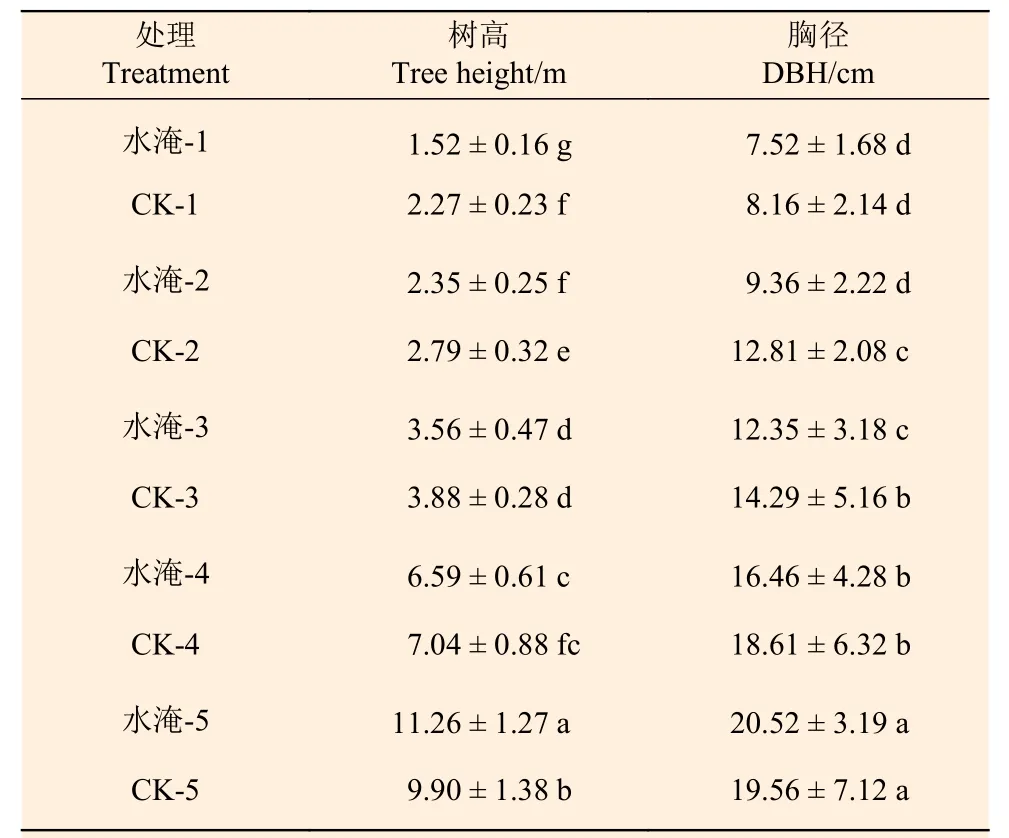
表1 消落带水桦周期性水淹后的形态指标的变化Table 1 Changes of morphological indexes of Betula nigra after periodic flooding in the depression zone
3.2 生理生化指标
3.2.1 含水量及叶绿素 图3A 表明:随树龄增加水桦叶片中的含水量逐步降低,水淹1 次后的植株叶片含水量相比对照有显著升高,水淹2 次后与对照叶片含水量显著不差异。水桦叶片叶绿素含量变化主要在第1 次水淹后,叶绿素a 含量(图3B)、总叶绿素(图3C)和叶绿素a/b(图3D)与对照相比均呈显著下降趋势。水淹2 次后植株的这4 个指标与对照相比再无差异;水淹3 次后,水淹和对照植株叶片的叶绿素a 含量、总叶绿素含量和叶绿素a/b 均显著高于1~2 次水淹。说明随着水淹次数的增加,水桦的适应性逐步建立,退水后刺激植物加速生长,叶绿素含量相应的增多,进而增加了水桦叶片的光合强度,生长能力也逐步恢复。
3.2.2 生理生化指标 图4A 表明:水桦叶片中可溶性蛋白含量比根中高,水淹1 次和2 次后的水桦叶片中可溶性蛋白含量都比对照高,水淹3 次后与对照组不再有差异;根系中的可溶性蛋白质含量前3 次水淹后均高于对照,水淹4 次后,与对照差异不显著。图4B 表明:与对照组相比,水淹1 次和2 次后叶片和根系中的丙二醛含量显著增加,水淹3 次后差异不显著。图4C 表明:第1 次水淹后叶片中的SOD 活性显著高于对照,2 次水淹后与对照差异不显著;根系中的SOD 活性在2 次水淹后显著高于对照,水淹3 次后,与对照差异不显著。水桦在水分胁迫时积累较多的渗透调节物质和抗氧化酶等来积极应对水分逆境,经过周期性水淹后的积累量和代谢速度都有差异,经历1~2 次水淹后,在恢复过程中这类物质消除比较慢,在出水后的叶片和根系中都能检测到,相对来说,根系的胁迫敏感和持久性比叶片更明显,3 次水淹后水桦的几项生理指标基本上与对照没有显著差异,说明耐水淹的适应机制基本建立,这估计与第3 次以后的水淹只是半淹的条件有关。
3.3 叶片结构变化
水桦为典型的两面叶植物,叶片有明显的上表面和下表面之分,有表皮细胞,栅栏组织2 层,海绵组织多层,其中,分布有维管束(图5)。周期性水淹次数对水桦叶形态和组织结构均有显著的影响,水分胁迫改变了水桦叶片的组织结构及比例,水淹1~2 次后,叶片上表皮(EP)均比未水淹厚,栅栏组织(PT)发达,排列紧密;3 次水淹后的植株叶片与对照没有明显的结构差异,特别是经历4 次水淹后,植物叶片气孔窝密度增加,叶片海绵细胞间隙增大,与对照没有差异。

图2 消落带水桦周期性水淹后的生长形态Fig.2 Growth state of B.nigra after periodic flooding in the fallow zone

图3 消落带水桦周期性水淹后的含水量和叶绿素含量变化Fig.3 Changes of water content and chlorophyll content of Betula nigra after periodic flooding in the ebb zone

图4 消落带水桦周期性水淹后的生理指标的变化Fig.4 Changes of physiological index of Betula nigra after periodic flooding in the ebb zone
图6 表明:水淹2 次后,维管束中间导管(CA)细胞变大,细胞松散,水淹4 次后,木质部与韧皮部之间出现了一些较大空隙的溶生型组织,能够更好的适应呼吸和代谢。
4 讨论
4.1 水桦应对周期性水淹的生长响应
3 年生水桦苗在消落区栽植后,逐步对水淹环境产生了适应性,并且由于退水后土壤和树体还保存有大量水分,进入伏旱能极快速地加快生长,产生了较明显的补偿效应。同样的补偿效应在长期淹水的河竹中也报道过,通过鞭根系统的生物量合理分配和异速生长调节河竹能逐步适应淹水环境[11]。周期性淹水对植物是一种生物钟的节律调节生长,Burkett 等[12]研究表明,密西西比州亚祖河消落带间歇性水淹地段的纳栎幼苗存活率明显高于长期性水淹地段。

图5 消落带水桦周期性水淹后的叶片横切面结构变化Fig.5 Changes of cross section structure of Betula nigra leaves in the ebb zone after periodic flooding

图6 消落带水桦周期性水淹后的叶片横切面维管束的结构Fig.6 The structure of vascular bundle in the cross section of Betula nigra leaves after periodic flooding
4.2 水桦应对周期性水淹的生理响应
阴生植物叶绿素a/b 值普遍较小[13]。第1 次水淹后水桦叶片的总叶绿素含量和叶绿素a/b 显著下降,说明水淹环境形成了类似一种阴生植物生存的条件,在退水后新发叶片色素代谢的影响还没消退;水淹3 次后叶绿素合成已经不再受之前水淹胁迫的影响,与第3 次水淹为半淹状态和植物的适应性形成有关系。植物在逆境中通过改变光合产物的分配比例等方式来维持糖分供应和调节碳代谢,从而避免有毒物质的形成,还可通过改变体内SOD、CAT、POD 水平等以保持尽量低的能量储备,降低代谢速率[14]。通过水桦水淹胁迫后几项生理指标调查发现,叶片中可溶性蛋白含量、SOD 在水淹2 次后就与对照没有差别,而同期的根系是在水淹3 次后与对照没有差别。这亦佐证了根系是水淹胁迫下植株受伤最早、最敏感、持续最久的部位[15]。
4.3 水桦应对周期性水淹的叶片结构响应
叶表皮角质膜厚度、气孔导度调节能力等是影响水分蒸腾和输导、气体交换的主要结构指标,能够反映植物对环境水分和湿度条件的适应状况[16]。水分胁迫改变了水桦叶片的组织结构及比例,水淹前2 次后,植株叶片上表皮部分增厚,栅栏组织发达,排列紧密。经历4 次水淹后,叶片海绵细胞间隙增大,形成较大的气孔窝。气孔下陷形成气孔窝或其上有突出的角质膜可能是由于水分胁迫对叶面积扩展的限制而形成[17]。水淹4 次后水桦叶片的木质部与韧皮部之间出现了一些较大空隙的溶生型组织是水桦适应水淹环境而增加的通气途径。通气组织的形成是植物耐涝的重要机制[18],肥大皮孔和溶生性通气组织形成的主要原因是渍水植物茎中乙烯的增加引起的纤维素酶活力增加[19]。植物应答涝渍胁迫依次通过信号传导物质诱导合成、代谢适应和形态适应(比如形成通气组织、不定根等)等过程来完成[20]。叶片和根系中稳定的细胞间和细胞内结构,有助于抗洪,在低氧胁迫下,根系比叶片遭受更严重的解剖和超微结构损伤,下一步将深入研究根系解剖结构。
5 结论
万州区消落带172 m 高程栽植的水桦在间歇性半水淹的条件下产生了较明显的补偿效应,说明水淹植物出水后产生了较高的激发能力,植物在“逃离”水环境后试图加速生长来弥补之前的损失。在水分胁迫下,水桦通过生理和结构上的调整来适应逆境,在万州消落带172 m 及以上高程栽培的水桦已经具备了较好的适应能力,这些基础数据为水桦在消落区更低高程、淹水期更长的环境下生存的可能性提供基础数据。近两年,项目组已经在160 m高程栽植水桦并且成活率达到了60%,2020 年在高程152 m 又定植3 年生水桦苗200 多株继续接受水淹,后期将继续报道新高程下的水桦水淹耐受特征。
