珍稀濒危植物金丝李种子休眠解除的转录组分析
2021-03-19张俊杰张灵艺
张俊杰,张灵艺,夏 科,蒋 冕,韦 霄*
(1.重庆交通大学建筑与城市规划学院,重庆 400074;2.广西壮族自治区中国科学院广西植物研究所,广西 桂林 541006;3.湖南农业大学植物保护学院,湖南 长沙 410128)
种子由休眠阶段转换到萌发阶段,涉及非常复杂的生物学过程[1]。两阶段相比对,常存在较多的差异表达基因(DEGs)[2]。与种子休眠相关的基因功能研究主要集中在拟南芥(Arabidopsis thaliana(L.) Heynh)[3]、烟草(Nicotiana tabacumL.)[4]及水稻(Oryza sativaL.)[5]等模式植物中。近年来,有关重楼(Paris polyphyllaSmith)等中草药[6-7]、杉木(Cunninghamia lanceolata(Lamb.) Hook.)和湖北梣(Fraxinus hupehensisChu)等林木[8-9]以及桃(Amygdalus persicaL.Spp.)[10-11]和芍药(Paeonia lactifloraPall.)[12]等观赏植物的种子休眠相关的基因功能研究也陆续被报道。
种子休眠解除涉及复杂的调控网络。华重楼(P.polyphyllaSm.var chinensis (Franch.) Hara)种子在发育与休眠解除过程中,差异表达基因主要富集在次生代谢产物合成、碳代谢、磷酸戊糖途径、多糖分解、蛋白质合成以及激素信号转导等通路[7]。人参(Panax ginsengC.A.Mey.)后熟发育时期的DEGs 主要富集到代谢过程、次生代谢合成和植物激素信号转导等通路[13]。具有形态生理休眠的辽东楤木(Aralia elataL.)种子在破眠起始阶段的呼吸代谢途径主要以糖酵解和三羧酸循环为主[14];而油菜(Brassica napusL.)种子休眠性则与脂肪酸代谢密切相关[15]。
内源激素在调控植物种子休眠与萌发过程中有十分重要的作用。近年来,在种子休眠与萌发过程中有关激素的合成与分解、信号转导等基因的表达调控机制研究取得了较大进展,其中,脱落酸(ABA)、赤霉素(GA)、生长素(auxin)和乙烯(ETH)等是研究最多的内源激素。三七(Panax notoginsengWall.)种子中共筛选出78 个与其休眠释放有关的DEGs,其中,15 个与ABA和GA 相关(如ABI5、GAI、KS、GA2ox等)[16]。拟南芥种子中的AtCYP707A2基因参与ABA 水平的调节,其休眠释放也与该基因的表达有关[17]。催化GA 生物合成的基因GA20ox1、GA 活性转化的关键酶基因GA3ox2与GA 分解代谢的关键基因GA2ox1[18]在西洋参(Panax quinquefoliusL.)种子休眠解除过程中表达量显著变化[19]。拟南芥的GA 受体GID1基因突变后,突变体种子中α-淀粉酶的活性被抑制,从而导致种子不能萌发[20]。花生(Arachis hypogaeaL.)种子休眠解除过程中除了与GA 和ABA 相关的unigenes 显著差异表达以外,与auxin 和ETH相关的DEGs 也较多[21]。ACO1基因转录调控乙烯生成,在打破山毛榉属(FagusL.)植物种子休眠过程中起主要作用[22]。
金丝李(Garcinia paucinervisChun et How)为藤黄科(Clusiaceae)藤黄属(GarciniaL.)乔木,主要分布于广西西部和云南东南部喀斯特山地,集经济、生态、观赏和药用价值于一身。因其木材名贵,金丝李曾遭受过度采伐,成为了珍稀濒危树种。前期研究表明,金丝李种子萌发缓慢且不整齐,被归为具有生理休眠的低度顽拗性种子[23-24],其休眠主要是由于胚和胚乳中存在内源抑制物的同时缺乏萌发促进物质。以外源6-BA 或GA3处理,亦或32℃条件下均可加快金丝李种子萌发的进程,在一定程度上可打破种子休眠。但处理后的种子平均萌发时间均大于100 d,萌发仍较为缓慢[25-26],这并不利于金丝李的育苗栽培和资源的保护利用。目前,有关金丝李的分子生物学研究有限,仅有关于其不同种群遗传多样性的报道[27],而藤黄属植物种子休眠机理的分子方面研究几乎空白。为了获得更有效地打破金丝李种子休眠的方法,需探索其休眠的分子机理,分析其休眠解除与种子萌发过程中参与调控的基因及其调控方式。
转录组学(transcriptomics)属于功能基因组学的研究范畴,可从整体水平上研究基因功能和基因结构,揭示不同转录组样本中基因表达水平的变化,挖掘特定生物学过程中的分子机理[28]。种子能否解除休眠取决于种子休眠程度与胚胎克服休眠能力之间的相互博弈。然而,科学界对种子休眠解除和萌发启始阶段的界定十分困难[29]。金丝李种子萌发缓慢且不规律,很难把握其从休眠状态转为休眠解除状态的关键时间,故本研究预设以种子萌发为其休眠解除的判断标准。通过将新鲜成熟的金丝李种子、播种后同一时间未萌发和已萌发种子的种胚和胚乳进行无参考基因组转录组测序,找出种子从休眠向萌发转化过程中的差异表达基因,挖掘调控其休眠解除的候选基因,以期为后续开展金丝李种子的休眠功能基因研究及分子育种实践提供有益参考,为藤黄属植物种子,甚至具有休眠属性的顽拗性种子的基因组学研究奠定基础,也为探讨其分子调控网络提供有价值的信息。
1 材料与方法
1.1 试验材料
成熟金丝李种子于2017 年7 月采集自广西龙州县弄岗国家级自然保护区,经0.1%的K2MnO4溶液消毒并洗净后,选取饱满且无病虫害的种子(经TTC 法测试其生活力达98.00%),一部分种子去除种皮后用灭菌刀片切取中部(包含胚和胚乳)约3 mm 部分,迅速用锡箔纸包裹放入液氮速冻,存于−80℃冰箱作为原种子,记为OS(original seeds);另一部分种子参照张俊杰等[25]的播种条件,以河沙为基质播种于25℃的培养箱中,经过60 d 取出种子(萌发率为(28.33 ± 2.36)%),未萌发的种子记为UG(ungerminated seeds);已萌发的种子记为GS(germinated seeds),去除种皮后取种子中部(包含胚和胚乳)约3 mm 部分(图1),迅速用锡箔纸包裹放入液氮速冻,于−80℃冰箱保存(种皮不是其休眠的主要原因[23],故本研究采用了去种皮操作)。
1.2 金丝李种胚和胚乳的RNA 提取
使用广州艾基生物技术有限公司的IPure TRizol植物RNA 提取试剂盒(K417-S)分别对OS、UG和GS 3 组材料进行种胚和胚乳(混合)的RNA提取。经超微量核酸蛋白测定仪(ScanDrop 100)测定提取的RNA 纯度及浓度(选择A260/280≈ 1.8~2.1,A260/230>1.8),再经过1.2%琼脂糖凝胶电泳检测所提取的RNA 完整性,合格后存于−80℃冰箱以备下一步试验。

图1 试验材料与取样部分Fig.1 Experimental materials and the extraction parts
1.3 cDNA 文库的构建与转录组测序
将OS、UG 和GS 3 组材料各5 粒种子作为1组混池处理,3 个生物学重复。在上机前分别对总RNA 的纯度、浓度及完整度用Nanodrop、Qubit及Agilent 2100 进行检测,选用评定等级为A 的样品。样品RNA 经DNase I 处理后,用带有Oligo(dT)的磁珠富集真核生物mRNA,加入打断试剂将mRNA 打断成短片段,并以打断后的mRNA为模板用六碱基随机引物(random hexamers)合成一链cDNA,然后加入缓冲液、dNTPs 和DNA polymerase I 合成cDNA 第二链,经QiaQuick PCR试剂盒纯化回收、粘性末端修复、3′末端加上碱基“A”和连接测序接头,得到的片段进行大小选择后,PCR 扩增富集。构建好的文库经Agilent 2100 Bioanalyzer 和ABI StepOnePlus Real-Time PCR System质检合格后使用Illumina HiSeqTM2500 测序平台进行测序。
1.4 转录组数据处理与分析
1.4.1 数据过滤和de novo 拼接 为减少测序错误对后续分析的影响,用FastaQC 软件进行质量评估。测序得到的原始raw reads 中,将含有低质量的和带接头的reads 进行过滤(去掉包含adapter,不确定碱基N 比例超过5%及低质量碱基(Q ≤10),含量大于50%的reads)后得到clean reads。之后使用组装软件Trinity(version:trinityrnaseq_r20140717)对去重复的clean reads 进行组装。然后使用Tgicl v2.1 去其冗余并进一步拼接,再对这些序列进行同源转录本聚类,获得最终的unigenes。
1.4.2 unigene 功能注释及差异表达基因的筛选
通过Blast 比对数据库获得功能注释,使用Blast2GO 对unigenes 集进行GO 注释。采用FPKM法来衡量基因的表达量。采用DESeq2 R package进行unigenes 的差异表达分析,对金丝李3 个比较组合的DEGs 进行筛选,条件为:|Log2Ratio| ≥1且错误发生率(FDR)≤0.01。在KOBAS2.0 网站上进行DEGs 的KEGG 的pathway富集分析。对于激素合成与降解及信号转导的相关DEGs,在转录组测序数据中找到对应注释,将其对应的CDS 序列分别在NCBI 上进行Blast 比对分析以确认。
1.5 qRT-PCR 分析验证
采用qRT-PCR 技术验证此次转录组测序数据的可靠性,测试3 个比较组合中12 个DEGs 的表达量变化。以Actin3做为参照基因,采用Primer Premier v5.0 设计引物,由生工生物工程(上海)有限公司合成(表1)。采用Aidlab 公司反转录试剂盒(TUREscript 1st Strand cDNA SYNTHESIS Kit)进行反转录操作。反应程序:95℃,3 min;95℃,10 s;58℃,30 s;72℃,20 s;39 个循环。以2−△△CT方法计算基因相对表达水平[30]。每个样品进行3 次生物学重复与3 次技术重复,统计值以平均值 ± 标准误(Mean ± SE)表示。使用Graphpad Prism 6 与SigmaPlot 11.0 软件绘图。
2 结果与分析
2.1 转录组测序结果的产量与质量统计
通过对金丝李种胚和胚乳的转录组测序,获得了OS、UG 和GS 3 组样品共9 个样本转录本信息,共超过120 G 的数据量;9 个样本的GC 含量均在45.70%~47.49%间,Q20、Q30 的范围分别为96.08%~96.56%、90.81%~92.38%(表2)。表明构建的3 个转录组文库测序质量较好,可以满足后续分析要求。
组装结果显示:9 个样本共获得了120 040 个unigenes,平均长度为1 104.92 nt,N50 为1 874。所有样品转录组的Unigenes 的长度有26.68%都在200~300 bp 的范围内,3 000 bp 以上的Unigenes占5.95%。
2.2 荧光定量PCR 验证
荧光定量PCR 验证过程中发现,除CL7766.Contig1 与CL6835.Contig2 外,随机挑选DEGs 的qRT-PCR 的相对表达量与转录组测序(RNASeq)的数据基本呈相似的变化趋势(图2),说明RNA-Seq 分析的基因表达谱数据结果在qRTPCR 分析中有较高的再现性,从而解释RNA-Seq分析具有较高的可信度。

表1 荧光定量引物列表Table 1 List of primers sequence of selected genes
2.3 金丝李种胚和胚乳的差异表达基因
对金丝李种胚和胚乳的OS、UG 和GS 3 组样本进行两两比较,筛选出一些DEGs,其中,GS相对OS 有1 174 个unigenes 上调表达,2 232 个下调表达;UG 相对OS 有849 个unigenes 上调表达,1 926 个下调表达;GS 相对UG 有814 个unigenes上调表达,670 个下调表达(图3A),表明金丝李种胚和胚乳在播种后涉及复杂的生物过程。OS_VS_GS、OS_VS_UG 和UG_VS_GS 3 个比较组合的共同与特有的DEGs 分布图见图3B。
2.4 unigene 的KEGG 功能注释
依据KEGG 数据库注释信息可以进一步获得unigenes 的pathway 注释,共56 224 个注释到该基因库。≥3%的pathway 名称及其包含的基因数量见表3,其中,13 020 个代谢途径(Metabolic pathways)的相关基因数量第一,占比23.16%,其次为6 727 个占比11.96%的次生代谢产物的生物合成(Biosynthesis of secondary metabolites)的相关基因。
2.5 差异表达基因的pathway 富集分析
利用KEGG 数据库将3 个比较组合文库筛选得到的DEGs 进行pathway 富集分析,以Qvalue ≤0.05 为标准。在3 个比较组合中注释到的前4 条途径一致,以代谢通路(Metabolic pathway)中的DEGs 最多,分别达709、533、256 个;其次是次生代谢产物的生物合成(Biosynthesis of secondary metabolites)途径,分别有480、359、160 个DEGs被分别注释到该途径。说明金丝李种子从休眠到萌发过程中,其基因表达差异多集中在这些途径中。

表2 转录组测序的组装质量统计表Table 2 Summary of the sequence assembly after Illumina sequencing
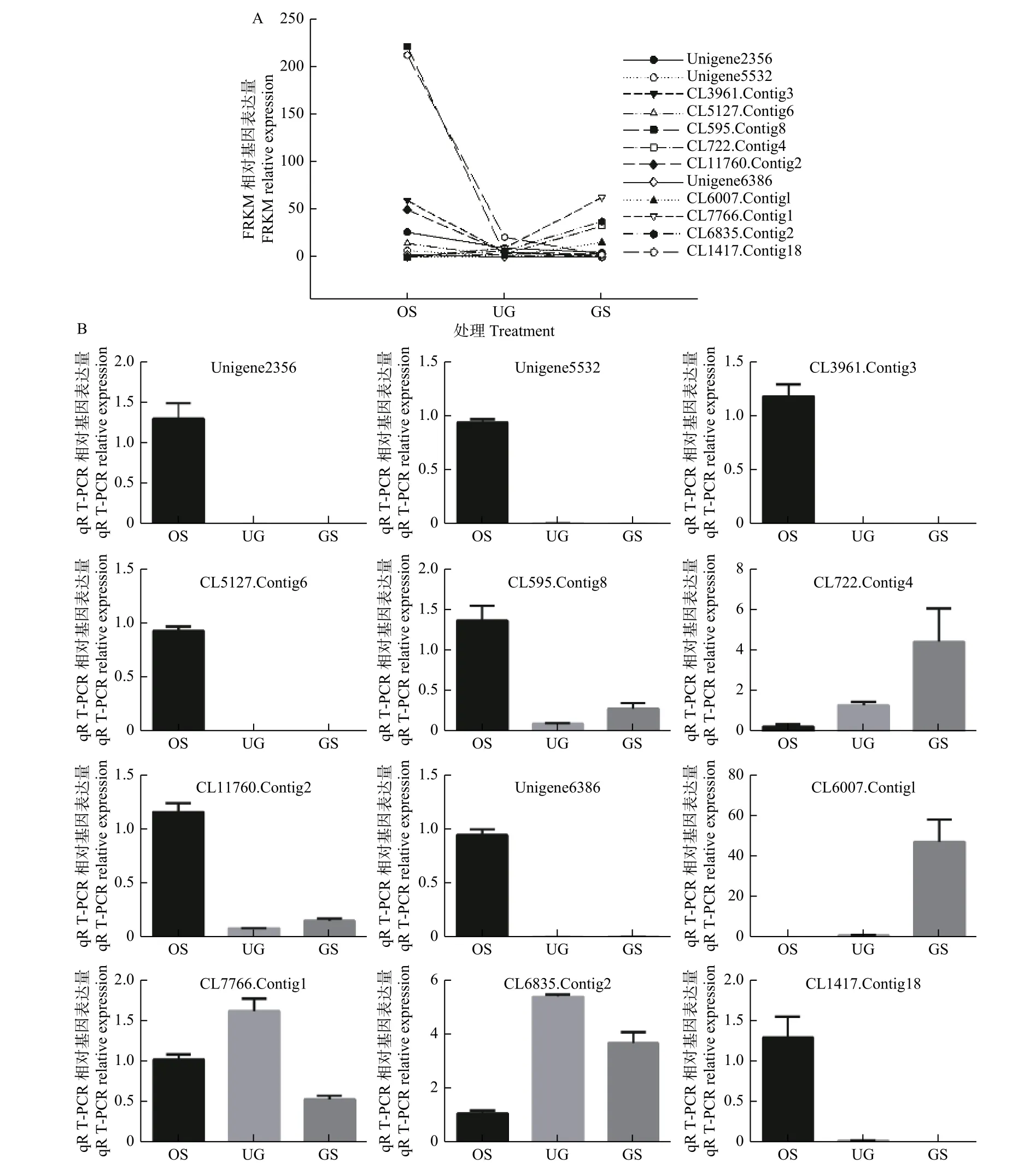
图2 12 个差异表达基因qRT-PCR 的验证分析Fig.2 qRT-PCR validation and analysis of 12 selected DEGs
2.6 休眠解除过程中的相关基因
2.6.1 与休眠解除相关基因的pathway 富集与表达OS_VS_GS 和UG_VS_GS 2 个比较组合牵涉到金丝李种子休眠的解除和萌发,笔者从中挑选出差异量较大的122 个基因(阈值log2|Fold Change| >2,且FDR <0.01)做热图,其富集到的pathway及其表达情况见图4。从播种到萌发阶段,富集到钙信号通路(Calcium signaling pathway)、次生代谢产物合成(Biosynthesis of secondary metabolites)(包括萜类化合物、黄酮类化合物等)、核糖体(Ribosome)、植物激素信号转导(Plant hormone signal transduction)等相关基因的表达量显著升高;而富集到糖酵解/糖异生(Glycolysis/Gluconeogenesis)、脂肪酸合成与降解(Fatty acid biosynthesis and degradation)、内质网中的蛋白质加工(Protein processing in endoplasmic reticulum)、氨基酸合成(Biosynthesis of amino acids)等相关基因的表达量则显著降低。

图3 3 个比较组合间的差异表达基因数目统计(A)和共同与特有差异表达基因分布图(B)Fig.3 Statistics of differentially expressed genes among three comparison groups of samples (A) and distribution of the genes commonly and specifically DEGs among three comparison groups of samples (B)

表3 金丝李种子的转录组unigene 的KEGG 代谢途径注释(≥ 3%)Table 3 KEEG pathway annotation of unigenes of transcriptome for G.paucinervis seeds (≥ 3%)
分析可知:在种子休眠解除的过程中,信号传导、激素作用、蛋白质合成、细胞分裂与代谢、次生代谢产物合成等比较活跃,且从原种子到种子吸胀过程中糖、脂肪和蛋白质分解代谢也较旺盛,当种子开始萌发后,这些代谢相关基因逐渐关闭。
2.6.2 植物激素相关基因的筛选 在3 个比较的组合中筛选出40 个在种子休眠至萌发过程中与激素相关的基因,根据功能注释可知,涉及到ABA、GA、auxin 和ETH 等相关的基因,其中,与激素合成、分解或衍生相关的基因有7 个,涉及ABA、GA 及ETH 共3 种植物激素;受体3 个,仅涉及GA 1 种植物激素;与信号转导相关的基因有17 个,涉及到ABA、GA、auxin 和ETH 4 种激素;转录因子12 个,涉及ABA 和ETH 2 种激素,以ERF 家族成员最多;其他基因1 个。
与植物激素相关的DEGs 的表达情况见图5,其中ZEP、GA2ox1、GA2ox3、GAI、GID1、SnRK2.2和ACO1在种子休眠解除时显著下调表达,以ACO1下调最显著,而CYP707A2、GA20ox1和GA3ox2在此过程中显著上调表达。这些调控ABA、GA、auxin 和ETH 等相关基因的表达量发生显著的变化,很可能导致对应激素的含量发生变化,促进种子休眠的解除。
2.7 差异表达的转录因子分析

图4 OS_VS_GS 与UG_VS_GS 比较组合中共有的部分差异表达显著的基因的表达情况Fig.4 Expression profile analysis of common DEGs in OS_VS_GS and UG_VS_GS comparison groups of samples
转录因子(transcription factor,TF)在种子发育、休眠与萌发等植物生命周期中起着非常重要的作用。从3 个比较组合中共发现375 个差异表达的TFs,分属于57 个转录因子家族。OS_VS_GS样本间有170 个差异表达的TFs,其中,ERF 和WRKY 家族各有20 个差异表达的TFs,MYB 和NAC 家族也均含14 个;OS_VS_UG 样本间有147 个差异表达的TFs,其中,ERF 和NAC 家族各有20 个差异表达的TFs,MYB 和WRKY 家族也均含16 个;UG_VS_GS 样本关系到种子从吸胀阶段到萌发阶段,它们间有75 个差异表达的TFs,其中,ERF 家族有14 个,HD-ZIP 和C3H 家族也均含6 个。
通过注释发现,与结合蛋白、含结构域的家族蛋白、ABA 和乙烯有关的TFs 表达量变化较大,其中,与乙烯有关的差异表达的TFs 达10 个。说明有较多的转录因子家族和转录因子参与了金丝李种子由休眠到萌发的过程,推测它们在种子破眠的过程中也起着一定作用。

图5 与植物激素相关的差异表达基因的表达情况Fig.5 Expression profile analysis of DEGs related to plant hormone
3 讨论
3.1 休眠解除过程中与物质代谢、钙信号通路相关的差异表达基因
糖酵解途径是三条最基本的呼吸代谢途径之一,为种子萌发提供所需能量[31]。Simmonds 等对野燕麦(Avena fatuaL.)种子休眠过程中糖代谢途径研究证明,由糖酵解途径/三羧酸循环向磷酸戊糖途径转变是解除其休眠的主要原因[32]。萌发前期的天女木兰(Magnolia sieboldiiK.Koch)种子主要通过糖酵解途径为种子萌发提供能量,定位于糖酵解/糖异生通路的5 种差异蛋白质均在种子萌发前期高峰度表达[33]。本研究中发现8 个与糖酵解/糖异生合成或分解相关DEGs 在播种到种子吸胀、萌发过程中逐渐下调表达,说明糖酵解途径为种子萌发提供能量后,这些糖酵解/糖异生代谢相关基因逐渐关闭。
在营养物质合成与代谢相关基因中,脂肪酸是一些植物种子的主要能量来源之一。巫山淫羊藿(Epimedium wushanenseYing)种子休眠解除过程中各脂肪酸含量变化显著[34]。水曲柳(Fraxinus mandshuricaRuprecht)种子在休眠解除过程中,脂肪酶活性和脂肪酸质量分数快速增加,脂肪酸合成或分解的相关基因在休眠解除过程中差异表达,将贮藏物质转化为营养物质,可为细胞分裂及胚根、胚轴和子叶的分化提供能量,为种子的萌发作准备[35]。脂肪酸合成与降解相关的5 个基因CL5358.Contig3、CL6410.Contig10、CL5358.Contig9、CL3542.Contig2 和CL3542.Contig1 在金丝李种子休眠解除时表达量显著变化,表明种子在破眠过程中脂肪酸代谢活跃。
钙离子(Ca2+)作为第二信使参与调节植物的多种生理过程,参与许多胞内信息或胞外刺激的接收和传递[36]。Somyong 等从水稻中鉴定出与钙信号转导有关的候选基因,涉及ABA 信号转导以及对萌发至关重要的功能蛋白关联网络[37]。此外,Ca2+信号参与GA 信号的转导作用[38],Ca2+-CaM(Calmodulin,钙调蛋白)信号系统参与乙烯生成,以间接方式调节乙烯生成中ACC 合酶向乙烯转化[39]。5 个钙信号通路相关基因CL629.Contig5、CL6715.Contig3、CL629.Contig3、CL7156.Contig2和CL629.Contig4 均在种子吸胀且未萌发时(UG)表达量变化不大,但在萌发时均显著上调,说明钙信号通路相关基因在休眠解除过程中可能起到一定的调控作用,可能参与了ABA、GA 和乙烯等激素有关基因的信号转导或合成。
3.2 休眠解除过程中植物激素相关基因的表达
种子休眠解除受多种植物内源激素调控[40]。Qi 等利用高通量胚胎转录组测序技术挖掘出重楼在种子层积过程中的11 个激素相关的DEGs[6]。此外,植物激素与植物的玩拗性密切相关[41],而金丝李种子为较特殊的具有休眠属性的玩拗性种子,故本文重点分析3 个比较组合中激素调控相关基因的差异表达。
GA 和ABA 的相关基因在种子休眠和萌发中的作用是通过合成、分解代谢与信号转导的平衡来实现的[42]。杉木[8]、桃[10,12]等植物种子的休眠解除过程中,调控GA 和ABA 的相关基因表达量差异较大。金丝李种子在休眠解除过程中,ABA 和GA 合成途径上的一些相关基因表达也有显著差异,如ZEP是催化ABA 生物合成的关键酶基因[40],从播种到萌发,ZEP表达显著下调,表明ABA 合成的关键步骤受阻。CYP707A家族编码ABA 8′-羟化酶,其影响种子从休眠到萌发的过程[17],CYP707A2作用于ABA 的分解代谢[43],在金丝李种子播后60 d,无论萌发与否,CYP707A2表达量均显著上升。因此,CYP707A2与ZEP可能共同参与调控ABA 含量的降低。SnRk2.2主要参与ABA 的信号转导,正调控ABA 信号[44]。SnRk2.2在OS_VS_GS比较组合中表达量显著下调。CL3120.Contig6 为一种RNA 结合蛋白,对ABI3、ABI4和ABI5起抑制作用,ABI3隶属于bZIP转录因子家族,正向调控种子休眠,种子播后60 d,CL3120.Contig6 的表达量上调,说明ABI3的表达受到抑制。因此,推断ABA 调控金丝李种子萌发是多基因协同作用的结果,通过控制基因的表达量调控ABA 的合成或者改变ABA 信号转导过程,使得ABA 含量在种子萌发过程中发生变化。
GA20ox1与GA3ox2为GA 合成途径中的关键调控基因,而GA2ox1的高表达能够导致GA 失活,从而调控GA 降解代谢。拟南芥种子在吸胀过程中,GA 合成的相关基因GA20ox1和GA3ox表达量均显著增加[45]。本研究发现,GA20ox1在播后60 d 已萌发种子中表达量显著上调,而GA3ox2在播后60 d 有无萌发的种子中表达量均显著上调,推测GA20ox1与GA3ox2在金丝李种子休眠解除过程中有一定作用;而GA2ox1则在3 个比较组合中均下调表达。类似的,西洋参种子在经过层积处理的休眠解除过程中,其GA20ox3逐渐上调表达,不同的是,西洋参种子GA2ox3和ZEP的表达量变化不显著[46]。GAI属于DELLA 家族的基因,负调控GA 信号转导途径[47]。本研究发现,播后60 dGAI的表达量均下调,说明对GA 信号的抑制作用减弱。GID1 通过蛋白质间的相互作用,增强DELLA 对GA 的阻遏反应[48]。GID1在播后60 d均下调表达,使得GA 的阻遏反应减弱。因此,GA 控制金丝李种子休眠解除也是一个多基因协同的复杂过程,通过控制基因的表达量使得GA 含量在种子休眠解除时发生变化。结合张俊杰等所测量的金丝李种子从休眠到萌发进程中内源激素的变化情况分析[23],其种子可能通过抑制ABA 的合成或促进其分解,加强GA 的合成同时减弱其降解,与激素信号转导有关基因和有关转录因子相配合,使萌发促进物与抑制物的比例趋于促进以打破休眠。
ACO 控制种子萌发过程中乙烯的演化,是乙烯合成途径中的关键酶。本研究播种后60 d 的种子中,ACO1的表达量均下调,且乙烯信号转导相关基因和大部分乙烯应答转录因子均下调表达,很可能导致乙烯的合成降低。推测乙烯很可能参与调控了金丝李种子的休眠与萌发。一些研究表明,乙烯作用于ABA 代谢降低ABA 含量,负调控ABA信号途径[49],在休眠解除过程中含量逐渐升高[21,50]。但在本研究中,乙烯含量变化趋势与之相反,具体原因有待进一步研究。
转录因子是调控靶基因在特定的时间、空间和适当的强度进行表达的一类蛋白质分子。本研究发现,bZIP 转录因子家族的CL9649.Contig2 和CL9649.Contig4 涉及到ABI5,而ABI5 通过与ABA 应答元件(ABA-responsive-element,ABRE)结合来激活种子中ABA 介导的基因转录,在种子萌发阶段加强种子对外源ABA 的应答[51]。在金丝李种子休眠解除时,与ABA 和乙烯有关的TFs 表达量变化较大,其中,与乙烯有关的差异表达的TFs 达10 个。无休眠的同属植物山竹(G.mangostanaL.)种子在萌发过程中乙烯应答转录因子的表达量变化也较大[52],推测乙烯在藤黄属植物种子中的作用具有更深入的研究意义。而金丝李种子休眠解除过程中各激素之间的互作机制,及其在种子休眠和萌发中的信号网络、蛋白互作的体内证据及更多调控基因位点的发现都值得深入研究。
4 结论
本研究推测,金丝李种子休眠解除过程是通过上调钙信号、次生代谢产物合成、核糖体和植物激素信号转导等基因相关的通路,下调糖酵解/糖异生、脂肪酸合成与降解、内质网中的蛋白质加工和氨基酸合成等基因相关的通路,同时伴随着上调GA 合成或ABA 分解的相关基因,下调ABA 的合成或GA 分解的相关基因,与有关转录因子等调控网络相配合以打破休眠。乙烯很可能也参与调控其种子的休眠与萌发。
