楸树种子发育过程中内源激素含量的动态变化
2021-03-19韩东花杨桂娟麻文俊王军辉
韩东花,杨桂娟,肖 遥,麻文俊,赵 鲲,王军辉,易 飞,3*
(1. 林木遗传育种国家重点实验室,国家林业和草原局林木培育重点实验室,中国林业科学研究院林业研究所,北京 100091;2. 北京师范大学珠海校区后勤处,广东 珠海 519087;3. 三峡大学生物与制药学院,湖北 宜昌 443002;4. 洛阳农林科学院,河南 洛阳 471023)
楸树(Catalpa bungei)为紫葳科(Bignoniaceae)梓属(Catalpa)的落叶乔木[1],是我国特有的珍贵优质用材树种和园林观赏树种,其材性优良,干形端直,树姿优美,用途十分广泛。楸树根系发达,耐旱耐寒,具有防风固沙的良好生态价值[2],其体内的活性成分具有多种药理作用[3-4]。自然状态下,楸树自花授粉不育,仅能通过昆虫的活动进行少量授粉,结实量很低,出种率仅10%左右[2];生产上,目前主要通过嫁接、组织培养等方法进行繁殖。近年来,对楸树的种质资源调查、良种选育、繁殖和栽培技术、抗性机理等方面开展了较多工作[2,4],而对楸树生殖生物学的研究,特别是对种子和胚胎发育过程中生理特性和规律的研究少有报道[5]。
植物激素在植物胚胎发育、种子萌发、果实成熟、营养生长等生长发育的各阶段均发挥重要作用,尤其是胚胎的正常发育需要多种激素的动态平衡及某一时期某一激素的主导作用[6-8]。楸树的自花授粉不育可能与传粉受精和胚胎发育有关[5],因此,开展楸树胚胎发育过程及内源激素的研究可为探明自花授粉不育的机理奠定基础。植物体细胞胚胎发生技术是植物快速繁殖的重要手段和遗传转化的有效体系,体胚发生与合子胚发育过程具有类似的机制[9],研究合子胚发育过程中的内源激素含量变化可为体胚诱导提供参考。本研究通过对楸树胚胎发育过程中生长素、细胞分裂素、赤霉素和脱落酸等激素含量变化的分析,揭示内源激素在楸树合子胚发育过程的调控作用,可作为楸树体胚诱导中外源激素添加的依据,为解决楸树体胚诱导率低这一技术瓶颈提供理论支撑。
1 材料与方法
1.1 试验材料
楸树蒴果采自河南省洛阳市白马寺镇试验地(34°42′55″ N, 112°32′36″ E)内的2 个无性系良种洛楸1 号(LQ1)和洛楸3 号(LQ3)。2018 年4 月楸树盛花期授粉后,分别于授粉后45 d(6 月1 日)、授粉后70 d(6 月26 日)、授粉后90 d(7 月16 日)采集样品。2 个无性系各选取9 个固定单株,每次采集时选取树冠中部南向的果实,每株采集10 个蒴果,即2 个无性系各采集90 个蒴果。从采自各单株的蒴果中各随机选取1 个,去除果皮,选择中间部位健康发育的种子,混合后分成3 份,用锡纸包裹置于液氮中,其余蒴果混合后用保鲜膜包裹置于冰盒中,样品在24 h 内带回实验室。液氮中的种子保存在−80℃的超低温冰箱中用于内源激素含量检测。将冰盒中的蒴果剥取种子,用于种子形态和胚胎发育时期鉴定。
1.2 激素检测方法
取超低温保存的种子约0.5 g,用研磨仪(MM400,Retsch)研磨(30 Hz,1 min)至粉末状,称取120 mg 粉末溶解于1.2 mL 80%甲醇-水提取液中,每30 min 涡旋1 次,共涡旋6 次,4℃冰箱中保存过夜。提取液于4℃,12000 g 离心15 min,吸取上清,35℃加热模式下液氮吹干。100 μL 30%甲醇-水复溶样品,涡旋使目标物质充分溶解,12000 g 离心15 min,吸取上清,并保存于进样瓶中。植物内源激素的检测采用液相色谱串联质谱法(LC-MS/MS),分别检测吲哚乙酸(IAA)、异戊烯腺嘌呤核苷(iPA)、赤霉素(GAs;C19-GAs:GA1、GA3、GA7)及脱落酸(ABA)的含量,激素含量使用鲜质量表示,单位为ng·g−1。每个发育时间的样品各3 个生物学重复,每个样品3 次技术重复。
1.3 胚胎发育时期鉴定、胚胎数量和种子性状的测定
冰盒中对授粉45、70、90 d 的样品分别随机选择3 个蒴果去除果皮,剥取中间部位健康发育的种子,混合后随机选择60 粒种子,去除种皮,采用超景深显微镜(Leica DVM6)进行种子形态和胚胎发育时期鉴定,统计各时期胚胎的数量。并随机选择授粉后70、90 d 种子各50 粒,用超景深显微镜拍照后测量种子的长度和宽度,计算长宽比。
1.4 数据分析
试验数据采用Microsoft Excel 2003、SPSS17.0进行分析处理,使用Duncan 新复极差法检验显著性。使用GraphPad Prism 做图。
2 结果与分析
2.1 楸树胚胎发育过程及其在无性系间的差异
植物胚胎发育始于合子胚分裂,经过原胚发育和胚的分化,最终形成成熟胚胎。合子胚第一次的不对等分裂形成的二细胞原胚直至球形胚期间的胚胎发育状态为原胚时期。双子叶原胚发育历经球形胚、心形胚、鱼雷胚时期,最终发育为子叶胚。
楸树胚胎发育过程的观察结果表明:合子胚首先进入球形胚时期(图1A),胚胎被大量透明状胚乳包裹。由于球形胚两侧的细胞单位时间内较上下的两部分细胞分裂次数多,因而产生2 个子叶原基,胚胎进入心形胚阶段(图1B)。心形胚的2 个侧生突起发育成为2 片侧生的子叶,子叶下方的细胞发育成为胚轴,子叶和胚轴进行伸长生长,形成鱼雷胚(图1C)。从球形胚到鱼雷胚,胚胎呈现乳白色,大小变化不明显,透明状的胚乳一直存在。胚胎体积迅速增大,进入子叶胚时期,此时可见2 片明显的子叶,约呈90°角,胚胎透明度有所下降(图1D)。授粉70 d 后,胚胎体积进一步增加,子叶变得狭长并位于同一直线上,整个胚胎呈现长条状;此时胚乳已经完全消失,胚胎白色不透明,仅在子叶连接处为浅黄色(图1E)。再经过20 d 左右的发育,胚胎成熟,为浅黄色,子叶边缘及连接处颜色较深,呈黄褐色,但胚胎的体积较早期子叶胚时有所下降(图1F)。

图1 不同发育时期的楸树胚胎形态Fig.1 Embryo morphology of C.bungei at different developmental stages
表1 授粉后45、70、90 d 各种胚形态所占比例Table 1 Statistics on the proportion of various embryo forms at 45,70 and 90 DAP
2 个无性系的胚胎发育速度在授粉后45 d 存在较大差异(表1),60 粒洛楸1 号种子中,处于心形胚时期的有43 个,占71.67%,处于鱼雷胚时期的仅有2 个;洛楸3 号的胚胎发育速度更快,60 粒种子中处于子叶胚时期的已有20 个,占33.33%,处于心形胚和鱼雷胚时期的分别占20.00%和31.67%。这种差异表明,洛楸1 号胚胎发育的同步性高,而洛楸3 号胚胎发育不同步,同时存在各时期的胚胎,且各时期的比例差别也不明显。在授粉70 d 后,2 个无性系的胚胎都全部到达子叶胚时期,均无其它发育时间的胚胎。授粉90 d 后,洛楸1 号种子的长度和宽度都比授粉70 d的显著增加,且长宽比下降(图2),表明授粉70 d时胚胎未达到成熟状态,细胞仍在不断分裂。授粉90 d 的洛楸3 号种子与授粉70 d 时相比,长度、宽度略有下降,长宽比则无显著差异(图2),表明洛楸3 号的胚胎在授粉70 d 后,细胞分裂基本完成,进入胚胎的成熟阶段,水分逐渐减少,干物质不断积累,因此体积稍有减小。
2.2 不同发育时间楸树种子内源激素含量的变化
本研究中,检测出IAA、iPA、GA1、GA7、ABA,而没检测出GA3,不同发育时期各类内源激素含量变化情况不同。

图2 授粉后70 d 与授粉后90 d 楸树种子长度、宽度和长宽比的变化Fig.2 Changes in length,width and aspect ratio of C.bungei seeds at 70 and 90 DAP
2.2.1 IAA 含量 2 个无性系的不同发育时间种子内源IAA 含量变化趋势不同(图3)。洛楸1 号IAA 含量呈先下降后上升的变化趋势,在授粉后90 d,含量到达最高,为0.70 ng·g−1。方差分析表明:3 个时期的含量均差异显著。洛楸3 号IAA 含量则在授粉45 d 时最高(1.37 ng·g−1),随后迅速下降,到授粉70 d 时,仅为0.27 ng·g−1,此后变化较小(授粉后90 d 为0.32 ng·g−1)。在种子发育过程中,洛楸3 号IAA 的含量只在授粉90 d 时低于洛楸1 号,而在授粉45、70 d 时,其IAA 的含量分别是洛楸1 号的3.76 倍和2.37 倍。结果表明:洛楸3 号在发育早期高水平的IAA 促进了胚胎细胞迅速伸长,发育速度快,授粉后45 d 即有约1/3 的胚胎进入子叶胚时期。洛楸1 号IAA 的含量在发育过程中维持较低水平,导致其发育速度明显落后于洛楸3 号。但在发育后期洛楸1 号的IAA含量达到峰值,且高于洛楸3 号,说明在此阶段其胚胎细胞仍在继续伸长,种子体积也有明显增大。

图3 不同发育时间楸树种子内源IAA 含量的变化Fig.3 The changes of endogenous IAA content of C.bungei seeds at different developmental periods
2.2.2 iPA 含量 图4 表明:iPA 含量在2 个无性系中均极低。授粉70 d 的洛楸1 号种子iPA 含量达到最大值,为0.023 ng·g−1,授粉45、90 d 的种子iPA 含量分别为0.018 9、0.019 2 ng·g−1;而洛楸3 号种子iPA 含量在3 个发育时期均低于0.02 ng·g−1。方差分析表明:2 个无性系的iPA 含量在3 个发育时期中均差异不显著。
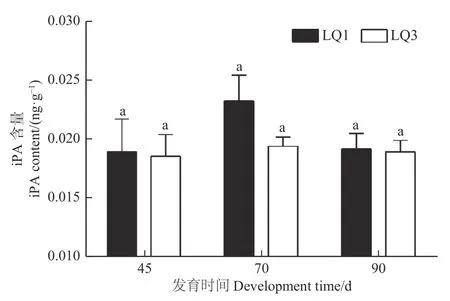
图4 不同发育时间楸树种子内源iPA 含量的变化Fig.4 The changes of endogenous iPA content of C.bungei seeds at different developmental periods
2.2.3 GAs 含量 2 个无性系中的GAs 含量变化趋势一致,均随着发育进程下降(图5)。洛楸1 号种子的GA1 含量在授粉后45 d 最高,为29.81 ng·g−1,此后就迅速下降;授粉后70 d,含量为3.74 ng·g−1;至授粉90 d 时,其含量仅为1.06 ng·g−1。洛楸3 号种子GA1 含量同样在授粉45 d 时达到最大值(9.31 ng·g−1),而授粉后70、90 d 的含量分别为0.76 、0.56 ng·g−1。洛楸1 号GA1 的含量在各个发育时间都明显高于洛楸3 号,分别是洛楸3 号含量的3.20、4.92、1.89倍。2 个无性系中GA7 含量的变化与GA1 相同,都在授粉后45 d 的含量最高,并与后2 个时期的含量差异显著,且同样是洛楸1 号GA7 含量高于洛楸3 号的含量,差异倍数的最大值也出现在授粉70 d 时(差异倍数分别为3.95、4.69、2.67 倍)。GAs 含量(GA1 + GA7)呈现与2 种赤霉素相同的变化趋势,授粉后45 d 的含量显著高于后2 个时期,而授粉70 d与90 d 的含量差异不显著。GA7的含量在整个发育过程中都远低于GA1 的含量,2 个无性系中GA7 含量在3 个发育时间均不超过GAs 的20%。

图5 不同发育时间楸树种子内源GAs 含量的变化Fig.5 The changes of endogenous GAs content of C.bungei seeds at different developmental periods
2.2.4 ABA 含量 2 个无性系种子的内源ABA 含量在发育全程中明显高于IAA、iPA 和GAs(GA1 +GA7)的含量,且在2 个无性系中变化趋势基本一致(图6)。洛楸1 号授粉后45 d,ABA 含量高达349.78 ng·g−1,随后逐渐下降,到授粉后90 d 含量最低,但仍达到96.90 ng·g−1。洛楸3 号的ABA含量同样在授粉后45 d 最高(189.51 ng·g−1),授粉后90 d 最低(43.33 ng·g−1)。方差分析表明:洛楸1 号3 个发育时间的ABA 含量均差异显著;洛楸3 号授粉后45 d 的ABA 含量显著高于授粉后90 d 的含量,但授粉后70 d 的ABA 含量与另2 个时期均差异不显著。与GAs 含量类似,洛楸3 号的ABA 含量在发育全程中均低于洛楸1 号,差异倍数在授粉70 d 时最低(1.76 倍)。
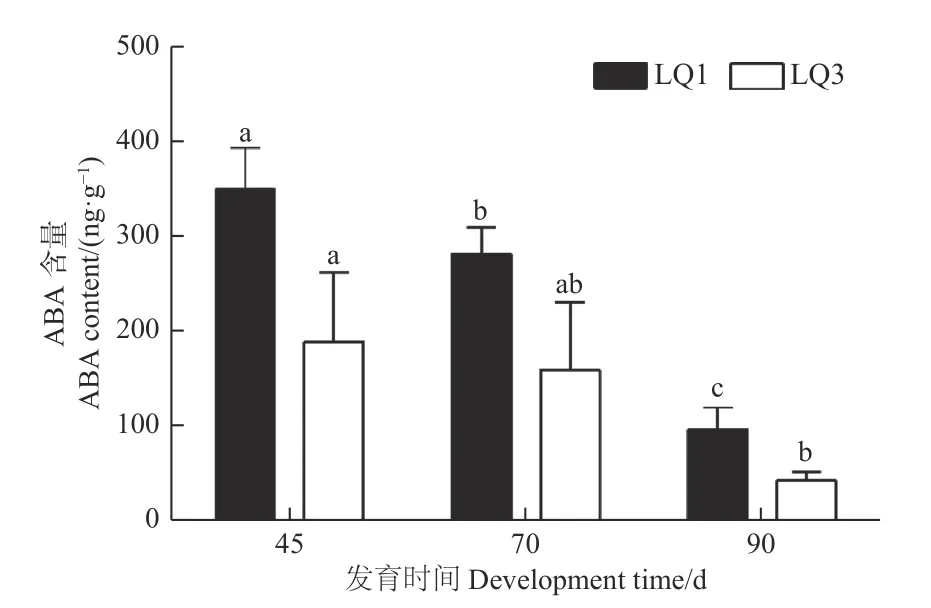
图6 不同发育时间楸树种子内源ABA 含量的变化Fig.6 The changes of endogenous ABA content of C.bungei seeds at different developmental periods

图7 不同发育时间楸树种子内源激素间比例的变化Fig.7 The changes of endogenous hormones ratio of C.bungei seeds at different developmental periods
2.2.5 种子发育过程中内源激素含量比值 种子的发育是多种植物激素共同作用的结果,激素之间既相互制约又相互促进。由图7 可知:洛楸1 号IAA/ABA 和iPA/ABA 的比值呈上升趋势,授粉后90 d 的比值显著高于前2 个时期的比值,但授粉后45 d 和70 d 的比值差异并不显著;GAs/ABA和(IAA + iPA + GAs)/ABA 的比值变化趋势相同,最高值均出现在授粉后45 d,与后2 个时期的比值差异显著,而授粉后70 d 和90 d的比值差异不显著。洛楸3 号IAA/ABA 的比值先下降后上升,授粉后70 d 的比值最小(0.002),显著低于授粉后45 d 的比值(0.007),但该比值在授粉后70 d 与90 d、45 d 与90 d 之间的差异均不显著;洛楸3 号的iPA/ABA、GAs/ABA 和(IAA + iPA +GAs)/ABA 比值变化趋势与洛楸1 号相同。2 个无性系中IAA 和iPA 的含量均明显低于GAs 含量,GAs 占促进生长类激素(生长素、细胞分裂素和赤霉素)的主体,因此,导致(IAA + iPA +GAs)/ABA 的比值由GAs/ABA 的比值决定,并呈现相同的变化趋势。
3 讨论
本研究通过对不同发育时间的楸树种子解剖观察,结果表明,楸树胚胎发育过程遵循双子叶植物的胚胎发育过程,即原胚发育历经球形胚、心形胚、鱼雷胚,最终发育为子叶胚。2 个无性系的胚胎发育速度有差异,洛楸3 号的发育速度明显快于洛楸1 号,但洛楸1 号胚胎发育的同步性更高。
生长素通常在胚胎发育早期作用显著[10],在种子生长发育过程中,IAA 通过促进细胞伸长、加快细胞代谢和缩短细胞分裂周期,实现种子的快速膨大[9,11-12]。在本研究中,2 个楸树无性系授粉后45 d 的种子都具有较高水平的IAA,其中,洛楸3 号IAA 含量达到峰值。由于在发育早期洛楸3 号的IAA 含量明显高于洛楸1 号,导致营养物质转运更快,洛楸3 号胚胎发育速度更快,授粉后45 d 即有33.09%的胚胎进入到子叶胚期,而此时洛楸1 号的胚胎多处于心形胚时期。细胞分裂素主要参与胚胎发育前期的器官形成,并促进细胞分裂和扩大,诱导营养物质运输,增加种子重量[13-14]。根据前人研究,细胞分裂素在胚胎发育前期含量高,在随后的发育过程中持续降低,接近种子脱水干燥期细胞分裂素作用最小[10,15-16]。本试验结果表明,2 个无性系中的iPA 含量在胚胎发育过程中一直维持低水平,且无显著变化。推测可能的原因是,楸树授粉后细胞分裂素迅速合成,含量很快达到顶峰,在此期间细胞快速分裂及伸长,胚胎及贮藏器官迅速分化发育,促进营养物质向种子流动。由于笔者在授粉后45 d 才首次检测内源激素,此时iPA 含量已经很低,在仪器检出限(0.02 ng·g−1)附近或以下,故在不同发育时间及2 个无性系间差异不显著。赤霉素通过增加细胞壁延展性来促进细胞伸长生长,研究表明,在胚胎的细胞极性生长期,尤其是鱼雷胚期以及早期子叶胚期,赤霉素对胚轴细胞的伸长调控作用非常明显[17]。2 个楸树无性系的GAs 含量与IAA 含量呈正相关,在授粉后45 d 达到最大值,此后迅速下降,与红松、玉米等种子内部赤霉素含量变化一致[10,18]。洛楸1 号GAs含量一直高于洛楸3 号,与胚胎发育速度的差异不一致,这是因为赤霉素促进种子发育的作用主要是通过促进生长素的合成而间接实现的[13,19],较高的IAA 含量是导致洛楸3 号胚胎早期发育更快的直接原因。
从授粉45 d 之后,2 个无性系的IAA 含量均开始下降,到子叶胚期含量最低(授粉70 d);胚胎发育后期IAA 含量又有所上升,这与扇脉杓兰(Cypripedium japonicumThunb.)[20]、华中五味子(Schisandra sphenantheraRehder & E. H. Wilson.)[21]、月季(Rosa hybridaE. H. L. Krause.)[22]、结缕草(Zoysia japonicaSteud.)[23]和沙棘(Hippophae rhamnoidesL.)[24]的研究结果一致。发育后期洛楸1 号的IAA 含量显著上升,通过调节核酸和蛋白质的合成促进生长,吸引同化物从叶片向种子运输[25],使得种子的长度、宽度和体积都有显著增加。胚胎发育后期,洛楸1 号和洛楸3 号的GAs含量显著下降,抑制水解酶合成,有利于淀粉等营养物质合成[26]。
植物种子发育分为2 个长度大致相同的阶段,第一阶段是以细胞分裂增殖为特征,第二阶段以储藏物积累为特征,细胞停止分裂,淀粉、脂肪、蛋白质等物质大量积累,种子脱水,此时胚胎的耐干燥性也逐渐增强。ABA 对种子的发育和成熟具有重要的生理作用,可促进耐干燥性的形成、促进休眠、抑制胎萌、控制脂质及蛋白质合成等[9,27-28]。在种子发育过程中,ABA 浓度变化遵循较为一致的变化趋势,即在形成初期ABA 仅以极低含量存在;在种子发育至1/3~1/2 的阶段时含量达到高峰;在成熟的过程中不断下降[11,22,29]。白云杉(Picea glaucaVoss.)种子成熟晚期ABA 含量达到顶峰,而火炬松(Pinus taedaL.)种子成熟晚期ABA 含量下降,说明针叶树中ABA 积累可能依赖于物种[22]。本研究中,从授粉45 d 开始ABA含量逐渐下降,说明楸树胚胎开始进入成熟期;授粉后70~90 d,ABA 含量虽下降,但水平仍然维持在一个较高水平,表明ABA 是控制楸树胚胎储藏物质积累的重要因素。
种子的正常发育受内源激素的绝对含量和激素动态平衡的调控,而激素之间的平衡关系比单一激素的作用更重要[7,20],尤其是受到促进生长类激素与抑制生长类激素之间比例的影响[30]。在2 个楸树无性系种子发育过程中,4 种植物激素含量存在明显的差异,IAA 和iPA 含量相对较低,GAs 和ABA 则相对较高,作为抑制生长类激素的ABA 在授粉45 d 后的发育过程中,含量一直明显高于促进生长类激素(IAA、iPA);2 个楸树无性系的种子均能正常发育,这表明激素间的比例关系才是更重要的影响因素。由于GAs 含量占促进生长类激素的主体,故(IAA + iPA + GAs)/ABA 的比值由GAs/ABA 的比值决定,二者均呈下降趋势。(IAA + iPA + GAs)/ABA 在授粉后45 d 达到最大值,表明早期的球形胚、心形胚和鱼雷胚发育需要较高的促进生长类激素;至授粉后70 d,所有胚胎均达到子叶胚时期,(IAA + iPA + GAs)/ABA显著下降,此时抑制类激素的比例上升,促进胚胎与种子的成熟,在华北驼绒藜[6]和扇脉杓兰[20]等研究中也有类似结果。洛楸3 号的IAA/ABA 比值在授粉后45 d 即达到最大值,并明显高于洛楸1 号,发育早期相对高比例的生长素促进洛楸3 号胚胎发育速度更快,与解剖结果相符;洛楸1 号的IAA/ABA 比值在授粉后90 d 显著上升,生长素促进了细胞的伸长生长,使种子的长度和宽度显著增加。虽然2 个楸树无性系的(IAA + iPA +GAs)/ABA 变化趋势相同,但IAA/ABA 的差异却导致了它们胚胎发育速度的明显差异,这表明生长素在楸树胚胎和种子发育过程中具有显著作用,即使它的含量和变化幅度并不是各种内源激素中最大的。
生长素是诱导体胚发生的关键因素[31-32],其含量在合子胚和体胚中变化较一致[33]。前期研究利用授粉后60 d 的楸树(无性系9-14)合子胚成功诱导出胚性愈伤组织[34],此时内源IAA 的含量已经显著下降,故胚性愈伤组织的诱导需要添加较高浓度外源生长素(1.0 mg·L−12,4-D)[34]。不同楸树无性系种子的内源IAA 含量存在较大差异,这影响了外源生长素的添加量,应测定内源IAA 含量以提供参考,基本原则是内源生长素含量相对高,则外源生长素添加量相应降低。需要注意的是,2,4-D 会对胚性愈伤组织的增殖及体胚分化产生不利影响,因此,需要及时降低浓度或更换为脱分化能力稍弱的生长素类。授粉后60 d 的楸树合子胚是比较合适的诱导胚性愈伤组织的材料,此时内源细胞分裂素已经极低,此后也无明显变化,因此外源细胞分裂素可能对诱导胚性愈伤组织的作用不明显。脱落酸对胚胎形态建成及成熟具有重要作用,同样也用于促进体胚的成熟[11,35];但在前期研究中,增殖后的楸树愈伤组织在未添加外源ABA 的1/2MS 培养基上成功分化出体胚并萌发成苗,这表明ABA 的作用因物种不同而异,ABA 不是楸树体胚成熟的必需条件。
此外,赤霉素主要分为C20-GAs 和C19-GAs两大类,有活性的赤霉素均属于C19-GAs,主要是GA1、GA3、GA7 等[36]。在本研究中均未检测出GA3,这是否是因为GA3 在楸树胚胎发育过程中的含量极低或是合成受阻,需要通过进一步研究才能明确。
4 结论
在楸树种子发育过程中,内源激素的含量随着胚胎发育进程而发生动态变化。抑制生长类激素ABA 的含量一直高于促进生长类激素的含量;除IAA 外,其余激素含量及激素间比例的变化趋势在2 个无性系间一致。IAA 在楸树胚胎发育过程中起重要的调控作用,是导致2 个无性系发育速度差异的主要原因。需要指出的是,本研究开始取样的时间较晚,这可能是导致未检测到细胞分裂素含量峰值的原因。本研究中均未检测出GA3,对此有待进一步研究。
