鸡爪槭金陵丹枫组培再生体系的建立
2021-03-15朱璐李淑顺闻婧马秋月颜坤元李倩中
朱璐 李淑顺 闻婧 马秋月 颜坤元 李倩中


摘要:鸡爪槭新品种金陵丹枫叶色绚烂,是优质的彩叶树种。以金陵丹枫带芽茎段为外植体,75%乙醇40s+0.1%氯化汞20min消毒效果最佳。以NN69为基本培养基,筛选獲得最适宜的启动培养基为NN69+0.1mg/LIBA,增殖培养基为NN69+0.4mg/LKT+0.1mg/LIBA,生根培养基为NN69+0.3mg/LIBA。探讨了金陵丹枫不定芽对羧苄青霉素和潮霉素的敏感性,筛选获得羧苄青霉素的临界值为300~400mg/L,潮霉素的临界值为2.5mg/L。
关键词:金陵丹枫;再生体系;羧苄青霉素;潮霉素
中图分类号:S792.350.5文献标志码:A
文章编号:1002-1302(2021)01-0054-05
作者简介:朱璐(1987—),女,山东淄博人,博士,助理研究员,研究方向为鸡爪槭遗传育种。E-mail:luzhu@jaas.ac.cn。
通信作者:李倩中,研究员,研究方向为槭树新品种选育及种质资源利用。E-mail:qianzhongli@jaas.ac.cn。
金陵丹枫是槭树科槭属植物鸡爪槭(Acerpalmatum)的一个园艺品种,由江苏省农业科学院经过多年选育而成[1]。其叶片掌状5~7裂,叶片边缘具有重锯齿,叶基部近心脏形,新叶为亮红色,观赏期达100d以上。金陵丹枫已获得江苏省林木良种认定证书和植物新品种权证书;可孤植、群植或作为高档盆栽用,具有极高的观赏和应用价值。
在金陵丹枫种苗的生产中,通常采用嫁接的方式,但是嫁接成活率受多种外界因素影响较大,如砧木和接穗的质量,嫁接季节和温度、湿度等,不利于大规模生产[2]。金陵丹枫扦插不易生根,繁殖较困难,因此亟待建立金陵丹枫的组培再生体系,解决批量生产的问题。目前,国内虽有少量鸡爪槭品种已建立了组培再生体系,如金陵黄枫、赤枫、日本红枫等[3-6],但是不同品种的鸡爪槭对不同培养基和植物激素的适应性差异很大,还需要针对不同品种研究其适宜的组培繁殖技术。
本研究以金陵丹枫当年生枝条作为外植体,通过启动培养、增殖培养和生根培养等阶段,筛选最适宜金陵丹枫生长的激素浓度,同时还研究了金陵丹枫不定芽对不同浓度的羧苄青霉素(carbenicillin,简称Carb)和潮霉素(hygromycin,简称Hyg)的敏感性,以期为金陵丹枫转基因体系的建立提供依据。
1材料与方法
1.1试验材料
鸡爪槭品种金陵丹枫健康无病害的当年新鲜枝条,采集于江苏省农业科学院槭树良种基地。试验于2019年5月开始进行,试验地点为江苏省农业科学院休闲农业研究所实验室。[LM]
1.2培养条件
培养基为NN69,购于北京酷来搏科技有限公司,添加蔗糖20g/L、琼脂5g/L,调整pH值至5.7。其他试剂均购于北京索莱宝科技有限公司。本试验光照强度为100μmol/(m2·s),光周期为16h—8h(光照—黑暗),温度为(25±2)℃。
1.3试验方法
1.3.1外植体消毒
将采集到的金陵丹枫当年生新鲜枝条剪去叶片,切取约3cm的带芽茎段,用洗洁剂清洗,自来水流水冲洗1h。使用75%乙醇和0.1%氯化汞组合消毒不同时间,同时添加0.2%Tween-20,消毒完毕后使用无菌水漂洗3次,在无菌滤纸上晾干表面水分后,接种到NN69培养基中,每瓶接种3个外植体,每个处理重复3次。随时观察其污染率,防止交叉感染,筛选最佳外植体消毒时间。
1.3.2启动培养
将上述获得的无菌外植体分别接种到含有不同生长素(IAA、IBA、NAA、6-BA和TDZ)不同浓度配比的NN69培养基中(表2),培养45d后,统计腋芽诱导率,观察腋芽萌动及后续生长状况。每个处理重复3次,筛选最佳启动培养基。
1.3.3增殖培养
将生长状况良好、长约1cm的腋芽剪下,放入含有不同浓度的细胞分裂素(6-BA和KT)和生长素(IBA和NAA)配比的NN69培养基中,培养45d后统计平均增殖系数。每个处理重复3次,筛选最佳增殖培养基。
1.3.4生根培养
将经过增殖培养获得的约1cm丛生芽分别剪下,转移到含有不同浓度生长素IAA(0.1、0.2、0.3、0.4、0.5mg/L)、IBA(0.1、0.2、0.3、0.4、0.5mg/L)和NAA(0.1、0.2、0.3、0.4、0.5mg/L)配比的NN69培养基中,培养30d后统计生根数及平均根长。每个处理重复3次,筛选获得最佳生根培养基。
1.3.5羧苄青霉素(Carb)抗性试验
选取增殖培养基上获得的生长状况良好的健壮不定芽接种到含有不同浓度Carb(0、100、200、300、400、500、600、700mg/L)的增殖培养基中,培养45d后统计不定芽的诱导率及平均增殖系数,同时观察不定芽的成活率及生长状况。每个处理重复3次,每个处理50个芽。
1.3.6潮霉素(Hyg)抗性试验
选取增殖培养基上获得的生长状况良好的健壮不定芽接种到含有不同浓度Hyg(0、2.5、5.0、7.5、10、12.5、15.0、17.5mg/L)的增殖培养基中,培养45d后统计不定芽的增值率及增殖系数,同时观察不定芽的成活率及生长状况。每个处理重复3次,每个处理50个芽。
1.4数据分析
试验数据采用Excel2016和SPSS19.0进行统计整理及分析,差异显著性采用ANOVA分析,Duncans检验(P<0.05)。
2结果与分析
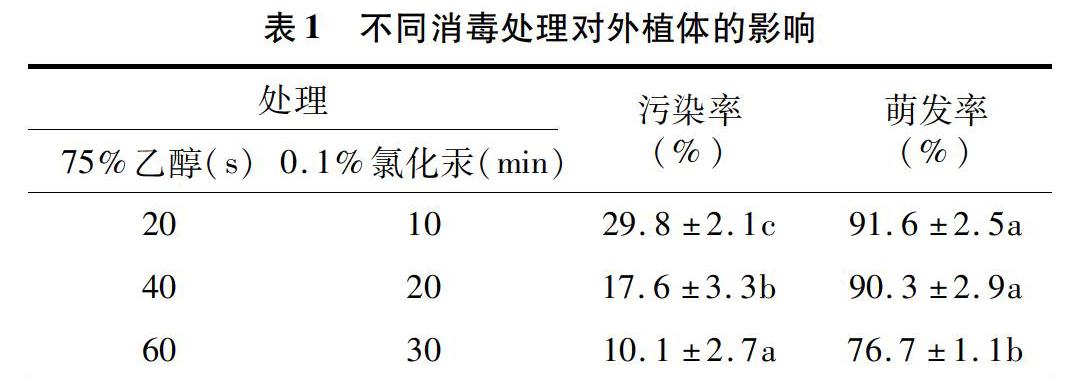
2.1不同消毒处理对外植体的影响
将田间采集的外植体茎段用不同的消毒时间进行处理(表1)。[JP+1]金陵丹枫外植体使用75%乙醇消毒40s和0.1%氯化汞消毒20min的组合处理时,既能保证金陵丹枫外植体具有较低的污染率(17.6%),又能保持较高的腋芽萌发率(90.3%)。因此,选用该处理对金陵丹枫外植体消毒效果最佳。
2.2不同激素配比对外植体启动培养的影响
将无菌外植体接种到不同激素配比的NN69培养基中,接种约10d后腋芽开始萌动,同时茎基部开始形成愈伤组织。接种45d后统计腋芽诱导率(表2),在NN69培养基中添加单种激素对金陵丹枫外植体启动培养的影响显著优于同时添加多种激素。其中添加IBA浓度为0.1mg/L时,腋芽诱导率最高,为(90.6±3.1)%,腋芽生长快且长势健壮。最终选择该培养基为金陵丹枫最佳培养基。
2.3不同激素配比对芽增殖培养的影响
将无菌外植体在启动培养基上生长的腋芽剪下,放入不同激素浓度配比的NN69培养基中培养45d后,统计观察腋芽平均增殖系数(增殖系数=产生的丛生芽数/接种的腋芽数×100%)。统计结果见表3,金陵丹枫腋芽在不同激素组合的增殖培养基中的平均增殖系数差异显著。6-BA和IBA组合的平均增殖系数为3.1~3.6,TDZ和IBA组合的平均增殖系数为2.2~2.9,KT和IBA组合的平均增殖系数为6.2~8.3,明显优于其他激素组合。其中在添加0.4mg/LKT和0.1mg/LIBA的NN69培养基中腋芽的增殖系数最高,为8.3,显著高于添加其他激素组合的培养基,且该培养基上生长的丛生芽状态良好,长势健壮,利于进行生根培养。
2.4不同浓度生长素对生根的影响
将在增殖培养基上产生的丛生芽剪下,分别转移到含有不同生长素浓度的NN69培养基中,观察统计不定芽的生根状况。试验结果显示,金陵丹枫不定芽在添加不同生长素的培养基中生根状况差异显著。在添加IAA的培养基上,生根率仅为55.9%~65.4%,平均根系量仅为2.5~3.7,平均根长仅为1.9~2.9cm。在添加IBA的培养基上,生根率显著升高,为75.9%~95.6%,平均根系量为4.3~7.1条,平均根长为3.0~3.9cm。在添加NAA的培养基上,生根率仅为67.8%~80.1%,平均根系量仅为3.1~3.9条,平均根长仅为2.3~2.9cm。不定芽在添加0.3mg/LIBA的培养基上,生根率最高,平均根系量和平均根长最大,小苗长势最好(表4)。鸡爪槭金陵丹枫丛生芽分化及生根情况见图1。
2.5不同浓度的羧苄青霉素对诱导丛生芽的影响
抗生素Carb可以有效抑制农杆菌的生长,同时也会抑制丛生芽的诱导和增殖。随着Carb浓度的增高,金陵丹枫丛生芽的诱导率和平均增殖系数显著降低(表5),表明金陵丹枫丛生芽对Carb非常敏感。Carb浓度为700mg/L时,丛生芽诱导率仅为45.9%,且丛生芽基本停止增殖。
2.6不同浓度的潮霉素对诱导丛生芽的影响
抗生素Hyg在遗传转化筛选过程中起着重要作用。Hyg也会抑制丛生芽的诱导和增殖,甚至会导致丛生芽白化死亡。Hyg对金陵丹枫丛生芽的生长影响尤为明显。当Hyg浓度为10.0mg/L时,丛生芽的诱导率仅为20.3%,且丛生芽几乎不增殖。当Hyg浓度为12.5mg/L时,丛生芽不被诱导,且20.6%丛生芽出现白化死亡现象(表6)。
3结论与讨论
组培再生技术具有繁殖速度快、繁殖系数大、繁殖后代整齐一致等优点,被广泛应用于各种植物种苗繁育中。但是由于物种之间的差异,许多木本植物仍面临组培再生困难的问题。本研究以鸡爪槭金陵丹枫为研究对象,建立了组培再生技术体系。以当年生枝条为外植体,75%乙醇消毒40s,0.1%氯化汞消毒20min,流水冲洗后接种到NN69+0.1mg/LIBA的培养基上进行启动培养,诱导腋芽萌发。将萌发的腋芽切下,接种到NN69+0.4mg/LKTNN69+0.1mg/LIBA的培养基上进行增殖培养,诱导产生丛生芽。从产生的丛生芽切下的单个不定芽接种到NN69+0.3mg/LIBA的培养基上进行生根培养,长成带根小苗后可以移栽到穴盘。通过金陵丹枫不定芽对羧苄青霉素和潮霉素的敏感性的研究,发现当Carb浓度为700mg/L或者Hyg浓度为10mg/L时,丛生芽基本停止增殖。
进行组培再生体系的建立第1步是要解决外植体的污染问题。由于本试验的外植体取自大田的当年生枝条,附生菌较多,故采用了75%乙醇消毒和0.1%氯化汞消毒组合消毒的方式,这与前人的研究结果[3]一致。在组培过程中,常用的基本培养基有MS[7]、WPM[8]、NN69[9]、B5[10]、White[11]等,不同基本培养基对槭属植物再生体系的建立具有重要影响。鸡爪槭赤枫使用了MS培养基作为基本培养基[4],日本红枫青龙使用了WPM培养基[5],鸡爪槭金陵黄枫使用了NN69培养基[3]。本试验也选择NN69作为基本培养基进行培养。植物生长调节剂是组培再生体系建立过程中不可或缺的物质,其种类、浓度和配比等是诱导腋芽生长、腋芽增殖和不定芽生根的关键因子[12-13]。鸡爪槭赤枫[4]、复叶槭[13]、红翅槭[14]和尖尾槭[15]均采用了6-BA和IAA的组合实现了腋芽的增殖。鸡爪槭金陵黄枫利用TDZ和NAA组合使用时,腋芽增殖系数最高[3]。日本红枫青龙在TDZ和IBA组合中增殖最快[5]。这说明槭属植物对激素种类和浓度的感知具有较大差异,不同基因型的槭属植物需要不同激素浓度和配比。
羧苄青霉素对根癌农杆菌具有很好的抑制作用,但是高濃度的羧苄青霉素会抑制不定芽的生长和增殖,浓度过低又不足以抑制农杆菌生长。在贡菊叶片诱导不定芽的过程中,当羧苄青霉素为250mg/L时,不定芽的诱导不受影响[16]。蓝莓与树莓在分化阶段羧苄青霉素的临界值为200~300mg/kg[17]。金陵丹枫不定芽对羧苄青霉素的临界值则为300~400mg/L。在转基因体系建立过程中,潮霉素作为抗性筛选标记具有重要作用。潮霉素浓度过高会导致植物细胞死亡,严重抑制植株生长。不同物种对潮霉素的敏感性差异巨大。巨霸杨对潮霉素临界浓度为4~6mg/L[18]。甘蔗在愈伤组织形成过程中,潮霉素的筛选浓度为30mg/L[19]。[JP3]金陵丹枫不定芽对潮霉素较为敏感,潮霉素浓度为2.5mg/L时,已经影响丛生芽的诱导率和增殖系数。
本研究建立了鸡爪槭金陵丹枫组培再生体系,为大量工厂化育苗提供了技术支撑;并且开展了不定芽对羧苄青霉素和潮霉素的抗性试验,筛选出了临界浓度,以期为金陵丹枫遗传转化体系的建立和优化提供参考,同时为进一步目的基因导入和分子遗传育种改良奠定了基础。
参考文献:
[1]闻婧,李淑顺,朱璐,等.鸡爪槭新品种‘金陵丹枫[J].园艺学报,2019,46(增刊2):2919-2920.
[2]吕运舟,黄利斌,何旭东,等.鸡爪槭园艺品种分类及栽培研究综述[J].江苏林业科技,2014,41(5):41-45.
[3]李倩中,刘晓宏,李淑顺,等.鸡爪槭新品种金陵黄枫组培技术初探[J].江苏农业科学,2011,39(4):49-50,89.
[4]马建华,朱晓菲,何程相,等.鸡爪槭(AcerpalmatumThunb.)品种‘赤枫组培再生体系的建立[J].中国农业科技导报,2020,22(1):171-178.
[5]孙红英,辛全伟,林兴生,等.日本红枫“青龙”组织培养与快速繁殖[J].中南林业科技大学学报,2019,39(7):44-47.
[6]舒婷,高小坤,罗文熠,等.日本红枫外植体的选择及启动培养初步研究[J].安徽林业科技,2017,43(6):26-28,32.
[7]MurashigeT,SkoogF.Arevisedmediumforrapidgrowthandbioassayswithtobaccotissuecultures[J].PhysiologiaPlantarum,1962,15(3):473-497.
[8]LloydG,McCownB.Commercially-feasiblemicropropagationofmountainlaurel,Kalmialatifolia,byuseofshoot-tipculture[J].CombinedProceedingsofInternationalPlantPropagatorsSociety,1980,30:421-427.
[9]GamborgOL,MillerRA,OjimaK.Nutrientrequirementsofsuspensionculturesofsoybeanrootcells[J].ExperimentalCellResearch,1968,50(1):151-158.
[10]LamportD.Cellsuspensionculturesofhigherplants:isolationandgrowthenergetics[J].ExperimentalCellResearch,1964,33(1):195-206.
[11]HillK,SchallerGE.Enhancingplantregenerationintissueculture[J].PlantSignaling&Behavior,2013,8(10):212-224.
[12]JiménezVM.Involvementofplanthormonesandplantgrowthregulatorsoninvitrosomaticembryogenesis[J].PlantGrowthRegulation,2005,47(2):91-110.
[13]李艳敏,孟月娥,赵秀山,等.金叶复叶槭组织培养技术研究[J].河南农业科学,2008,37(7):98-99.
[14]唐丽,钟秋平,刘显梅,等.红翅槭的组织培养及再生技术[J].北方园艺,2010(9):136-138.
[15]DurkovicJ.RegenerationofAcercaudatifoliumHayataplantletsfromjuvenileexplants[J].PlantCellReports,2003,21(11):1060-1064.
[16]徐亚男,任镘蓉,岳圆圓,等.贡菊再生体系建立及羧苄青霉素浓度筛选[J].延边大学农学学报,2019,41(3):41-45.
[17]张寅玲,黄俊轩,李建科,等.羧苄青霉素对几种浆果分化及生长的影响研究[J].北方园艺,2010(16):135-137.
[18]王桂英,刘晓杰,李珊珊,等.巨霸杨组培再生体系的建立及潮霉素抗性试验[J].北方园艺,2015(13):98-102.
[19]姚丽,吴才文,曾千春.甘蔗遗传转化中不同阶段潮霉素抗性筛选[J].中国糖料,2010(2):17-19.
