基于生长发育与多糖含量的黄精需水规律研究
2021-03-14刘玉翠王志纯贺立鹏肖井雷
闫 莉,刘玉翠,王志纯,李 婧,贺立鹏,肖井雷
(1.长春中医药大学药学院,长春130117;2.长春中医药大学附属医院,长春130021;3.白城中医院,白城137000)
黄精(Polygonatum sibiricumRed.)为百合科黄精属多年生草本植物,始载于《雷公炮炙论》,为黄精药材的正品来源,具有补气养阴、健脾、润肺、益肾的功效[1]。黄精中含有生物碱、芳酮、甾体皂苷、木质素、氨基酸和多糖[2-5]等多种化学成分,其中黄精多糖在黄精成分中扮演着重要的角色[6],是其生物活性主要来源[7],如抗糖尿病、抗衰老、增强免疫力、抗氧化、抗疲劳等[8-10]。黄精主要分布于东北地区[11],为吉林省道地大品种。近年来,黄精市场需求量逐年增加,市场缺口很大,且有拉大趋势。目前,黄精仍以野生为主,种植不成规模,资源锐减,采挖量少;生长周期长,产量有限,而人工种植是解决资源匮乏的有效途径。前人在肥料、透光率、郁闭度、间伐等对黄精生理、产量与多糖含量的影响方面做了许多研究[12-15],多是基于其耐阴性或需肥性对生理和质量的影响,但对于需水规律的研究较少,而土壤水分状况直接影响植物的光合作用、形态特征乃至生态适合度。而且从生境来看,由于中草药种类繁多,生长地区的不同,水分和养分是中草药生长的关键所在,应当建立在中草药需水生理规律基础上开展其它研究[16],因此本文基于黄精的叶面积、株高、根茎长、叶绿素荧光值、生物量等生理性指标以及多糖含量内在品质指标探讨黄精适宜性需水量,为其水肥耦合体系的奠定理论基础。
1 材料与方法
1.1 实验设计
试验于2019年4~11月在长春中医药大学七星百草园温室中开展,年平均气温在20℃左右,供试材料为生长发育良好的黄精带芽根茎,经长春中医药大学肖井雷副教授鉴定为百合科植物黄精(Polygonatum sibiricumRed.)。采用盆栽法,花盆高18cm,口径21cm,每盆土深保持在16cm左右。选用长势良好且大小相对一致根茎种植于花盆内,每个处理3个重复。约两周待植株适应生长后开始进行不同水肥胁迫处理,分别进行株高、叶面积、根长形态指标测定;根茎鲜重、根茎干重测定;黄精多糖含量测定。
以吉林省年均降水量680mm为参考并设为对照,设计5种供水处理,即严重干旱量处理(400mm)、中度干旱量处理(500mm)、轻度干旱量处理(600mm)、充分水量处理(700mm)、极充分供水量处理(800mm)。从苗出土开始供水,每个样品组的供水次数、时间相同,每隔5d给水1次,给水时模拟自然降水,用小喷壶将水喷洒在药材植株上,逐渐进入土中,一般在16:00~17:00供水,记录每月的供水次数、供水量、苗长势等。
1.2 仪器与试剂
JM-A5002电子天平(诸暨市超泽衡器设备有限公司);DHG-9053A电热鼓风干燥箱(上海一恒科学仪器有限公司);YMJ-B叶面积测定仪(浙江托普云农科技股份有限公司);Yaxin-1162叶绿素荧光仪(北京雅欣理仪科技有限公司);TU-1810紫外分光光度计(北京普析通用仪器有限责任公司);MiLLi-Q超纯水机(德国默克化工技术有限公司)。
无水葡萄糖(110833-201506-20mg,中国食品药品检定研究院);蒽酮(S19210-5g,上海源叶生物科技有限公司);浓硫酸(北京化工厂);乙醇(分析纯,北京化工厂);蒸馏水为自制。
1.3 生长指标测定
株高和根茎长采用卷尺和直尺测定,株高每个样品组分别在生长前期(5月)、中期(7月)、后期(9月)各测定一次取平均值;根茎在采挖后(10月),除去须根及泥沙,测量直线长度,每个样品组测3次,取平均值,记录数据;叶面积采用叶面积自动测定仪测定每株顶端叶片面积,每个样品组分别在生长前、中、后期各测定一次取平均值,记录数据;生物量测定于根茎采挖后,除去须根及泥沙,用电子天平测定鲜重(g/株);室温下晾干1周后于60℃烘箱中烘干至恒重后测定重量(g/株),每个样品组测3次,取平均值,记录数据。结果见表1。
1.4 叶绿素荧光诱导动力学曲线测定
每个处理取3株,对各植株1/2高度的相同部位成熟叶片,进行暗适应处理30min,然后用叶绿素荧光测定仪(光强2500,时长1s)于上午9:30~11:00时,分别测定不同处理条件下植株的叶绿素荧光参数值,测定3次取平均值,结果见图2,并用其安装目录下的YGTrans软件处理绘制快速荧光动力学曲线,OJIP曲线见图1。
1.5 黄精多糖含量测定
紫外-可见分光光度法测定黄精多糖含量,测定方法参照2020年版《中国药典》(一部)黄精含量测定项下,所得标准曲线为Y=38.407X+0.0704,R2=0.9994。结果见图3。
1.6 数据分析
用SPSS 20.0单因素方差分析方法(One-way ANOVA)及最小显著差异统计(LSD)t检验对各处理效应进行差异显著性分析比较(P<0.05),YGTrans.运行处理OJIP曲线,利用EXCEL 2010做图。
2 结果与分析
2.1 不同水分梯度处理对黄精生长指标的影响
植物生长形态指标能直观反映不同栽培处理方式的促进效果,其中株高是植株生长状况的重要形态指标[17],根生物量是植物形态变化对养分适应的重要表征[18],叶面积通常作为评价生理特性的常用参数[19]。由表1可看出,不同水分处理下,黄精在极充分水环境条件下的株高度、根茎长度、生物量都显著高于其它水分生长环境(P<0.05),叶面积以充分水条件下较大(P<0.05)。综合分析结果可知,黄精在水分充足条件下生长发育状态较旺盛。

表1 不同水分梯度处理下的黄精生长特性值Table 1.The growth characteristic value of Polygonatum sibiricum Red.under different water gradient
2.2 不同水分梯度处理对黄精快速叶绿素荧光诱导曲线的影响
植物光系统Ⅱ(PSⅡ)光合变化可以通过OJIP曲线来反映[20]。从图1可看出,在6种梯度处理下的黄精叶片的OJIP曲线变化趋势基本相同,但荧光值有差异。在O点处(0.02ms)相差基本不大;从J点(2ms)开始,到I点(30ms)时,不同水分处理间荧光值差异显著,严重干旱量处理下的荧光值显著高于其它处理;达到P点时,荧光值趋于稳定,不同处理的最大荧光值Fm表现为严重干旱量>自然降水量>轻度干旱量>充分水量>中度干旱量>极充分水量。
叶绿素含量与叶绿素荧光参数相结合能够更加准确地反映植物的生长状态。初始荧光F0是PSⅡ反应中心处于完全开放时的荧光产量,F0值越高说明PSⅡ反应中心的失活或受破坏程度越高;最大荧光Fm反映了PSⅡ的电子传递和荧光产量的变化,Fm越大,电子反映程度越快[21-22]。从图2可看出F0和Fm均从严重干旱处理条件以后呈整体下降趋势,以其和充分水处理条件下值最大,但各处理水平下的值并没有显著性差别。

图1 不同水分梯度处理下的黄精快速叶绿素荧光诱导动力学曲线FIG.1 Dynamic curve of chlorophyll fluorescence induction under different water gradients
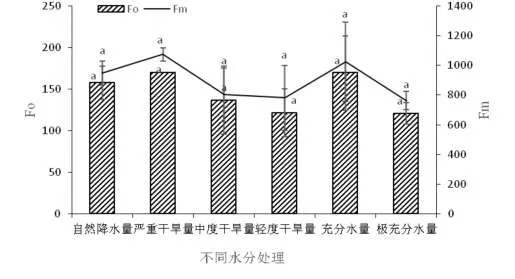
图2 不同水分梯度处理对黄精初始荧光F0和最大荧光Fm的影响FIG.2 Effects of different water gradient treatments on F0 and Fm of Polygonatum sibiricum Red.
2.3 不同水分梯度处理对黄精多糖含量影响
由图2可看出,不同水分梯度处理下,以中度干旱和充分水时黄精多糖含量较高,极充分水时黄精多糖含量下降,可见黄精多糖在合成过程中需要一定的水,但以中度干旱为宜,水分过多黄精多糖含量则会下降。

图3 不同水处理下的黄精多糖含量Fig.3 The content of polysaccharide in different water gradient注:不同小写字母代表差异性显著(P<0.05)Note:Different lowercase letters represent significant differences(P<0.05)
3 结论与讨论
水分是影响光合作用及蒸腾作用的重要因素,光合速率不仅是反应植物生理特性的重要指标,也是评估光合生产生物量能力的重要参数之一,充足的水分不仅可以保证植物进行正常的生长发育,也会促进有效成分的积累,但水分过多也会造成植物根系对养分利用受阻,合成有效成分关键酶的失活,有研究表明在适当干旱胁迫条件下植物可以启动自身防御系统及刺激,有效成分合成协同作用来抵制外界环境对自身的侵害[23]。因此,结合黄精生长发育特性和多糖含量实验结果,在黄精栽培过程中,保持充足的水分但以中度干旱为主即可有效保证良好的生长发育和促进黄精多糖含量的提升,否则过旱或水分极度充足时黄精产量和多糖含量均会下降。
与植物外在的直观表现相比,叶绿素荧光参数更加能够反映植物的内部变化和植物的生长状况;通过叶绿素荧光动力学可以在不损伤植物的情况下测试植物叶片的光合反应速率和受胁迫的状态。植物经过暗适应后暴露在可见光下,荧光值会随时间有所变化,形成的曲线就是叶绿素荧光诱导曲线。植物快速叶绿素荧光诱导动力学曲线(OJIP)可以反映出大量关于PSⅡ反应中心原初光化学反应的信息[24]。J相荧光强度升高是由于QB不能及时接受、还原来自QA-的电子,导致QA-的大量积累,I相和P相分别是由于快还原型PQ库和慢还原型PQ库被完全还原造成的[25]。本研究中在I点时不同处理间荧光值差异显著,严重干旱量处理的值显著高于其他处理的;在J~I点之间,严重干旱量在QA-向QB的电子传递过程中所耗散的能量最小,且荧光值趋于稳定,在6种不同水处理下黄精叶片在I点和P点的荧光值差异显著,可以明显从OJIP曲线中找出最适梯度为严重干旱量。但严重的干旱会对植物生长发育受阻,过分的胁迫会使OJIP曲线出现明显的K拐点,K点的出现是放氧复合体(OEC)受伤害的标志,K点的相对可变荧光代表OEC被破坏的程度,胁迫越大会对植物伤害程度越大[26]。在本实验叶绿素荧光特征值对比时发现,虽然严重干旱的电子传递效率较高,但其对光能的利用也越低,可能受到失活或破坏的程度越大,会极易出现K拐点。
