毛竹NIP基因的分子特征及应答胁迫的表达模式*
2021-03-13朱成磊杨克彬徐秀荣李晓佩高志民
朱成磊 杨克彬 徐秀荣 马 霜,2 李晓佩 高志民
(1.国际竹藤中心竹藤资源基因科学与基因产业化研究所 国家林业和草原局/北京市共建竹藤科学与技术重点实验室 北京 100102; 2.西南科技大学 绵阳 621010)
水是植物细胞维持正常的生理功能不可缺少的组成部分,而水分子的跨膜转运主要通过水通道蛋白(aquaporins, AQPs)来完成的。嵌于生物膜上的水通道通常由4个功能独立的AQPs构成的四聚体组成(de Grootetal., 2001),植物通过水通道快速调节水分平衡来适应外界环境的变化(Johansonetal., 2001)。植物中根据AQPs在细胞中的位置及结构将其分成5个亚家族(PIPs、TIPs、NIPs、SIPs和XIPs)(Danielsonetal., 2008),其中膜内在水通道蛋白(nodulin 26-like intrinsic aquaporin proteins, NIPs)最初在大豆(Glycinemax)中发现,被定义为类NOD26膜内在水通道蛋白(Fortinetal., 1987)。随后发现植物中NIPs普遍存在,主要在细胞膜上行使水分子和一些小分子物质的运输功能,在保护植物免受外界环境伤害方面发挥着重要作用。例如,AtNIP2;1主要在拟南芥(Arabidopsisthaliana)成熟根的维管组织和根尖中表达,参与根系营养物质的吸收和根尖的发育(Choietal., 2007);AtNIP7;1参与砷的吸收与转运(Isayenkovetal., 2008);AtNIP5;1参与硼的运输(Gómez-Sotoetal., 2019)。有研究表明,NIP基因在盐和其他金属离子等逆境胁迫中均扮演着重要角色(Wangetal., 2017; Zhuetal., 2019)。定位在细胞膜上的水稻(Oryzasativa)OsNIP2;1(Zhaoetal., 2010)、大麦(Hordeumvulgare)HvNIP2;1(Schnurbuschetal., 2010)分别具有运输硅和硼穿过细胞膜的功能,而硅和硼在应对各种胁迫保护植物方面具有重要作用。
毛竹(Phllostachysedulis)是我国最重要的竹种之一,现有林地面积467.78万hm2,占全国竹林面积的72.96%(李玉敏等,2019)。低温和干旱是影响毛竹生长和分布的主要环境限制因子,如自然低温胁迫条件下,1年生、2年生毛竹和成竹的半致死温度依次降低,且与1月下旬叶片中可溶性糖含量呈极显著正相关,与12月上旬叶片中MDA含量呈显著负相关(应叶青等,2011)。模拟干旱条件下对毛竹叶片的研究表明,水势驱动不同竹龄个体之间水分输送的方向,使毛竹适应干旱胁迫环境(曹永慧等,2018)。研究表明,DREB、NAC、WRKY等多种转录因子(Wuetal., 2015; Wangetal., 2016; Lietal., 2017),以及LEA、PeUGE、ZEP等多种结构基因(Huangetal., 2016; Sunetal., 2016; Louetal., 2017)参与了毛竹对低温和干旱等胁迫的应答。过量表达毛竹水通道蛋白基因PeTIP4;1-1能够提高转基因拟南芥的抗旱能力(Sunetal., 2017),然而对于毛竹NIP基因却知之甚少。本研究在全面分析毛竹NIP家族成员的基础上,采用实时荧光定量PCR(qPCR)技术分析毛竹NIP基因在干旱和温度胁迫条件下表达模式,以期为深入研究毛竹NIP基因的功能提供参考。
1 材料与方法
1.1 毛竹NIP基因查找及理化性质分析
以模式物种水稻和拟南芥的NIP基因为种子序列,利用TBtools软件(Chenetal., 2020)基于毛竹第2版本基因组数据(Zhaoetal., 2018)进行同源序列查找。运用BLASN和BLASTX对所获得序列进行比对分析,阈值E<10-20,并对获得的序列用SMART在线软件进行保守结构域分析,保留具有完整NIP基因保守结构域的序列。最终获得毛竹NIP基因成员,并根据它们与水稻的亲缘关系进行命名。用在线软件ProtParam(http:∥web.expasy.org/protparam/)对毛竹NIP基因编码蛋白的理化性质进行分析。
1.2 毛竹NIP基因生物信息学分析
运用TBtools软件以及毛竹第2版本基因组数据对毛竹NIP基因的基因结构进行分析;使用在线软件MEME(http:∥meme.nbcr.-net/meme/intro.html)对毛竹NIP氨基酸保守基序进行分析,利用DNAMAN 8.0将毛竹NIP氨基酸序列与拟南芥AtNIP1-1和水稻OsNIP1-1进行序列比对及保守结构分析;使用WoLF PSORT算法(http:∥wolfpsort.seq.cbrc.jp/)和TMHMM Server v.2.0软件(http:∥www.cbs.dtu.dk/services/TMHMM/)分别预测亚细胞位置和跨膜结构域;使用在线软件PlantCARE(http:∥bioinformatics.psb.ugent.be/webtools/plantcare/html/),对毛竹NIP基因上游启动子序列(2 000 bp)中所含调控元件进行分析预测(Lescotetal., 2002)。
利用BLASTP程序对毛竹和水稻氨基酸序列进行双向比对,配对超过100个氨基酸分子,阈值E<10-50(Zhangetal., 2018)的序列被定义为1对共线性序列,通过TBtools内置的MCScanX程序(Wangetal., 2012)对2个物种间的NIP共线性基因进行可视化展示。同时,根据毛竹和水稻基因组的同源性结果,利用TBtools计算所有NIP同源基因对之间的同义(Ks)和非同义(Ka)核苷酸替换率。
为探究毛竹NIP基因的潜在功能及其进化关系,分别从Rice genome annotation database、PLAZA、TAIR和Phytozome数据库获得水稻、玉米(Zeamays)、高粱(Sorghumbicolor)、拟南芥和毛果杨(Populustrichocarpa)NIP的氨基酸序列,基于MEGA 7.0内置的Clustal W对毛竹和这些下载的NIP序列进行比对分析,并构建系统进化树(Kumaretal., 2016),参数选择:邻接法,校验参数为1 000次重复,氨基酸替换模型选用No.of differences(Jonesetal., 1992),缺失位点处理方法选择完全删除。
1.3 毛竹NIP基因组织特异性表达分析
从NCBI Short Read Archive下载的毛竹组织(鞭、笋、根、叶片、芽和鞘)的26个转录组数据(登录号:SRX2408703—SRX2408728)(Zhaoetal., 2018),筛选其中NIP基因的FPKM(fragments per kilobase of exon model per million mapped fragments, 每千个碱基的转录每百万映射读取的碎片值),并取以2为底的对数(Log2)作为基因的表达量,用TBtools软件绘制表达谱热图,可视化分析不同基因的表达情况。
1.4 毛竹NIP基因在不同胁迫条件下表达分析
毛竹种子播种后,在人工气候室(温度25 ℃左右,光16 h/暗8 h,相对湿度80%左右)中培养,选择生长一致的3个月毛竹实生幼苗,随机分成3组进行处理。向A组基质中添加20% PEG 6000至饱和状态,B组和C组分别放入4 ℃和42 ℃培养箱中处理。每个处理至少收集15株幼苗,每个处理3次重复。分别在处理后0、1、3、6、12 h后收集毛竹根系样品,液氮速冻后存于-80 ℃冰箱备用。用Takara RNA试剂盒提取样品总RNA并反转录成cDNA,存于-20 ℃冰箱用于后续试验。
根据毛竹NIP基因序列使用Primer Premier 5软件设计定量引物(表1)。qPCR反应体系(10.0 μL)为:2 × SYBRⅡGreen 1 Master 5.0 μL,正向/反向引物0.3 μL,模板cDNA1.0 μL,ddH2O 3.4 μL。扩增程序:95 ℃预变性5 min;95 ℃变性10 s,61 ℃退火10 s,循环40次。以PeTIP41为内参基因,定量结果采用2-ΔΔCT法(Livaketal., 2001)分析,基于TBtools进行归一化后绘制表达量热图。
1.5 毛竹NIP基因的载体构建与酵母表达分析
根据基因特征和表达模式分析结果,选择2个基因(PeNIP1-1和PeNIP2-2)设计编码区扩增引物(ORF-NIP1-1和ORF-NIP2-2)和酵母表达载体构建引物(BENIP1-1和BENIP2-2)(表1),以毛竹cDNA为模板先扩增编码区,经测序验证正确后,以测序正确的质粒为模板扩增得到包含双酶切位点的基因片段。采用BamHⅠ和EcoRⅠ双酶切将含有PeNIP1-1和PeNIP2-2目的基因的片段分别克隆到pYES2载体的多克隆位点,形成酵母表达载体pYES2∷PeNIP1-1和pYES2∷PeNIP2-2。

表1 PCR引物①
载体经测序验证正确后,按照INVSc1感受态细胞(Weidibio, 中国)的转化说明书,将酵母表达载体pYES2∷PeNIP1-1和pYES2∷PeNIP2-2以及空载pYES2质粒分别转入感受态细胞。将重组酵母分别涂布于固体培养基(SD-Ura+2%葡萄糖,pH5.8)上,30 ℃培养48~96 h。分别挑取单克隆接种于液体培养基中,30 ℃振荡(200 r·min-1)培养24 h左右,取一定量的培养物,4 000 r·min-1离心1 min收集菌体,菌体重悬于液体诱导培养基(SD-Ura+2%半乳糖,pH5.8)中,调整菌液OD600值为0.2,30 ℃振荡诱导培养36 h。取诱导培养后菌液,分别稀释5个梯度(10-1、10-2、10-3、10-4、10-5),取菌液5 μL分别接种在含0.5、1.0和1.5 mol·L-1山梨醇或NaCl的固体诱导培养基上,30 ℃培养3~5天后,比较观察酵母的生长差异。
2 结果与分析
2.1 毛竹NIP基因鉴定与蛋白理化性质
通过比对分析,在毛竹基因组数据库中共获得14个具有完整保守结构域的NIP家族基因,根据与其他物种的亲缘关系分别命名为PeNIP1-1—PeNIP1-6、PeNIP2-1—PeNIP2-4和PeNIP3-1—PeNIP3-4(表2)。利用在线分析软件对PeNIPs编码蛋白预测分析的结果表明,14个PeNIPs编码蛋白的氨基酸长度为235~297 aa,相对分子量在24.03~31.84 kDa之间;理论等电点在6.51~9.24之间,且除PeNIP1-3和PeNIP2-1之外其余的均大于7.00;仅PeNIP3-3有4个跨膜结构,其他13个PeNIPs均有6个跨膜结构;亚细胞定位预测显示所有PeNIPs均定位于细胞质膜上(表2)。
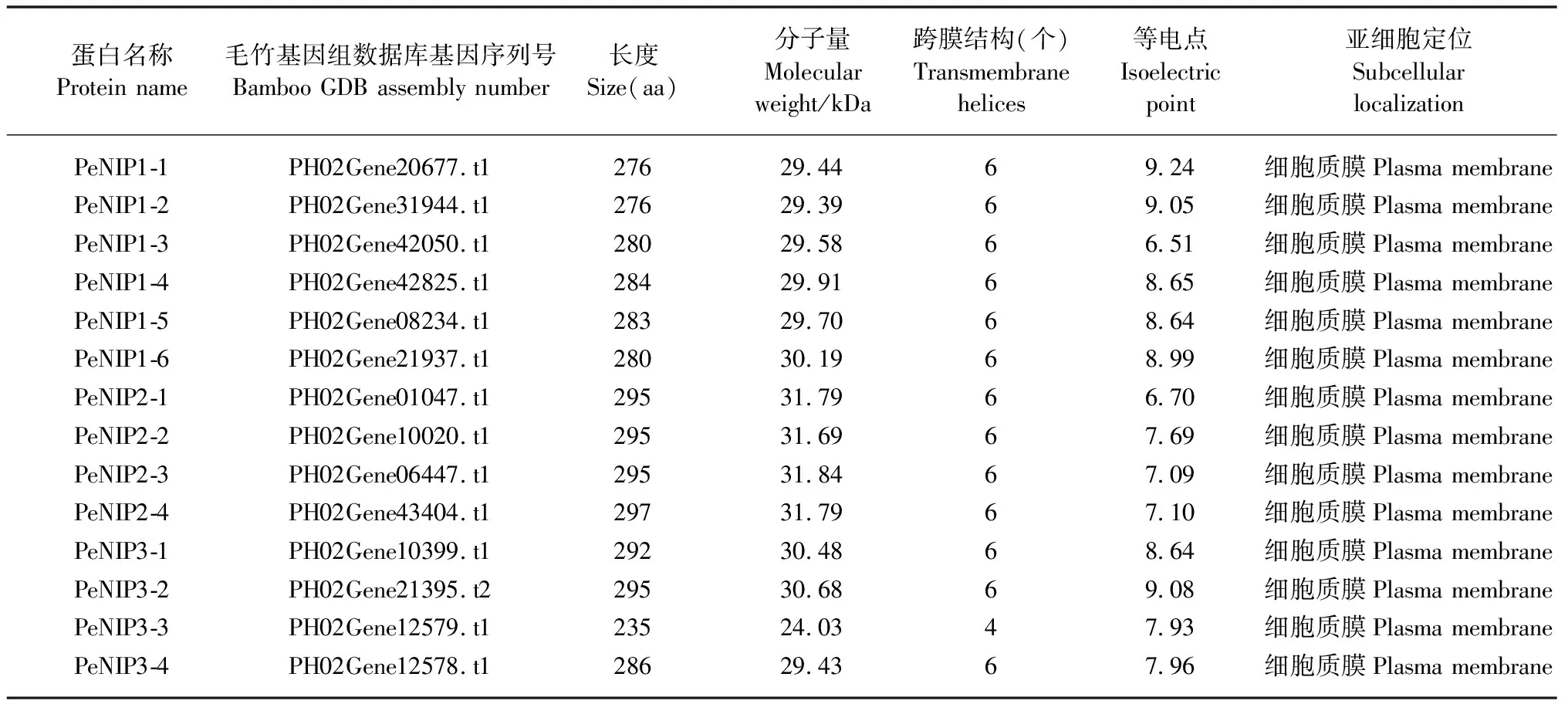
表2 PeNIPs蛋白的理化性质和亚细胞定位预测
2.2 PeNIPs的系统进化
为检测PeNIPs之间的进化关系,预测其潜在功能,对毛竹、水稻、玉米、高粱、拟南芥和毛果杨的NIP氨基酸序列进行比对分析,利用MEGA7.0构建系统进化树(图1)。结果表明,6种植物的NIP成员被分成了3个大的分支(Ⅰ、Ⅱ和Ⅲ),其中Ⅰ中6种植物的NIP成员都有,又大致可分为2组,即毛竹的6个成员(PeNIP1-1—PeNIP1-6)和其他单子叶植物(水稻、高粱和玉米)的NIPs聚类在一起,而双子叶植物拟南芥和毛果杨的NIPs聚类在一起;在Ⅱ分支中,主要是单子叶植物的NIP成员,包括毛竹4个成员(PeNIP2-1—PeNIP2-4)以及水稻的2个、高粱的2个和玉米的2个成员,仅包含1个双子叶植物毛果杨成员(PtNIP2-1);而在Ⅲ分支中各植物种成员间差异较大,聚类较为分散,但4个PeNIPs均与水稻或高粱的NIP成员聚类在一起。由此说明,毛竹与单子叶植物水稻、高粱和玉米的亲缘关系更近,在功能上PeNIPs或许与单子叶植物中的同源基因相似(Hanaokaetal., 2014; Yamajietal., 2009)。

图1 基于不同种植物NIP家族成员构建的系统进化树
2.3 毛竹与水稻NIP成员的基因片段复制和共线性
基因复制和功能分化在基因家族扩张和新功能的演变中发挥着重要作用,毛竹在4 800万年前与水稻分化之后,又在700~1 200万年前发生了多数基因簇的分化(Pengetal., 2013)。为研究毛竹PeNIPs与其近缘物种水稻的进化关系,对毛竹和水稻中NIP基因的共线性关系及类型进行分析。结果表明,在毛竹14个PeNIPs中除PeNIP3-3和PeNIP3-4没有共线性关系外,共找到毛竹12个基因与水稻8个NIP基因存在27对片段重复,没有发现串联重复及其他重复类型的基因。毛竹与水稻的NIP基因共线性分为2种类型:一是单个基因对应,如PeNIP3-2/OsNIP3-1和PeNIP3-1/OsNIP3-1;二是单个基因与多个基因对应,如PeNIP1-1对应OsNIP1-1、OsNIP1-2和OsNIP1-4共3个基因(图2)。通常认为,非同义对同义取代比(Ka/Ks)<1表示基因选择为纯化的功能约束,Ka/Ks>1表示为阳性选择的进化加速,Ka/Ks=1表示为自然选择(Anisimovaetal., 2001; Rothetal., 2006)。对毛竹和水稻具有片段重复的基因进行Ka/Ks分析结果显示,27对NIP基因的Ka/Ks均小于1,最大不超过0.56,表明毛竹NIP基因经片段复制后,主要经历了较强的纯化选择,功能分化有限,且在随后的进化过程中毛竹重复NIP基因间的功能差异不大。
2.4 PeNIPs基因结构及编码氨基酸的保守基序和结构域
基因结构分析表明,14个PeNIPs均具有内含子(3~5个),大部分成员含4个或者5个外显子(图3A)。同一分支成员的基因结构相似,各分支之间的基因结构存在一定差异,具体表现为内含子的大小和位置存在差异,这些差异可能会导致基因功能的差异。对PeNIPs编码的蛋白保守基序分析表明,毛竹PeNIPs序列中共有10个保守基序,其中Ⅰ分支6个成员除了PeNIP1-6之外,均含有基序1-7和9;Ⅱ分支4个成员所含保守基序一致,均包含除基序9以外的基序;基序1、2、4和5是Ⅲ分支中4个成员共有基序,而基序8是PeNIP3-1和PeNIP3-2所共有(图3B)。每个保守基序中氨基酸序列的偏好性在PeNIPs不同成员间存在着一定的差异,但大多数是比较保守的,尤其是含有跨膜区(TM1-TM6)和Loop-Half螺旋区(Loop B和Loop E)的保守基序(图3C)。同一个分支大多数成员具有相同的保守基序,说明这些成员可能存在相似的功能。

图3 PeNIPs基因结构及编码氨基酸保守基序分析
AQPs运输底物具有选择透过性,位于Loop B和Loop E处的高度保守的NPA(Asn-Pro-Ala)结构域对于孔道大小及水分亲疏性具有重要作用。序列比对结果表明,从PeNIPs氨基酸的N端到C端,除PeNIP3-3缺少ar/R选择性过滤器的TM4结构之外,其他各序列均含有高度保守的NPA结构域及ar/R选择性过滤器(TM1-TM6),另外除PeNIP3-1和PeNIP3-2的2个NPA结构域的第3个氨基酸分别被丝氨酸和天冬氨酸替代外,其他12个PeNIPs均具有2个典型的NPA结构域(图4)。在底物运输时,ar/R选择性过滤器同样也是重要的选择通过结构,除PeNIP1-4为W-V-E-R外,其他PeNIP1s均为W-V-A-R,PeNIP2s成员为G-S-G/A-R组合形式,而PeNIP3s成员为A-I/A-G-R形式。氨基酸Froger’s残基在底物运输过程同样发挥着重要作用,但毛竹PeNIPs的Froger’s残基保守性较低,具有多种组合形式。ar/R选择性过滤器和Froger’s残基的功能位点的多态性预示着PeNIPs在毛竹快速生长发育过程中发挥着不同的功能。

图4 NIPs序列比对分析
2.5 PeNIPs上游启动子顺式调控元件
了解启动子顺式作用元件是预测基因转录和表达调控的重要研究方法。对14个PeNIPs起始密码子上游2 000 bp序列中调控元件分析表明,其中包含多种与胁迫、激素应答相关的调控元件。非生物胁迫的顺式作用元件主要有响应低氧的ARE和GC-motif、低温的LTR、干旱的MBS以及逆境响应元件TC-rich repeats等;与生物胁迫相关的有真菌诱导响应元件W-box;与激素相关的应答元件包括生长素的AuxRR-core和TGA-element,茉莉酸甲酯的TGACG-motif,赤霉素的GARE-motif、P-box和TATC-box,水杨酸的TCA-element,以及脱落酸的ABRE等(图5A)。但各基因启动子中元件的种类以及数量均存在一定的差异(图5B)。由此说明,PeNIPs的转录将受到各种生物、非生物胁迫和激素的影响,而且所受影响的程度也将存在一定的差异。

图5 PeNIPs基因启动子顺式作用元件和应答元件分析
2.6 PeNIPs组织特异性表达
转录组表达谱数据是验证基因功能的有效途径之一。基于毛竹26个组织的转录组数据分析表明,14个PeNIPs在毛竹不同组织以及同一组织不同生长时期的表达模式不同,且各基因的表达丰度也存在着一定的差异(图6)。有4个基因(PeNIP2-1/2-2/3-1/3-2)在各个组织中均有表达,它们可能与毛竹整个生长发育过程密切相关,有3个基因(PeNIP1-6/3-3/3-4)则在26个组织中基本没有检测到表达;其他7个基因表现出组织表达特异性,如PeNIP1-1和PeNIP1-2主要在笋芽中表达,PeNIP1-3、PeNIP1-4和PeNIP1-5在根中的表达量高于其他组织,PeNIP2-3和PeNIP2-4在不同发育阶段根、笋和叶中均有表达,但在不同高度笋中的表达量多数表现为中部和基部高于上部。另外,多数在笋中表达的PeNIPs具有类似的变化趋势,即随着笋高度的增加基因的总的表达量也逐渐增加,且多为基部和中部表达高于上部,推测PeNIPs在毛竹快速生长过程的水分运输中发挥了重要作用。

图6 PeNIPs在26个组织中的表达分析
2.7 PeNIPs在逆境胁迫条件下的表达
启动子调控元件分析表明毛竹PeNIPs的表达可能会受到逆境胁迫影响,本研究采用qPCR技术主要检测了温度和干旱胁迫处理条件下PeNIPs在根中的表达情况。结果表明,随着处理时间的延长,14个PeNIPs在不同胁迫处理条件下呈现出一定的差异表达,其中低温处理下的8个基因(PeNIP1-3、PeNIP1-5、PeNIP1-6、PeNIP2-1、PeNIP2-2、PeNIP2-4、PeNIP3-1和PeNIP3-3)、高温处理下的2个基因(PeNIP1-1和PeNIP2-2)以及干旱处理下的3个基因(PeNIP1-1、PeNIP1-6和PeNIP2-1)均表现为不同程度的上调表达;而有2个基因(PeNIP3-3和PeNIP3-4)在4 ℃下以及有4个基因(PeNIP1-3、PeNIP2-1、PeNIP2-3和PeNIP2-4)在42 ℃下均表现为下调表达;其他基因则表现为波动变化,且多数基因在处理时间达到6 h和12 h时表达量较高(4 ℃处理下有3个基因,42 ℃处理下有5个基因以及干旱处理下有10个基因)(图7)。
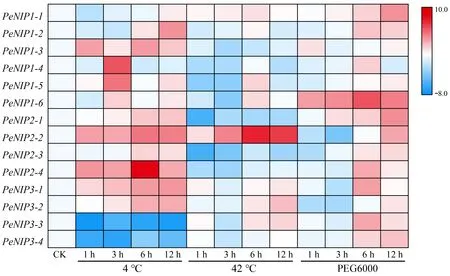
图7 温度和干旱胁迫条件下根中PeNIPs的表达分析
另外,上调表达的基因有3种变化趋势:1)在处理6 h时基因表达量达到最高,随后有所下降,如4 ℃处理下的PeNIP2-2和PeNIP2-4、42 ℃处理下的PeNIP1-1和PeNIP2-2及干旱处理下的PeNIP1-6;2)随处理时间的延长,基因表达量逐渐上升,如4 ℃处理下的PeNIP2-1、PeNIP3-1和PeNIP3-2,以及干旱处理下的PeNIP1-1和PeNIP2-1;3)基因表达量随处理时间延长而呈现出波动变化,如4 ℃处理下的PeNIP1-3、PeNIP1-5和PeNIP1-6。因此,推测PeNIPs在不同逆境胁迫中可能以不同的表达方式发挥其作用。
2.8 表达PeNIPs的酵母对胁迫的抗性
接种重组酵母(pYES2∷PeNIP1-1和pYES2∷PeNIP2-2)和对照酵母(pYES2)菌液在正常固体培养基上,诱导培养观察发现它们表现出相似的生长能力(图8),表明在酵母中表达PeNIP1-1和PeNIP2-2不影响酵母的正常生长。在添加不同浓度山梨醇和NaCl的固体培养基上,重组酵母和对照酵母的生长均受到一定的抑制。当山梨醇浓度为0.5 mol·L-1时,各稀释菌液的生长没有明显差异;但当山梨醇浓度为1.0 mol·L-1时,稀释为10-5的菌液中重组酵母菌落数量均明显多于对照;当浓度达到1.5 mol·L-1时,稀释为10-4的菌液中重组酵母菌落数量均明显多于对照(图8A)。另外,在添加了不同浓度NaCl的固体培养基上,重组酵母在含0.5和1.0 mol·L-1的NaCl培养基上均有所生长,而对照酵母仅在含0.5 mol·L-1的NaCl培养基上生长,当NaCl为1.5 mol·L-1时无酵母菌落生长;且在NaCl为0.5 mol·L-1时,稀释为10-4的菌液中重组酵母菌落数量多于对照,在NaCl为1.0 mol·L-1时,稀释为10-1的菌液中菌落数量多于对照(图8B)。由此表明,PeNIP1-1和PeNIP2-2的表达提高了转基因酵母的抗旱和抗盐能力。

图8 胁迫条件下PeNIP1-1和PeNIP2-2表达对酵母生长的影响
3 讨论
许多研究证实,水通道蛋白(AQPs)在提高植物对非生物胁迫的耐受性方面发挥着重要作用。膜内在水通道蛋白(NIPs)作为一类重要的AQPs,其在植物生长发育过程中的作用倍受关注。如HvNIP2;1(HvLsi1)在大麦中不但具有运输硅的活性(Chibaetal., 2009),而且还调节硼的吸收(Schnurbuschetal., 2010),从而影响其生长和产量;NIP1;2调节拟南芥对铝的吸收、转运和耐受能力(Wangetal., 2017)。继玉米和水稻之后,已在多种单子叶植物如谷子(Setariaitalica)、柳枝稷(Panicumvirgatum)、高粱、菠萝(Ananascomosus)中先后鉴定出12、23、11和7个NIP成员(Azadetal., 2009; Reddyetal., 2015; Bezerra-Netoetal., 2019),进一步试验证明,NIPs除运输水外还具有甘油转运功能(Kaldenhoffetal., 2006; Gomesetal., 2009)。本研究从毛竹中鉴定出14个NIP成员,是已知单子叶植物中相对较多的。研究表明,在进化过程中多倍体化是植物适应环境和新物种形成的重要机制(Husbandetal., 1998),单个基因片段、染色体和基因组复制是植物进化的主要动力(Patersonetal., 2012)。毛竹在进化过程中经历了全基因组复制事件和多数基因簇的分化(Pengetal., 2013),是导致其NIP基因数量增加的主要原因,毛竹和水稻NIP基因之间共线性分析结果支持了这一观点。然而,基因对的Ka/Ks均小于1,推测PeNIPs在进化过程中受到了纯化选择,基因片段的复制维持了其原有功能,而没有形成新的功能。
真核生物基因的表达受多层次调控,转录因子与靶基因启动子结合位点的相互作用是真核生物基因表达调控的重要机制之一。启动子决定基因的活动,但其本身并不控制基因活动,而是通过与转录因子的结合而控制基因的活动。在PeNIPs上游启动子序列中存在多种激素与逆境胁迫相关的顺式作用元件和应答元件,这些元件已被证明赋予了植物快速反应和调节相关基因表达的能力,从而提高对逆境的适应性(Wuetal., 2019),如维持细胞壁、抵御外界伤害(Creelmanetal., 1992)、调控细胞壁性质(Wolfetal., 2012; Majdaetal., 2018)以及果实生长与成熟(Villarrealetal., 2016)等,推测它们在毛竹中可能发挥着类似的作用。基因表达模式是基因功能的重要体现,转录组表达谱表明PeNIPs在各组织中发挥着不同的作用。结合定量表达结果分析发现,一些在毛竹各生长阶段表达量低或不表达的基因(如PeNIP1-1、PeNIP1-6、PeNIP3-3和PeNIP3-4),在逆境胁迫条件下却均有所表达,故推测这些PeNIPs也可能参与逆境胁迫响应并发挥着重要作用(Zhuetal., 2019)。另外,不同逆境胁迫下同一基因表达模式的差异,进一步说明PeNIPs功能的多样性,而其在竹子生长过程以及胁迫中的作用机制仍需进一步研究。

4 结论
本研究在毛竹中共鉴定出14个PeNIPs基因,其编码的蛋白均具有完整的保守结构域,为疏水蛋白。在PeNIPs启动子区域中含有多种与胁迫、激素相关的顺式作用元件和应答元件,在逆境胁迫条件下PeNIPs的表达变化证实它们参与了温度、干旱胁迫的应答。表达PeNIP1-1和PeNIP2-2的酵母在干旱和高盐胁迫下的生长优于对照,表明它们具有一定的提高抗旱和抗盐能力的功能。本研究将为进一步开展毛竹基因工程研究提供候选基因资源,对培育毛竹抗逆新品种具有重要参考价值。
