低温胁迫对耐低温和非耐低温品系大黄鱼MT、AQP1、TCP1基因表达的影响
2021-03-13李伟业罗海忠殷小龙张川柳敏海章霞邱豪军毛志增油九菊徐志进
李伟业,罗海忠,殷小龙,张川,柳敏海,章霞,邱豪军,毛志增,油九菊,徐志进*
(1.浙江省舟山市水产研究所,浙江 舟山 316000;2.舟山市海洋与渔业局,浙江 舟山 316000;3.浙江万里学院,浙江 宁波 315100)
大黄鱼Larimichthyscrocea为暖水性鱼类,主要分布于黄海南部、东海,以及琼州海峡以东的南海北部沿岸,是中国重要的经济鱼类之一。大黄鱼的水温适应范围为10~32 ℃,最适温度为18~25 ℃,低于14 ℃和高于30 ℃摄食下降,低于7 ℃时大黄鱼死亡[1]。近年来,由于生态环境的破坏,极端天气频繁发生,中国南方沿海地区也常受寒流侵袭,致使养殖海区水温长期偏低,对于不耐低温的大黄鱼造成了严重的损害。据报道,2016年南方渔业因寒潮造成经济损失超过20亿元,仅大黄鱼损失就超过3亿元[2]。因此,开展低温对大黄鱼影响的研究,对开发抗寒大黄鱼新品种、促进大黄鱼产业可持续发展具有重要意义。
目前,有关低温对大黄鱼影响的研究较多,但多集中于生长特性、生理生化指标等方面,而对大黄鱼耐寒分子机制研究较少。金属硫蛋白(Metallothionein, MT)是由微生物和动植物产生的金属结合蛋白,是一类可被多种因素诱导的内源性蛋白,在水生动物体内各生长发育阶段发挥着重要作用,具有较强的清除自由基能力[3]。水通道蛋白(Aquaporin,AQP),又名水孔蛋白,是一种位于细胞膜上的蛋白质(内在膜蛋白),不仅在水分子的快速跨膜转运中起主要作用,还具有阳离子通道的作用,同时有助于CO2和NH3的交换运输[4]。目前,已发现的水通道蛋白有200多种亚型, 其中对AQP1的研究最为广泛和深入[5]。AQP1是由Agre等从红细胞膜分离纯化Rh血型多肽时偶然发现的,相对分子质量为 28 000。它不仅可以调节渗透压, 还与小分子气体交换和运输等有关, 也与某些疾病有着重要的相关性[6]。热休克蛋白(Heat shock protein,HSPs),是一组在生物进化过程中高度保守的蛋白分子,HSP60 家族是HSP家族中重要的成员之一,可以有效保护机体细胞免受逆境胁迫[7]。TCP1 (t-com-plex polypeptide-1)属于HSP60家族Ⅱ类亚族,是一种广泛存在于细胞浆中的异型寡聚蛋白,对提高细胞耐受应激能力、维持细胞内环境的稳定具有重要作用[8]。
研究发现,MT、AQP1、TCP1 3个基因与鱼类的抗寒性能相关[3-8]。为此,本研究中选取了上述基因,并比较分析了耐低温品系与非耐低温品系大黄鱼中3个基因在低温条件下的表达特点,以验证3个候选基因与大黄鱼耐寒能力的相关性,旨在从分子层面阐释大黄鱼在低温胁迫下基因调控的相关机理,以期为今后研究大黄鱼的耐寒分子机制和抗寒育种提供科学参考。
1 材料与方法
1.1 材料
试验用鱼取自浙江省舟山市水产研究所繁育的F5代耐低温品系大黄鱼和非耐低温品系大黄鱼幼鱼,耐低温品系大黄鱼体质量为(55.35±3.52)g,体长为(14.72±0.25)cm,非耐低温大黄鱼体质量为(56.45±4.41)g,体长为(14.91±0.32)cm。将试验鱼置于圆形玻璃钢桶(直径为200 cm、高为100 cm)内,纳米气管增氧,于每天9:00、16:00各投喂一次配合饲料(天邦大黄鱼配合饲料3号料),并于投喂后1 h吸污,日换水率100%。试验用水为过滤后的自然海水。
1.2 方法
1.2.1 低温胁迫对比试验 试验设2个组,分别为耐低温品系大黄鱼组(N组)和非耐低温品系大黄鱼组(F组),每个组设2个平行。每个试验桶各放入50尾大黄鱼幼鱼。试验桶水温为16 ℃(自然温度)。试验前,将试验鱼移至试验桶中,暂养7 d,待试验鱼的状态稳定后开始正式试验。试验起始温度为16 ℃,按照1 ℃/d的速率降温,分别在16、13、10、7 ℃时取样,并观察试验鱼的行为状态。在各温度下随机抽取3尾鱼,取其肝脏、肌肉,并于液氮中速冻后置于-80 ℃超低温冰箱中保存备用。
1.2.2 荧光定量PCR 采用天根生化科技(北京)有限公司试剂盒提取总RNA,经琼脂糖电泳检测RNA 的完整性,用RNA作为模板,以Oligo dT18作为引物合成第一链cDNA。根据GenBank数据库中MT、AQP1、TCP1基因序列,使用Primer 5.0软件设计3对特异性引物(表1),用于荧光定量分析(qPCR),选取β-actin作为内参基因[9]。扩增反应在ABI 7300plus荧光定量扩增仪上进行,荧光定量检测采用SYBR定量检测试剂盒(TaKaRa)。反应体系(共20 μL)包括:SYBR Premix Ex TaqⅡ10 μL,上、下游引物各0.8 μL,Rox Reference Dye 0.4 μL,cDNA模板2 μL, ddH2O 6 μL。反应程序为:95 ℃下预变性30 s; 95 ℃下变性 5 s,60 ℃ 下退火31 s, 共进行40个循环;最后在72 ℃下延伸10 min。溶解反应:95 ℃ 下反应15 s,60 ℃ 下反应60 s (数据采集),95 ℃ 下反应15 s。采用2-ΔΔCT法计算基因的相对表达量。
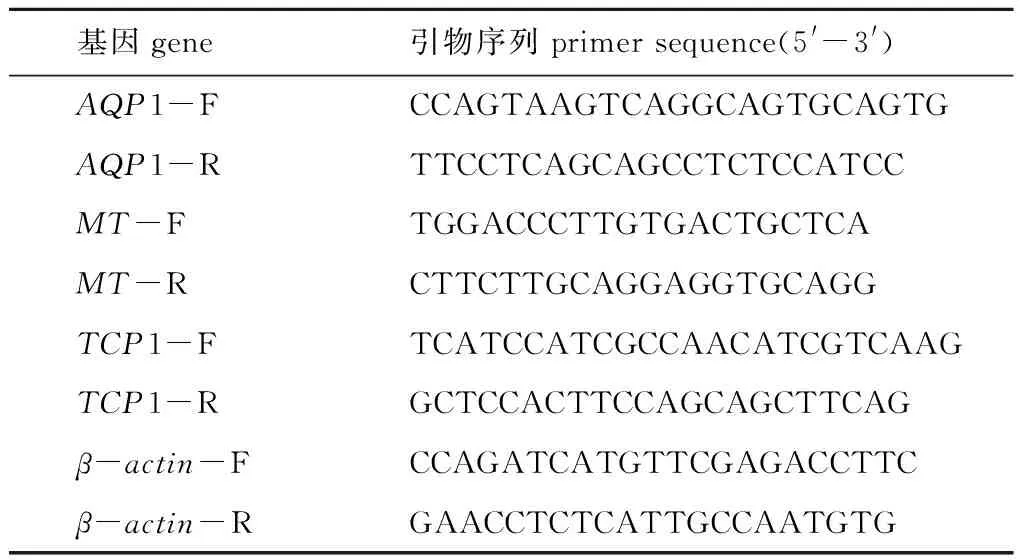
表1 大黄鱼基因定量分析所用引物
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)表示,采用SPSS 19.0软件对数据进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 不同温度下耐低温和非耐低温品系大黄鱼的行为状态
从表2可见:N组大黄鱼和F组大黄鱼在16、13、10 ℃下,行为状态较为相似;在7 ℃下,N组大黄鱼和F组大黄鱼的行为状态出现差异,N组大黄鱼尽管活力一般,也不摄食,但未出现翻肚侧游的现象,在水体各层分布较均匀,而F组大黄鱼活力不佳,部分出现翻肚侧游的现象,且多分布于水体的中上层。

表2 不同温度下耐低温和非耐低温品系大黄鱼的行为状态
2.2 不同温度下耐低温和非耐低温品系大黄鱼肝脏和肌肉中MT基因表达量的变化
从图1可见:随着温度的降低,N、F组大黄鱼肝脏和肌肉中MT基因表达量均呈上升趋势,且各试验组均有显著性差异(16 ℃时除外)(P<0.05);在7 ℃时,大黄鱼肝脏和肌肉中MT基因表达量均达到最高,N组、F组大黄鱼肝脏中的表达量分别为16 ℃时的10.8倍和22.3倍,N组、F组大黄鱼肌肉中的表达量分别为16 ℃时的9.8倍和18.3倍,且F组大黄鱼表达量也显著高于N组(P<0.05)。
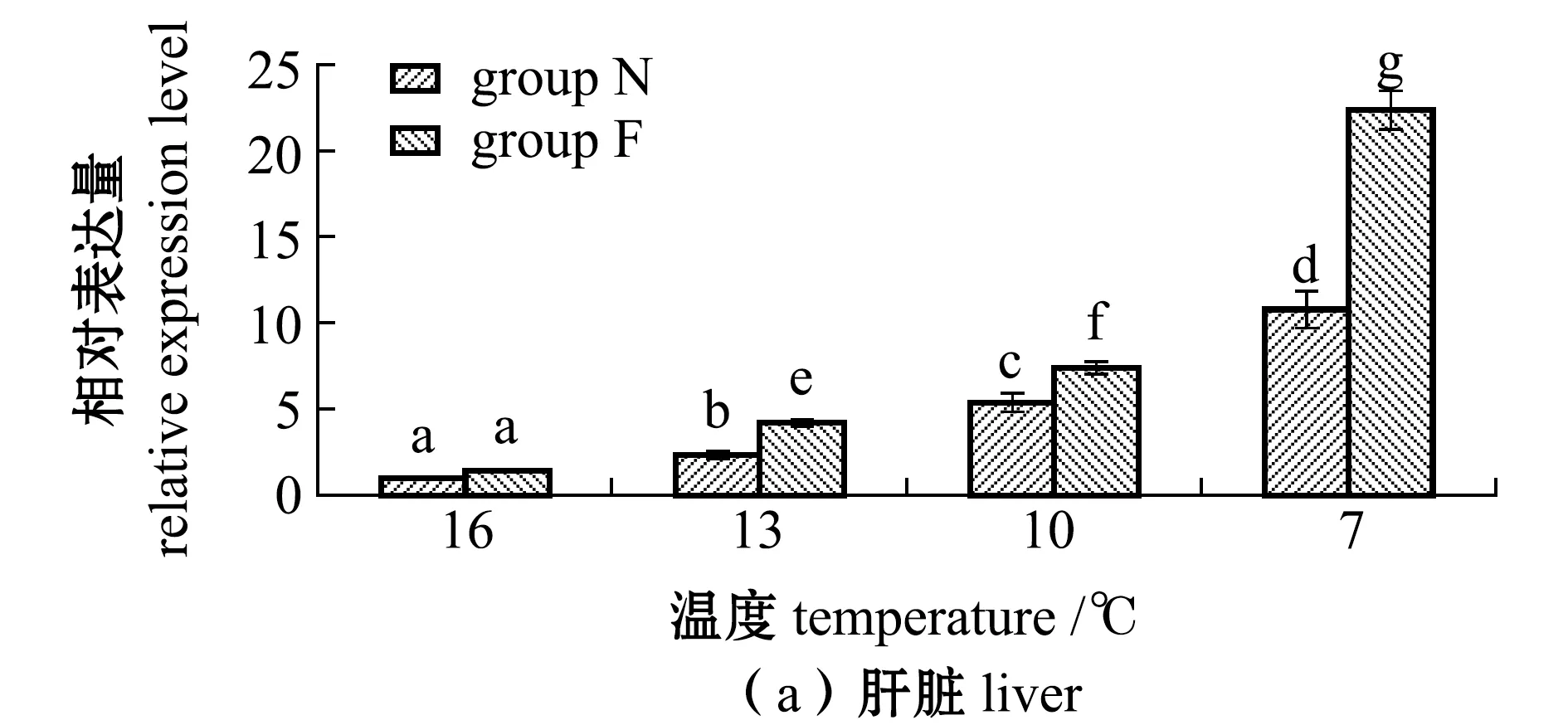

标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.图1 不同温度下耐低温和非耐低温品系大黄鱼肝脏和肌肉中MT基因相对表达量的变化Fig.1 Relative expression levels of MT gene in liver and muscle of large yellow croaker Larimichthys crocea exposed to different temperature
2.3 不同温度下耐低温和非耐低温品系大黄鱼肝脏和肌肉中AQP1基因表达量的变化
从图2(a)可见:N、F组大黄鱼肝脏中AQP1表达量均随温度的降低呈先升高后降低的趋势,且各试验组间均有显著性差异(P<0.05),F组表达量均显著高于N组(P<0.05);在13 ℃时N组、F组大黄鱼的表达量均达到最高,上调幅度分别为16 ℃时的1.73倍和1.82倍;当温度降到10 ℃时,各试验组大黄鱼肝脏中的AQP1表达量显著下降;在7 ℃时N组、F组大黄鱼表达量达到最低,分别为16 ℃时的0.23%和0.39%。
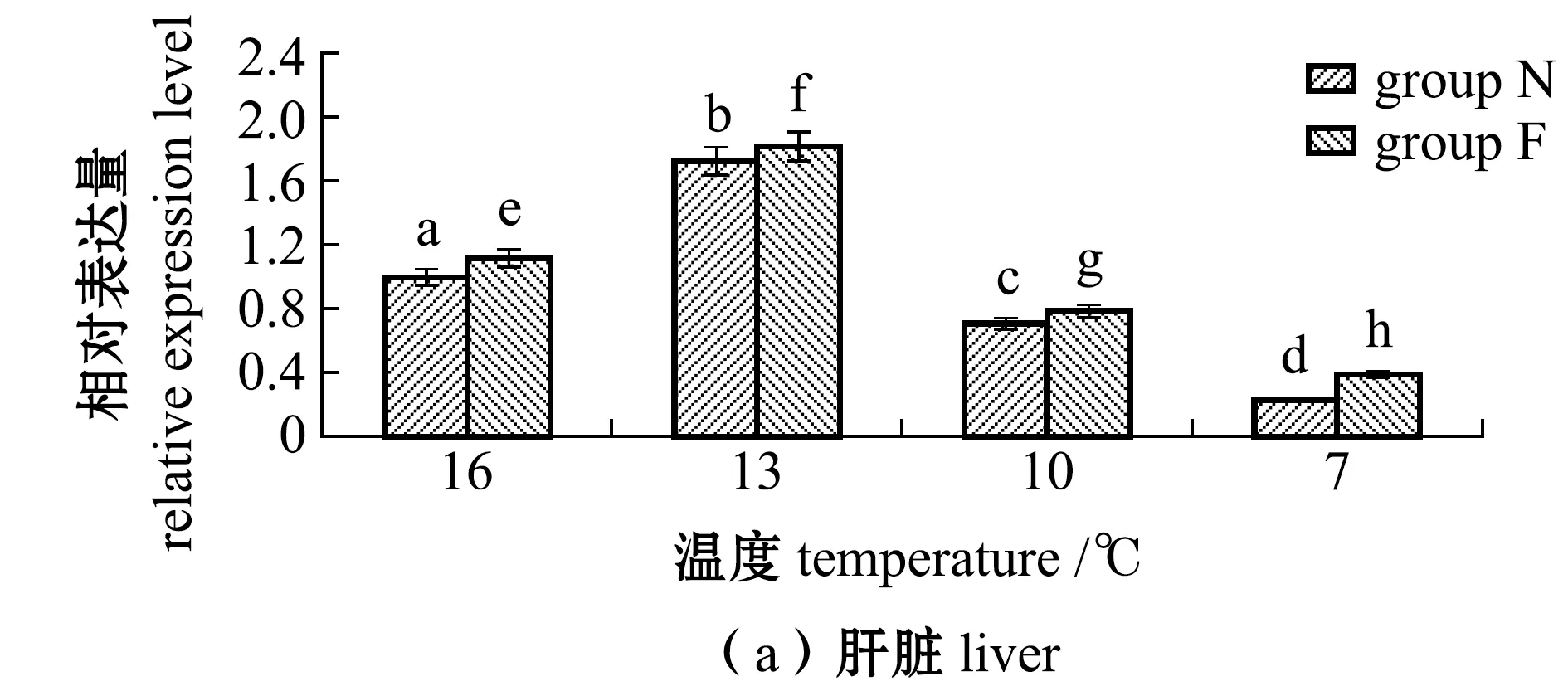
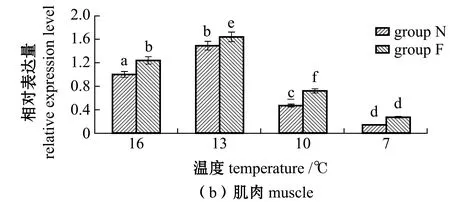
图2 不同温度下耐低温和非耐低温品系大黄鱼肝脏和肌肉中AQP1基因相对表达量的变化Fig.2 Relative expression levels of AQP1 gene in liver and muscle of large yellow croaker Larimichthys crocea exposed to different temperature
从图2(b)可见:N、F组大黄鱼肌肉中AQP1表达量也均随着温度的降低呈先升高后降低的趋势;在13 ℃时N组、F组大黄鱼的表达量均达到最高,上调幅度分别为16 ℃时的1.49倍和1.64倍,且F组表达量显著高于N组(P<0.05);当温度降到10 ℃时,各试验组大黄鱼肌肉中的AQP1表达量显著下降;在7 ℃时N组、F组大黄鱼表达量达到最低,分别为16 ℃时的0.14%和0.26%,但N组和F组表达量间无显著性差异(P>0.05)。
2.4 不同温度下耐低温和非耐低温品系大黄鱼肝脏和肌肉中TCP1基因表达量的变化
从图3可见:随着温度的降低,N、F组大黄鱼肝脏和肌肉中TCP1基因表达量均呈上升趋势,且各试验组间有显著性差异(16 ℃时除外)(P<0.05);在7 ℃时,肝脏和肌肉中表达量均达到最高,N组、F组大黄鱼肝脏中TCP1基因表达量分别为16 ℃时的28.3倍和19.3倍,N组、F组大黄鱼肌肉中TCP1基因表达量分别为16 ℃时的9.3倍和6.3倍,且N组表达量显著高于F组(P<0.05)。
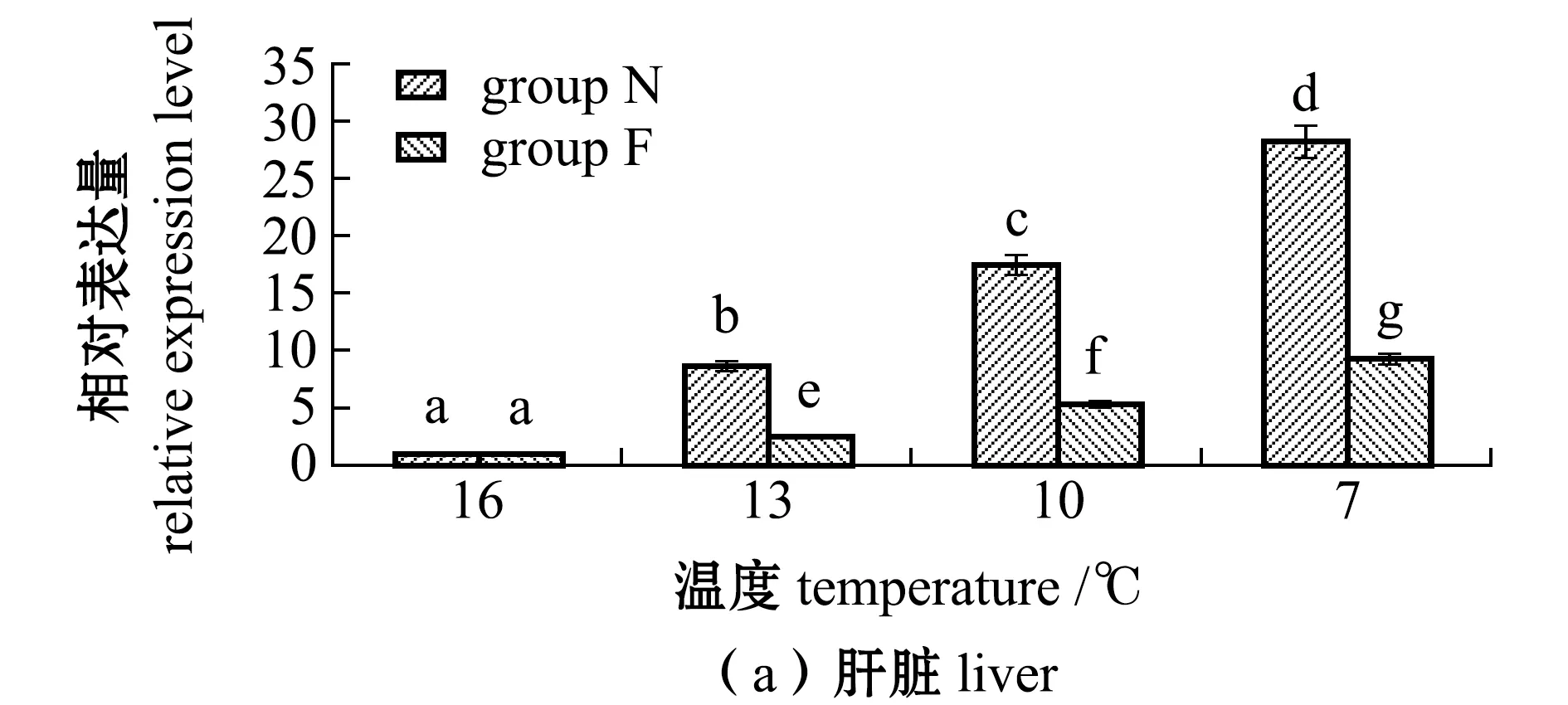

图3 不同温度下耐低温和非耐低温品系大黄鱼肝脏和肌肉中TCP1基因相对表达量的变化Fig.3 Relative expression levels of TCP1 gene in liver and muscle of large yellow croaker Larimichthys crocea exposed to different temperature
3 讨论
3.1 低温胁迫对耐低温和非耐低温品系大黄鱼MT基因表达的影响
MT为一类可被多种因素诱导的内源性蛋白,在水生动物体内各生长发育阶段均发挥着重要作用,具有较强的清除自由基能力,其清除羟基自由基的能力是SOD的1万倍,清除氧自由基的能力是GSH的25倍。众多研究表明,MT的合成与温度有明显的温度效应关系。Oh等[10]研究发现,冷、热应激和耐力锻炼等均可引起大鼠肝脏MT含量升高;Baer等[11]也发现,MT含量与小鼠对寒冷的耐受性呈正相关(r=0.78)。另有研究认为,MT可能在冷应激中起到稳定细胞膜、保护细胞器的重要作用[12-14]。
本研究中发现,随着温度降低,大黄鱼肝脏和肌肉中MT基因表达量均呈显著上升,且非耐低温品系大黄鱼的表达量显著高于耐低温品系,这表明低温胁迫会促进MT基因的表达,这与Sardella等[15]的研究结果相似。此外,这或许从侧面反映了耐低温品系大黄鱼比非耐低温品系大黄鱼具有更强的低温适应能力。
3.2 低温胁迫对耐低温和非耐低温品系大黄鱼AQP1基因表达的影响
AQP基因不仅在水分子的快速跨膜转运中起到主要作用,还具有阳离子通道的作用,同时有助于CO2和NH3的交换运输,它属于水选择性跨膜通道[16]。研究表明,AQP1基因与动物机体的抗寒能力关系密切,在树蛙Hylachrysoscelis和面包酵母Saccharomycescerevisiae研究中均发现,AQP1 基因与这些物种的抗寒性能相关[17-18]。此外,朱华平等[19]研究表明,AQP1基因表达量与温度显著相关,且随着温度的降低,AQP1基因的表达量逐渐下调。本研究中发现,AQP1基因表达量与温度也具有显著的相关性,温度降至10 ℃后,耐低温品系和非低温品系大黄鱼肝脏和肌肉的AQP1基因表达均显著下调,在7 ℃时表达量最低,且耐低温品系大黄鱼肝脏和肌肉的AQP1表达量均低于非耐低温品系。结合耐低温品系和非耐低温品系大黄鱼在7 ℃下的行为状态(耐低温品系大黄鱼缓慢游动,非耐寒品系大黄鱼部分侧游),笔者认为,耐低温品系大黄鱼具有更强的耐低温能力,这也可能与其AQP1表达量下调幅度更大有关,这也与朱华平等[16]的研究结果相似。其机制可能是大黄鱼机体为适应低温条件,AQP1 基因表达量大幅下调,降低细胞膜上AQP1 的含量或活性,减少水分子的跨膜运输,使细胞内环境保持相对稳定,降低外界低温对细胞的损害。
3.3 低温胁迫对耐低温和非耐低温品系大黄鱼TCP1基因表达的影响
TCP1伴侣蛋白是一大类在生物大分子折叠、组装及降解过程中起重要协同作用且与细胞应激损伤关系密切的蛋白。对提高细胞耐受应激的能力、维持细胞内环境的稳定具有重要作用[8,20]。众多研究表明,TCP1与生物体抗寒能力相关,如酵母SaccharomycescerevisiaeTCP-1-alpha 和TCP-1-beta 的低温诱导表达模式显示,TCP-1是一种冷激表达蛋白[21],肉蝇Sarcophagacrassipalpis滞育期的低温存活能力与热休克蛋白如TCP-1、HSP70家族等的上调表达关系密切[22];葱蝇Deliaantique幼虫耐寒能力增强也与其TCP-1的上调表达密切相关[23]。在水生生物中也有研究表明,TCP基因与抗寒密切相关,如殷勤等[24]在低温胁迫试验中证实,TCP基因与凡纳滨对虾耐寒性状存在相关性,不同基因型的个体在耐寒能力上具有差异;谢建丽等[25]对尼罗罗非鱼的研究中发现,随着低温胁迫程度的加强,TCP基因表达上调幅度增大,这表明TCP-1-beta和TCP-1-eta是潜在的耐寒相关基因。本研究中发现,TCP1基因表达量与温度也具有显著的相关性,随着温度的降低,各试验组大黄鱼肝脏和肌肉中的TCP1基因表达量均显著上调,在温度降至7 ℃后,TCP1基因表达量上调幅度最大。此外,耐低温品系大黄鱼肝脏和肌肉中的TCP1表达量均显著高于非耐低温品系。本研究结果与谢建丽等[25]的研究结果相似,这表明TCP1与大黄鱼的抗寒能力密切相关,同时,耐低温品系大黄鱼的TCP1表达量显著高于非耐低温品系,这也从侧面反映了耐低温品系大黄鱼比非耐低温品系具有更强的抗寒能力。
4 结论
1)2个品系的大黄鱼MT、AQP1、TCP1 3个基因在低温下表现出显著差异性,表明这3个基因与大黄鱼抗寒能力具有一定的相关性。
2)耐低温品系大黄鱼在低温下存活率和活力要优于非耐低温品系,结合MT、AQP1、TCP1 3个与抗寒相关的基因的表达差异,证明两者在低温适应能力和抗寒能力上存在一定区别。
3)在大黄鱼耐低温品系的筛选过程中,寻找出抗寒相关因子及其基因,获得抗寒相关基因的分子标记,是低温选育耐低温品系的重要手段。而找到与性状显著相关的SNP位点是进行分子标记辅助育种的前提和基础,因此,今后应重点进行抗寒基因编码序列SNP位点的筛查。
