高锰酸钾胁迫及毒后恢复对锦鲤肝脏组织的影响
2021-03-11伍广涛蒲红宇张蓉王晓雯朱华
伍广涛 蒲红宇 张蓉 王晓雯 朱华


摘 要:为了解高锰酸钾消毒对锦鲤幼鱼毒性毒理的影响,采用静水生物测试法研究高锰酸钾(KMnO4)对锦鲤幼鱼的急性毒性并进行安全评价。以(16.36± 0.01)g锦鲤幼鱼为试验对象,设定0.5、1、2 mg·L-1和3 mg·L-1 4个KMnO4浓度梯度进行48 h急性暴露试验,统计累计死亡率,将剩余幼鱼进行48 h恢复试验。在胁迫0、24 h、48 h和恢复24 h、48 h等5个时间段取样,以肝脏组织超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷草转氨酶(GOT)活性以及谷胱甘肽(GSH)和丙二醛(MDA)含量为指标,研究KMnO4对锦鲤幼鱼的毒理作用。结果表明:2 mg·L-1以上的高锰酸钾溶液浸泡24 h能使锦鲤幼鱼致死,SOD、CAT、GOT受到抑制。在解除胁迫后基本能恢复到正常水平。而GHS和MDA含量在胁迫过程中是呈升高趋势的,但在解除胁迫后均下降到与对照组相似水平。研究结果表明KMnO4会造成锦鲤肝脏的损伤,且损伤程度随着浓度和时间的增加而加重,但是解除胁迫后,SOD、CAT、GOT和GSH、MDA等均能达到不同程度的恢复。使用溶液浓度为1 mg·L-1的高锰酸钾对锦鲤幼鱼消毒最为合适。
关键词:高锰酸钾;急性胁迫;肝脏;抗氧化;锦鲤;SOD
鲤鱼(Cyprinus carpio)是中国主要的淡水养殖品种之一[1]。锦鲤是鲤鱼的亚种,是经过人工选育而成的名贵观赏鱼类,在个人娱乐和竞技表演中作为宠物鱼来养殖[2]。随着养殖规模的扩大,养殖期间病害频发,所以广泛使用高锰酸钾等药物消毒,但对于其作用机制研究较少。到目前为止,对锦鲤的急性毒性研究主要在于对不同药物对其存活率的影响,但对于高锰酸钾消毒后对锦鲤肝脏的损伤以及相关指标的变化未见报道。
高锰酸钾(KMnO4)是一直被用作治疗和防御鱼类疾病的绿色化学药物,通过其具有的强氧化性,达到杀死细菌、真菌以及寄生虫的效果。其杀菌力随浓度升高而增强,0.1%时可杀死多数细菌的繁殖体,2%~5%溶液能在24小时内杀死细菌[3],但使用过量,则会对鱼的鳃及肝脏等组织产生不利的影响,可造成组织的氧化损伤。KMnO4还原生成的二氧化锰与蛋白质结合形成的蛋白盐复合物具有刺激和腐蚀作用[4]。生产上推荐的泼洒浓度为1~2 mg·L-1。但由于鱼的品种以及大小规格的不同,导致使用高錳酸钾消毒的剂量也相差较大。目前国内外有许多关于高锰酸钾胁迫对水生动物影响的报道。Straus[5]报道在经济鱼和观赏鱼养殖中,高锰酸钾通常是直接加入养殖水体中或通过药浴的方式处理鱼体上的原生动物和寄生虫。另外如鲈鲤(Percocypris pingi)[6]、草鱼(Ctenopharyngodon idella)[7]、中国花鲈(Lateolabrax japonicus)[8]、红耳彩龟(Trachemys scripta elegans)[9]、血鹦鹉(Amphilophus citrinellus)[10]、斑点叉尾鮰(Ietalurus Punetaus)[11]等,然而现有研究对高锰酸钾对锦鲤胁迫的影响主要集中在安全浓度以及死亡率上[12],对于肝脏组织酶活性的变化以及胁迫后的恢复能力研究还鲜有报道。本研究通过试验确定高锰酸钾对锦鲤幼鱼的半致死浓度,并在高锰酸钾急性胁迫下测定不同处理时间段锦鲤肝脏组织酶活性的变化以及胁迫后恢复情况。探讨高锰酸钾胁迫对锦鲤幼鱼的毒性作用机制,旨在为锦鲤及其他观赏鱼养殖中高锰酸钾胁迫的应激反应评估提供科学依据。
1 材料与方法
1.1 试验用鱼
试验鱼由北京市水产科学研究所水族实验室提供,鱼体质量为(16.36±0.01)g,体长(10.5±0.2)cm,试验前 1 d 停食,试验时选取体质健壮、反应灵敏、个体大小基本一致的幼鱼进行试验。试验期间不喂食。
1.2 试验药物及试验条件
试验药物:高锰酸钾(分析纯)购自拜耳农药生物公司。
试验用水为曝气 2 d以上的自来水,pH 值7.4,溶氧5.6 mg·L-1、水温(20.7±0.1)℃。试验容器为40 L的塑料桶。
1.3 试验方法
通过预试验的结果,分别设定4个高锰酸钾浓度梯度组(0.5、1、2 mg·L-1和3 mg·L-1),和一个空白对照组,试验均在室内进行。先将高锰酸钾溶于纯水,配制成母液,再按比例稀释成所需的质量浓度,药液现配现用。每个塑料桶装有10 L各梯度的高锰酸钾溶液,同时分别放入10尾幼鱼,试验过程中不更换药液。前8个小时观察试验鱼的行为变化。记录鱼的死亡时间以及死亡数,及时捞出死亡个体。试验开始前,先将一尾幼鱼解剖取其肝脏组织进行保存,并在急性胁迫12 h、48 h以及将剩余个体放入清水恢复24 h、48 h四个时间段,每组随机取一尾幼鱼快速进行解剖,取出肝脏组织,放入5 mL塑料离心管中,先放置于液氮罐中保存,待取样完毕后放到-80 ℃冰箱进行保存。
1.4 样品测定
应用羟胺法测定SOD活力;采用钼酸铵法测定CAT活力;比色法测定GSH和GOT活性;采用TBA法测定MDA含量变化情况。
1.5 数据处理
试验数据用统计学方法SPSS19.0进行处理,所给结果均为平均数±标准误差(MEAN±SD);用单因素方差方法分析,组间数据的两两比较采用LSD法,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 锦鲤中毒症状
锦鲤在不同质量浓度的高锰酸钾溶液中呈现明显的中毒症状。在高浓度组,其应激反应强烈,游动迅速,不断乱窜。在6小时,出现侧游、运动减慢的锦鲤。由表1可知,在6~24 h期间,低浓度组没有出现死亡,2 mg·L-1组死亡率为40%,3 mg·L-1组死亡率为50%。但随着时间的延长,并不再出现死亡情况。
2.2 对锦鲤肝脏SOD活性的影响
由表2可以看出,锦鲤在经过高锰酸钾处理24 h后,各浓度组肝脏的SOD活性与对照组相比均显著下降,差异极显著(P<0.01)。到48 h,2 mg·L-1组与对照组差异显著(P<0.05),3 mg·L-1组与对照组差异极显著(P<0.01),并且达到最低点。解除胁迫后24 h,各处理组的SOD活性均开始回升,2 mg·L-1组已基本恢复到与对照组差不多水平。但是解除胁迫后48 h,3 mg·L-1组SOD的活性仍与对照组存在极显著差异(P<001)。
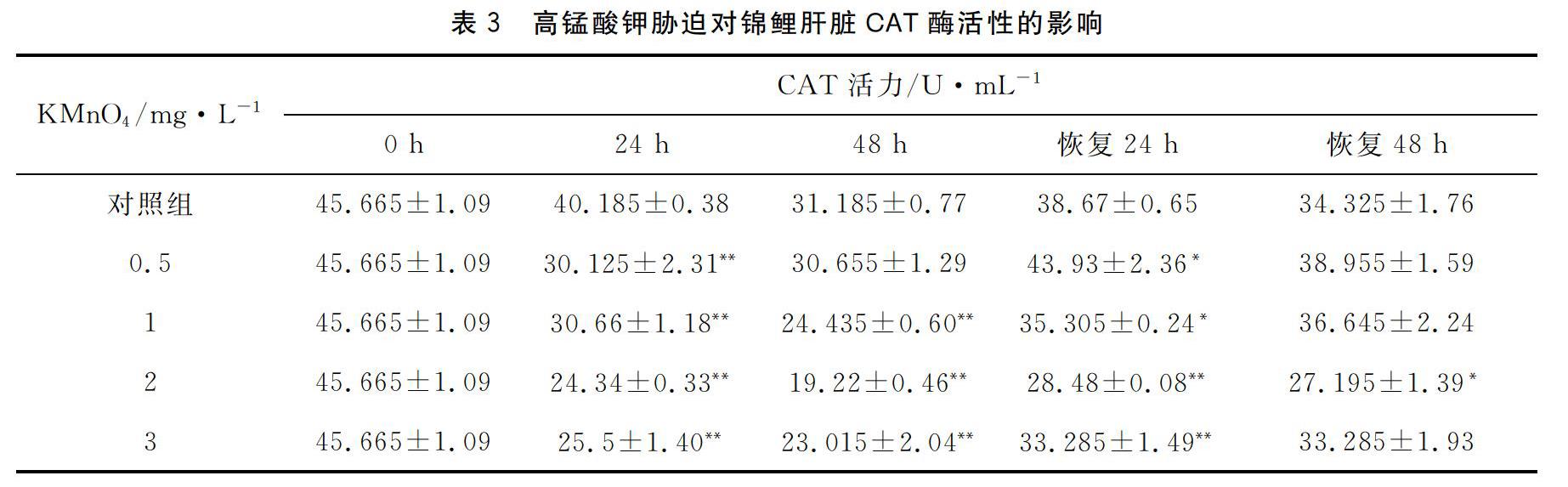
从表3可知,随着高錳酸钾浓度的增加,24 h锦鲤肝脏CAT活性被抑制,其中随着处理浓度的升高,CAT活性被抑制得更加明显。各处理组内CAT活性极显著低于对照组(P<0.01),48 h各个组的CAT活性均达到最低值,除了0.5 mg·L-1组与对照组无显著差异外,其他处理组均极显著低于对照组(P<0.01),解除胁迫24 h各组CAT活性逐渐回升。但均与对照组存在显著性差异,恢复48 h后,仅有2 mg·L-1组与对照组存在显著性差异(P<0.05),其余处理组CAT活性基本恢复到正常水平。
通过分析表4可知,随着高锰酸钾浓度的增加,锦鲤肝脏GOT酶活性诱导增强。24 h和48 h各处理组的GOT活性升高,其中1 mg·L-1和2 mg·L-1组显著高于对照组(P<0.05),3 mg·L-1组极显著高于对照组(P<0.01)。并且在胁迫48 h后,GOT活性达到最高值。在解除胁迫48 h,GOT活性逐渐下降,低浓度组基本恢复到对照组水平,2 mg·L-1和3 mg·L-1组仍极显著高于对照组(P<0.01)。
从表5可以看出,锦鲤在经高锰酸钾处理24 h到48 h后,锦鲤幼鱼肝脏GSH含量升高,2 mg·L-1组在胁迫24 h后,极显著高于对照组(P<0.01),胁迫48 h后,显著高于对照组(P<0.05),解除胁迫48 h后基本恢复到与对照组相似水平。
通过分析表6可知,高锰酸钾处理急性胁迫以及解除胁迫后,锦鲤幼鱼肝脏MDA含量呈先升高后降低的趋势。高锰酸钾处理24 h后,各处理组MDA含量升高,并均极显著高于对照组(P<001)。48 h MDA含量达到最高值,3 mg·L-1处理组的MDA含量达到(11.225±0.09)nmol·mL-1。解除胁迫24 h和48 h后MDA含量均有所下降,但仍均显著高于对照组(P<001)。
3 讨论
3.1 锦鲤幼鱼中毒症状
锦鲤幼鱼KMnO4中毒后, 在水中上下乱窜,表现得急促不安,呼吸频率加快。将死亡个体捞出,观察到鱼的体表和鳃丝上充满黏液。表明KMnO4可能损伤了锦鲤幼鱼的鳃导致鱼体缺氧,神经系统受损。这与周礼敬等[13]和张月琴等[14]观察到的鱼类急性高锰酸钾中毒症状相似。在急性胁迫结束后,将存活锦鲤幼鱼移入清水中继续暂养48 h,并没有出现继续死亡现象,表明锦鲤幼鱼具有一定的生理调节机能。
3.2 KMnO4对锦鲤幼鱼抗氧化酶活性的影响
SOD-CAT作为鱼类抗氧化损伤的第一道防线,它们在维持自由基平衡和减少氧化损伤方面发挥着重要作用[15]。本次研究中,在胁迫2 d时对照组的SOD与CAT也是呈先下降趋势,只是下降趋势没有试验组明显,说明低氧胁迫对锦鲤抗氧化系统有一定影响。在斑马鱼[16]的研究中有过SOD和CAT下降的现象。可能是该鱼肝脏产生过多的ROS,反过来抑制了SOD、CAT活性。先天免疫系统是脊椎动物抵御压力的第一道防线,但也是无脊椎动物唯一的防线[17]。由于缺乏特定的免疫系统,酶(如CAT和SOD)在无脊椎动物的免疫中起着至关重要的作用[18]。超氧化物歧化酶和过氧化氢酶是关键的内源性抗氧化酶,它们反过来参与超氧化物自由基的水解:SOD将超氧化物转化为过氧化氢,然后过氧化氢被过氧化氢酶水解为水和氧气[19]。GSH则在参与清除H2O2过程中也起到重要的作用。一些研究表明,当生物体受到轻度逆境胁迫时,SOD活性往往升高,这其实是一种应激反应,通过产生大量SOD来清除体内超氧离子自由基,使机体达到一种新的动态平衡现象,这一现象也被称为“毒物兴奋效应”;而当受到重度环境胁迫时,SOD活性通常降低,使生物体内积累过量的活性氧,从而导致生物体的伤害[20]。本次试验中,锦鲤幼鱼受到高锰酸钾胁迫后体内肝脏组织的SOD和CAT的活性被极显著的抑制,说明高锰酸钾并没有使锦鲤幼鱼产生“毒物兴奋效应”,而是鱼体内的活性氧超过了SOD的耐性阈值,细胞受到了严重伤害,导致其应激的能力下降,因此SOD活性也不可避免地降低。因此,KMnO4胁迫下SOD与CAT活性的降低,造成锦鲤幼鱼的活性氧伤害很可能是KMnO4对锦鲤幼鱼形成毒害的重要原因之一。但是通过放入清水中解除胁迫48 h后,SOD和CAT的活性均能恢复到与对照组相似水平,说明锦鲤具有一定的自我调节功能。
本次研究中,GSH的含量极显著地上升了。可能是原本负责将过氧化氢水解为H2O与氧气的CAT活性被抑制。只能靠产生大量GSH酶来清除体内过多的H2O2。反映机体氧化损伤最具代表性的指标之一的是MDA,其含量变化通常与SOD酶的活力成负相关[21]。本次研究也证实了这一点。在高锰酸钾胁迫48 h内,SOD酶活力下降,而MDA的含量上升。说明高锰酸钾胁迫48 h已经损害了锦鲤的抗氧化系统。
GOT是广泛存在于动物线粒体中的重要氨基酸转氨酶,其活性的变化可以有效测定肝脏的损伤程度。本次试验锦鲤受高锰酸钾胁迫过程中,肝脏GOT活性是持续上升的,这与朱仙珍[22]等对湘云鲫的研究相一致。表明KMnO4胁迫对锦鲤肝脏有一定程度的损害。但经过解除胁迫48 h试验可以看出,这种损害是可逆的,可以通过自身调节修复。
本次研究通過分析各项抗氧化酶指标可以看出,1 mg·L-1高锰酸钾胁迫锦鲤幼鱼不仅不会使其致死,除MDA外,其余指标都基本能恢复到正常水平。所以在锦鲤幼鱼养殖过程中,使用溶液浓度为1 mg·L-1的高锰酸钾比较合适。
参考文献:
[1]
CHISTIAKOV D A , CHISTIAKOV P A. Genetic and genomic resources for common carp Cyprinus Carpio, an economically important farmed freshwater fish[J]. Animal Genetics, 2009:81-106.
[2] OUYANG P,YANG R,CHEN J, et al.First detection of carp edema virus in association with cyprinid herpesvirus 3 in cultured ornamental koi, Cyprinus carpio L in China[J]Aquaculture ,2018,490(2):162-168,
[3] 马靓,张敏,张俊嫱.常用的氧化剂与挥发性烷化剂类消毒药[J].养殖技术顾问, 2014 (2):223-223.
[4] 谭永胜,刘建勇,徐彬晓,等.高锰酸钾对虎斑乌贼胚胎和幼体的毒性研研究[J].水产养殖,2011,32(1):12-15.
[5] STRAUS D L.Comparison of the acute toxicity of potassium permanganate to hybrid striped bass in well water and diluted well water[J]. Journal of the World Aquaculture Society, 2004,35(1):55-60.
[6] 杨星, 张美彦, 李小义,等. 4种常用水产药物对鲈鲤鱼苗的急性毒性效应[J]. 贵州农业科学, 2018, 46(11):87-90.
[7] 温茹淑,郑清梅,方展强,等.敌百虫和高锰酸钾对草鱼鱼种的急性毒性研究[J].水产科学,2007,26(7):405—407.
[8] 朱友芳, 严志洪, 洪万树. 高锰酸钾对中国花鲈的毒性效应[J].生态毒理学报, 2011, 6(2):176-181.
[9] 郑佳瑞,潘连德.高锰酸钾对红耳彩龟幼体的毒性研究和致畸率的测定[J].水产养殖,2015,36(10):15-19.
[10] 季延滨,孙学亮,郭永军.3种渔药对血鹦鹉鱼苗的急性毒性效应[J].贵州农业科学,2014,42(5):154-157.
[11] GRIFFIN B R , DAVIS K B , DARWISH A , et al. Effect of exposure to potassium permanganate on stress indicators in channel catfish Ictalurus punctatus[J]. Journal of the World Aquaculture Society, 2002, 33(1):1-9.
[12] 刘银华,何国森,钱毅,等.5种常用消毒剂对锦鲤幼鱼的急性毒性试验[J].渔业研究,2019,41(1):70—74.
[13] 周礼敬,詹会祥,吴兴兵,等.4种渔药对昆明裂腹鱼鱼苗的急性毒性试验[J].淡水渔业,2012,42(4):26-30.
[14] 张月琴, 李爱景, 金晓璐,等. 硫酸铜和高锰酸钾对淇河鲫仔鱼的急性毒性研究[J]. 安徽农业科学, 2009,37(15):7030-7031.
[15] CAO L, HUANG W, SHAN X J, et al. Tissue-specific accumulation of cadmium and its effects on antioxidative responses in Japanese flounder juveniles[J]. Environmental Toxicology & Pharmacology, 2012, 33(1): 16-25.
[16] FENG J F, GUO Y, GAO Y F, et al.Effects ofhypoxia on the physiology of zebrafish (Danio rerio): Initial responses, acclimation and recovery[J].Bulletin of Environmental Contamination & Toxicology, 2016, 96(1): 43-48.
[17] 陈光芸,张惠芬,徐钢春,等.硫酸铜和高锰酸钾对似刺鳊鮈幼鱼的急性毒性试验[J].水产养殖,2012,33(7):27-30.
[18] GUAN R J , MARIUZZA R A . Peptidoglycan recognition proteins of the innate immune system[J]. Trends in Microbiology, 2007, 15(3):127-134.
[19] SONG L S,WANG L L ,ZHANG H,et al.The immune system and its modulation mechanism in scallop[J]. Fish & Shellfish Immunology, 2015, 46(1):65-78.
[20] 王瑞龍, 陈玉明, 徐军,等.氯氰菊酯对唐鱼肝和鳃组织超氧化物歧化酶(SOD)活性的影响[J]. 生态环境, 2007,16(3):790-793.
[21] 贾秀英,施蔡雷.水体二价铜离子致蟾蜍蝌蚪DNA损伤和氧化损伤[J].环境科学学报,2008,28(10):2095—2100.
[22] 朱仙珍,郑永华,唐洪玉,等.恩诺沙星对湘云鲫(Triploid crucian carp)组织转氨酶(GPT、GOT)活性的影响[J].淡水渔业,2011,41(1):58-63.
Effects of potassium permanganate stress and post-toxic recovery on liver tissue of Cyprinus Carpio
WU Guangtao1,2, PU Hongyu1, ZHANG Rong2, WANG Xiaowen2, ZHU Hua2
(1. School of Aquatic products and Life, Dalian Ocean University, Dalian 116023,China;2. Beijing key Laboratory of Fisheries Biotechnology, Beijing Institute of Aquatic Sciences, Beijing 100068,China)
Abstract:In order to understand the toxicological effect of potassium permanganate disinfection on juvenile koi, the acute toxicity of potassium permanganate (KMnO4) to juvenile koi was studied by static water bioassay and safety evaluation was carried out. The acute exposure experiment of 48 h was carried out with 0.5,1, 2 mg ·L-1 and 3 mg ·L-1 KMnO4 concentration gradients, and the cumulative mortality was calculated, and the 48 h recovery experiment for the rest of fist was carried out. The activities of superoxide dismutase (SOD), catalase (CAT) and glutamic oxaloacetic transaminase (GOT) and the contents of glutathione (GSH) and malondialdehyde (MDA) in liver tissue were taken at 0,24 and 48 hours after stress and 24 hours and 48 hours after recovery. The toxicological effects of KMnO4 on juvenile koi were studied. The results showed that soaking in 2 mg ·L-1 potassium permanganate solution for 24 hours could kill juvenile koi and inhibit SOD, CAT and GOT. After relieving the stress, it can basically return to the normal level. The contents of GHS and MDA increased in the process of stress, but decreased to a level similar to that of the control group after relieving stress. The results showed that KMnO4 could cause liver damage of koi, and the degree of damage was aggravated with the increase of concentration and time, but after relieving stress, SOD, CAT, GOT, GSH, MDA and so on could recover to different degrees. Potassium permanganate with the concentration of 1 mg ·L-1 is the most suitable for disinfection of juvenile koi.
Key words:potassium permanganate; acute stress; liver; antioxidation; koi; SOD
(收稿日期:2021-01-16)
