陕北黄土高原生物结皮中7种微藻的形态与分子生物学鉴定
2021-03-10祝亚芳黄兴波程金凤
祝亚芳,黄兴波,程金凤
(西北农林科技大学 生命科学学院,陕西杨陵 712100)
生物结皮(biological crusts)是在土生藻类拓殖作用下,由微小生物及其代谢产物与沙粒组成[1-3],是水分、有机物与土壤颗粒紧密结合在土壤表层形成的一种壳状体[4],广泛地分布在干旱半干旱地区,其生物组成主要有藻类、地衣、苔藓,以及真菌、细菌等[5-6]。其中的藻类是分布在土壤环境中的土生藻类,在生物结皮中占据重要组分[7]。土生藻类能利用自身的固碳、固氮作用增加土壤有机物含量[8-9],并通过藻体及其分泌物粘固沙粒形成活性生物结皮,从而提高土壤的生物活性[10],改善土表理化性质,起到抗风蚀的作用。可见生物结皮中的藻类对固定土壤和促进养分循环具有极其重要的作用。
中国西北部的黄土高原是典型的干旱半干旱生态系统,面临着水土流失等诸多生态问题。在退耕还林的政策实施后,生物结皮便成为黄土高原典型的地表覆盖类型,不同降雨量对其盖度影响较大[11]。其中,李金峰等[12]在该地区发育初期的生物结皮中发现了50种藻类,大多是蓝藻和绿藻;杨丽娜等[13]对该地区生物结皮中的蓝藻多样性进行了研究。对于黄土高原生物结皮藻类的研究常见为数量及分布的研究,而利用分子手段对生物结皮藻类群落的系统学研究较少。本研究将对黄土高原生物结皮中的7种纯化藻类进行形态学与分子生物学鉴定,并利用MrBayes 3.2.4对这几种藻类进行系统学分析,为后续黄土高原生物结皮藻类的研究奠定理论基础。
1 材料与方法
1.1 样品采集及处理
在陕北黄土高原不同区域的每块样地上,使用酒精浸泡过的环刀和土钻采集生长良好的生物结皮样品(10 cm × 10 cm)。将采集完整的生物结皮除去石块、植物根系等杂物后,保存到牛皮纸信封内;将所有样品编号标记,阴干保存带回实验室[14],在超低温冰箱中保存。各采样地点见表1。
1.2 结皮藻类的培养与纯化
1.2.1 结皮藻类培养选择合适的锥形瓶并加入80 mL的BG-11[15]培养基后进行灭菌处理、冷却备用。将室外采集的生物结皮拿到实验室内,选取发育良好的生物结皮,放入锥形瓶中充分混匀后置于人工气候培养箱中培养。将光照、光暗周期及温度参数分别调至40%,10 h / 14 h,26 ℃,培养1周左右,培养期间随时观察生长情况,避免生长过旺或杂菌污染严重。
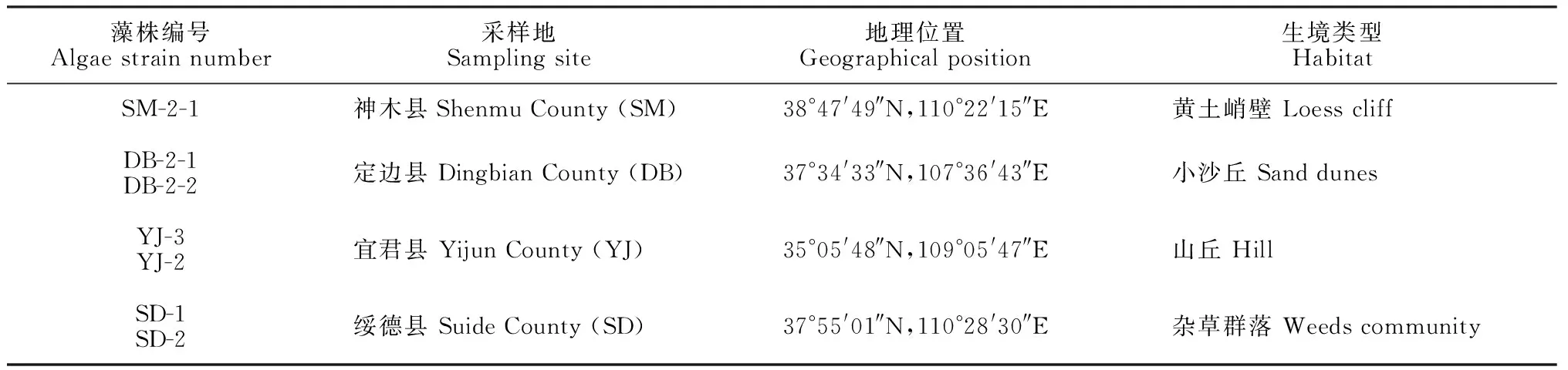
表1 陕北黄土高原生物结皮采样点信息
1.2.2 藻类纯化利用水滴稀释法或平板法[16]对上述培养好的混合藻液进行单藻种纯化。首先将平板上长出的单个群落挑出放在倒置显微镜下观察,若形态一致,将其转入装有5 mL无菌培养液的小瓶子中培养;若形态不一致,则采用微吸管分离法或稀释水滴分离法进行纯化。整个纯化期间定时进行镜检,直到观察到的藻类形态一致为止,即纯化完成。最后取对数生长期的藻液滴于载玻片上,制成临时装片,在光学显微镜下观察结皮微藻的形态并对其形态特征拍照。
1.3 单藻种的分子鉴定
1.3.1 DNA提取、扩增与测序取对数生长期的藻液,3 000 r/min离心10 min,收集沉淀,称取少量放到2 mL的离心管中,用CTAB方法进行基因组DNA提取。用于扩增绿藻5.8S+ITS2的引物序列为:正向5′-TCCGTAGGTGAACCTGCGG-3′,反向5′-TCCTCCGCTTATTGATATGC-3′[17];用于扩增蓝藻的16S-23S rDNA的引物为:正向5′-TGTACACACCGGCCCGTC-3′,反向5′-CTCTGTGTGCCTAGGTATCC-3′[18]。PCR反应体系(25 μL):ddH2O为9.5 μL、2×Taq MasterMix为12.5 μL、正反向引物各1 μL、DNA模板1 μL。扩增完成后,双向测序由西安擎科生物技术公司完成。
1.3.2 贝叶斯(BI)树构建测序完成后数据导入软件Geneious 9.0.2中,进行拼接处理,将处理好的序列提交至GeneBank,利用Blast搜索引擎中的nucleotide blastn下载若干同源序列。然后,对所有序列进行比对、排矩阵后,用jModelTest计算合适模型,最后用MrBayes 3.2.4构建系统发育树。
1.3.3 遗传距离分析遗传距离计算在MEGA 7.0中进行,将剔除外类群序列的上述文件导入MEGA中,并对序列进行分组处理,之后在Distance分析选项中计算遗传距离三角矩阵,其计算模型选择K2P。
2 结果与分析
2.1 7株结皮藻的形态特征
本次研究从生物结皮中共纯化出7种藻类,其中有5种绿藻(编号分别为SM-2-1、DB-2-1、DB-2-2、SD-1、SD-2)和2种蓝藻(编号分别为YJ-3和YJ-2)。
(1)绿藻:SM-2-1细胞为长圆形,两端具有突出的尖,常见1或2个细胞组成,外有明显的胶被包裹,细胞长约16.7 μm,色素体片状周生,胞内有1个明显的蛋白核(图1 a,b)。DB-2-1常见为2或4个细胞,由透明胶被包裹聚集,单个细胞为圆球形,直径约为13.3 μm,色素体呈不规则状周生,常见1个蛋白核(图1 c,d)。DB-2-2为球形细胞,胞外有透明的胶被物质,常由数个细胞组成,个体大小差异较大(直径在15~40 μm间),色素体均匀分布在藻体细胞内部,有多个蛋白核(图1 e,f)。SD-1细胞为梭形或纺锤状且两端有细长的喙状末端,整个细胞长约80 μm,两细长的喙状末端基本一致,色素体片状分布在两端、中间分布较少,具有1个蛋白核(图1 i,j)。SD-2藻体呈单细胞圆球形,直径约20 μm,个体间分散生长,色素环状分布在细胞上,具有蛋白核(图1 g,h)。
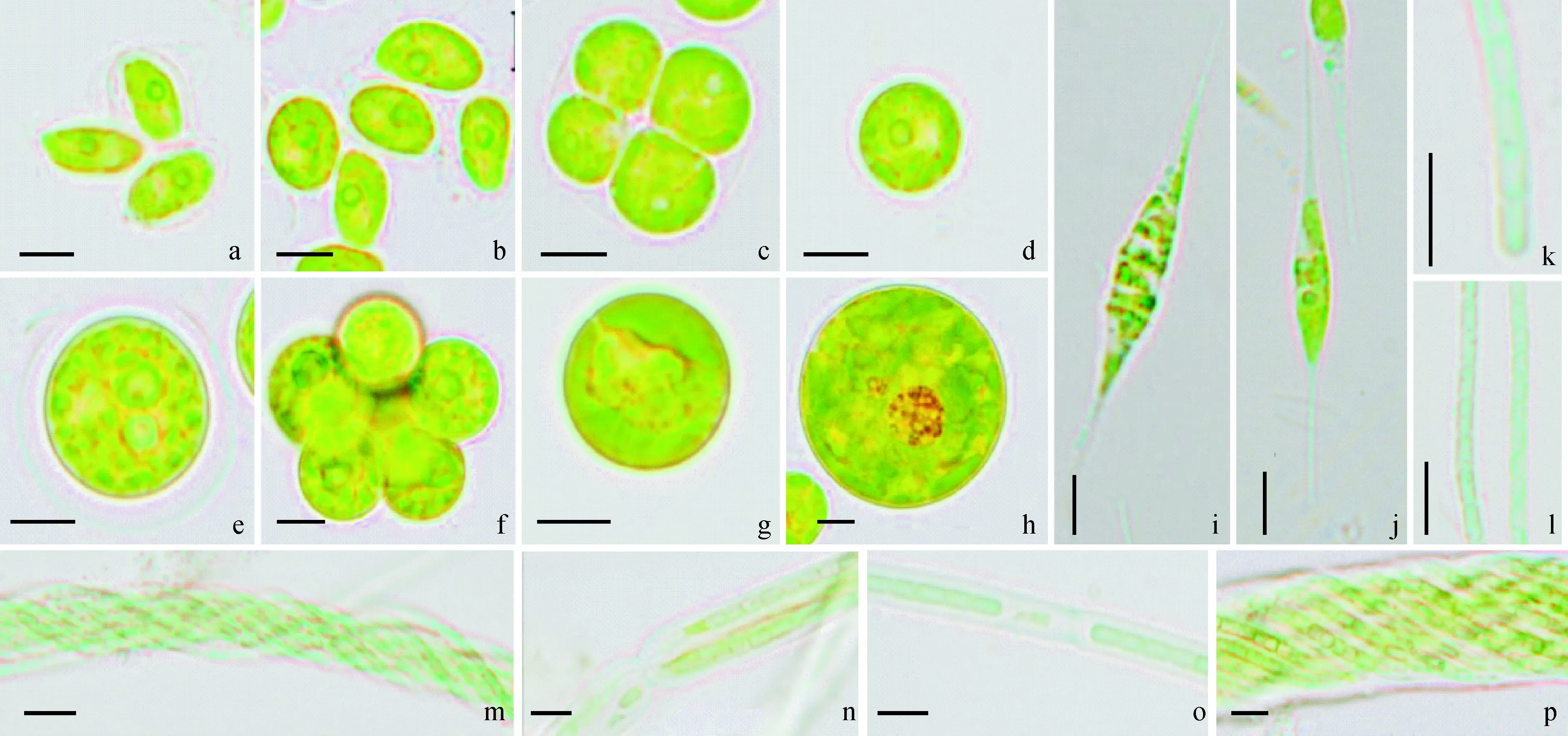
藻类照片均为100倍油镜下的光学照片(标尺=10 μm)。其中,a、b.SM-2-1; c、d.DB-2-1; e、f.DB-2-2;g、h.SD-2;i、j.SD-1; k~m.YJ-2; n~p.YJ-3图1 7种结皮藻的形态特征The above photos of algae are optical photos under 100x oil microscope, bar=10 μm. a, b. SM-2-1; c, d. DB-2-1; e, f. DB-2-2; g, h. SD-2; i, j. SD-1; k-m. YJ-2; n-p. YJ-3Fig.1 Morphological characteristics of seven species of biological crust algae
(2)蓝藻:YJ-3的藻丝体外侧有明显的鞘,常见鞘内多个藻丝体有规律地缠绕在一起呈束状,有时鞘内也只出现一个藻丝体,鞘有收缢现象,单个藻丝体宽约8.4 μm,束状宽约33.3 μm,细胞长宽分别为6.3 μm和3.0 μm,藻体呈蓝绿色(图1,n~p)。YJ-2通常单个藻丝体出现,有时也会多个藻丝相互缠绕出现,细胞间有收缢,细胞长约3.2 μm,宽约1.6 μm,无外鞘,藻体呈蓝绿色(图1,k~m)。
2.2 藻株核酸序列分析
从形态上初步断定5株编号为SM-2-1、DB-2-1、DB-2-2、SD-1和SD-2的结皮藻为绿藻门植物,进行5.8S+ITS2核酸序列扩增,序列长度分别为664 bp、663 bp、662 bp、589 bp和688 bp,其中GC含量分别为33.43%、49.47%、50.15%、50.76%和51.01%;藻株YJ-3和YJ-2判定为蓝藻,16S-23S rDNA序列扩增长度分别为570 bp和465 bp,序列GC含量分别为46.31%和49.03%,图2为7株结皮藻扩增片段电泳图。利用Blast搜索引擎中的nucleotide blastn对获得的5.8S+ITS2序列和16S-23S rDNA序列进行比对,结果显示如下:
SM-2-1藻株5.8S+ITS2序列与Acutodesmusreginaes CCAP 27666(JQ082326)的比对序列相似度最高(96%),存在2个碱基差异位点。DB-2-1藻株与多条比对序列相似性均高达100%,无碱基差异。DB-2-2藻株序列与雨生红球藻H(HaematococcuspluvialisH,GQ463618)序列高度相似(99%),同时与多种衣藻目(Chlamydomonadales)藻株序列相似(95%左右)。SD-1藻株比对序列与水生境中的环藻科Ankyra属两藻株序列[19](HQ219412、HQ219430)只发现一个碱基差异点,相似度高达97%,与Atractomorphaporcatastrain SAG 71.90(KM020065)的5.8S+ITS2序列相似性为91%,存在22个碱基差异位点。SD-2的5.8S+ITS2序列与真眼点藻科(Eustigmataceae)多个藻株序列高度相似,其中与大真眼点藻(EustigmatosmagnusSAG 2370)存在1个碱基差异位点,序列相似性高达99%。藻株YJ-3的16S-23S rDNA序列与NCBI数据库GeneBank中比对出来的序列相似度都不高,其中序列相似度最高的是伪鱼腥藻科(Pseudanabaenaceae)藻株,仅为87%,且有10个位点存在差异。藻株YJ-2的16S-23S rDNA比对序列与细鞘丝藻属(Leptolyngbya)藻株序列相似度高,其中与Haloleptolyngbyasp. PMC 895.15(MH182758)的比对序列相似度最高(100%),无碱基差异。

图2 7株结皮藻DNA扩增片段电泳图Fig.2 The electrophoresis patterns of DNA amplified fragments of seven species from biological crust algae
2.3 BI树与遗传距离分析
2.3.1 结皮绿藻系统树分析将结皮分离藻株的5.8S+ITS2序列或16S-23S rDNA序列进行同源比对后,下载一些相似性高的序列,通过剪切、排矩阵后,利用MrBayes 3.2.4软件进行建树分析。
对结皮绿藻的BI树(图3)进行分析可以得出,这5株绿藻可分为4个分支,从上到下分别为栅藻科(Scenedesmaceae)、衣藻目(Chlamydomonadales)、环藻科(Sphaeropleaceae)、真眼点藻科(Eustigmataceae)。其中,DB-2-1和SM-2-1 都属于栅藻科。DB-2-1与Scotiellopsisreticulate的4个物种聚在一支且支持率为100%,且与这4株藻之间的遗传距离均为0.000,综合两种分析结果得出DB-2-1藻株应该归于Scotiellopsis属。SM-2-1与Acutodesmusreginae单独聚在一起,支持率为64%,两者间的遗传距离最小(0.041),并与NCBI相似性搜索比对结果一致,因此应该归于尖带藻属(Acutodesmus)。SD-1所在的分支为环藻科,与淡水生境的Ankyra属藻株共为一支,支持率为82%,遗传距离小于0.057,系统发育树与遗传距离分析结果一致,而SD-1形态与Ankyra属藻种形态极为相似,因此SD-1最有可能是环藻科Ankyra属物种。SD-2与真眼点藻科真眼点藻属(Eustigmatos)藻株聚为一支,且与大真眼点藻SAG2370(EustigmatosmagnusSAG2370)的遗传距离最小0.008,与真眼点藻属的其他藻种的遗传距离也都小于0.02,与同源比对结果相结合可确定SD-2最有可能是真眼点藻属藻种(Eustigmatos)。DB-2-2与一种雨生红球藻(HaematococcuspluvialisH)和一种土生红球藻‘Haematococcussp.’(MF482915)聚为一支,支持率为84%,遗传距离分别为0.005、0.026,通过对DB-2-2的形态观察以及序列比对分析后,其应归于红球藻属(Haematococcus)。

图3 5株结皮绿藻5.8S+ITS2的贝叶斯系统发育树Fig.3 Bayesian phylogenetic tree of 5.8S+ITS2 from five strains of green algae with biological crusts
2.3.2 结皮蓝藻系统树分析对蓝藻贝叶斯系统发育树(图4)分析显示,YJ-3和YJ-2聚在一大类分支伪鱼腥藻科(Pseudanabaenaceae)中,从BI树中能明显的发现这2株蓝藻分别归于不同的属。YJ-3与伪鱼腥藻科(Pseudanabaenaceae)藻株KC525096聚为一支,支持率为100%,两者间遗传距离为0.273,遗传距离值偏大,这与上述NCBI同源序列分析结果一致,因此YJ-3可能为伪鱼腥藻科一新物种。YJ-2与细鞘丝藻属(Leptolyngbya)的2个藻种归为一个分支,节点支持率为100%,但YJ-2藻丝无鞘,同时遗传距离较大分别为0.314和0.327,与其序列相似度最高的是Haloleptolyngbyasp.PMC895.15但两者间的遗传距离较远,因此YJ-2也有可能是细鞘丝藻属(Leptolyngbya)亲缘关系较近的一新物种。

图4 2株结皮蓝藻16S-23S rDNA的贝叶斯系统发育树Fig.4 Bayesian phylogenetic tree of 16S-23S rDNA from two strains of cyanobacteria with biological crusts
3 讨 论
目前国内对生物结皮藻类多样性的研究主要依据其形态学特征来鉴定,该方法较为费时且需要具有多年藻类形态鉴定经验,但是多数藻类在不同环境及发育阶段的形态特征会有所不同,因此仅凭形态学特征来进行藻种鉴定是非常困难的。近年来,藻类分子系统学在其分类、系统发育发生和分子进化等领域得到了广泛的应用[20-21],多种DNA保守序列(如16S-23S、ITS等)分析越来越多地用于藻类分子系统研究中[18,22],确保了鉴定的准确性。本次实验通过形态观察并利用5.8S+ITS2和16S-23S rDNA序列分别对纯化的结皮绿藻与蓝藻完成鉴定,为后续黄土高原生物结皮藻类的研究奠定部分理论基础。
本研究对7种结皮藻的系统发育分析及形态鉴定可初步确定到属的水平。在5株结皮绿藻5.8S+ITS2序列比对分析中发现,该序列在多数属内差异小、非常保守,极易确定到属。DB-2-1属于Scotiellopsis属、SM-2-1属于尖带藻属(Acutodesmus),均隶属于栅藻科。栅藻科植物体为真性定性群体,常见多个藻体细胞平行或上下交错排列、少数藻以单细胞,藻体形态多样,只有1个周生色素体和一个蛋白核。DB-2-1与Veronika Kaufnerová[23]文中ScotiellopsisreticulateCCALA474的形态一致,无论是从形态还是序列分析都支持DB-2-1是Scotiellopsis属中的一种。SM-2-1形态符合尖带藻属的描述[24],但是尖带藻属胞外无胶被而该藻种胞外存在胶被,很有可能是该属的新种。DB-2-2与雨生红球藻 H(HaematococcuspluvialisH)同源性序列最为相似,同时与另外一株红球藻属野生藻株(MF482915)聚为一支,因此本文建议DB-2-2归于红球藻属(Haematococcus)。SD-1形态特征较像弓形藻属(Schroederia),但系统发育分析与序列比对表明其为Ankyra属物种,与Yong Jae Kim文中[25]对环藻Ankyrajudayi的形态描述相符,但是两者生境截然不同,Ankyrajudayi为水生环境而SD-1则是在较为干旱的陕北黄土高原生物结皮中分离的,这与沙漠绿藻起源于淡水藻的推论相吻合。根据分析SD-2可能是真眼点藻属(Eustigmatos)物种,而真眼点藻是一种单细胞土生藻,具有高产油和可溶性多糖特性,因此基于这两方面的研究较多,如吴桂秀等[26]。藻株SD-2在生物结皮中分离得到,与真眼点藻属生境相符,可能对生物结皮的形成和发育起着极其重要的作用。另外2株结皮蓝藻中,YJ-3经分子序列分析表明其应归于伪鱼腥藻科,与之归为一支的伪鱼腥藻(KC525096)生境为阿塔卡马沙漠[27],生境相同但在序列中存在多个碱基差异且遗传距离值偏大,其较可能为伪鱼腥藻内的一个新种。YJ-3形态为多条藻丝组装成紧密的绳索结构,这种超强绳索结构在功能上使蓝藻能够在泥沙及侵蚀的不稳定环境中成为生态稳定的开拓者,在传统分类学上又是几个属定义的基础特性,特别是微鞘藻属(Microcoleus)和水鞘藻属(Hydrocoleum)[28]。YJ-2与BI树中聚在同一分支的细鞘丝藻(Leptolyngbya)比对结果存在4%的碱基差异,而与藻株Haloleptolyngbyasp. PMC895.15相似度高达100%且无碱基差异,但是YJ-2与三者的遗传距离都较远,而YJ-2形态观察并无外鞘,可能为伪鱼腥藻科细鞘丝藻属亲缘关系较近的一新物种。Patzelt D. J.[27]在对沙漠土壤蓝藻多样性的研究中可以看出细鞘丝藻属(Leptolyngbya)呈现多样性,在伪鱼腥藻科多个分支中都有出现,还有部分以外类群出现,因此对于细鞘丝藻属还需进行深入的分类研究。本研究观察发现,在这7株结皮藻中,有一半的藻体外部形态特征具有鞘或者胶囊。这些鞘或者胶囊是微藻以不同形式排出的EPS[29],能参与沙粒的黏附,促进生物结皮形成。
