杂交兰花色花香生物合成途径的转录组分析
2021-03-10樊荣辉林榕燕叶秀仙钟淮钦
孔 兰,樊荣辉,林榕燕,叶秀仙,林 兵,钟淮钦*
(1 福建省农业科学院 作物研究所, 福州 350013; 2 福建省特色花卉工程技术研究中心, 福州 350013)
花色、花香作为观赏植物重要的表型性状,决定了兰花的观赏价值和经济价值[1-2]。杂交兰(Cymbidiumhybrid)是兰属中的国兰和大花蕙兰(Cymbidiumhybridium)杂交培育而成的一类兰花的特称,继承了国兰的幽香和大花蕙兰花大、色艳、花箭出架等优异特性,植株适中,花期长,具有广阔的市场前景[3-5]。此外,杂交兰花色和花香多样,也是研究花色和花香形成机制的理想材料[6-7]。
目前,国内外已开展了观赏型植物花色素和香气成分分析[8-9]。不同花色杂交兰色素成分检测发现,花青素决定了杂交兰红色素和紫色色素的积累,而类胡萝卜素影响了黄色色素的积累[10-11]。陈艺荃等[12]应用顶空-固相微萃取/气相色谱-质谱联用技术分析了7个杂交兰品种的花香成分,发现萜烯类化合物是其主要花香成分,不同品种间花香成分存在显著差异。上述研究表明,杂交兰不同品种的花色素和花香成分生物合成存在异同。
前人基于转录组数据,分析了蝴蝶兰[13]、文心兰[14]、卡特兰[15]、春兰[16]和建兰[17]等兰科植物花色素和花香成分生物合成的主要功能基因及其差异表达,建立了花色花香形成的分子调控网络。但对杂交兰特定的花色和花香、相关分子机制仍待研究。
杂交兰K18为黄色花,其花香成分包括石竹烯、α-香柑油烯、反式橙花叔醇、β-姜黄烯和β-罗勒烯等化合物,主成分为倍半萜;K24的花为紫红色,其花香成分包括桉油精、正己醇和反式法呢醛等化合物,主成分为单萜[12]。因此,本研究以K18和K24为材料,采用RNA-Seq技术获得杂交兰不同花期的花朵转录组数据,分析杂交兰不同花色/花香相关基因的表达调控变化,为深入研究其分子机制以及兰花品种改良提供有效信息。
1 材料和方法
1.1 材 料
黄花清香型K18(‘玉凤’)为本实验室引进品种,紫红花淡香型K24(‘福韵丹霞’)是本实验室大花蕙兰和墨兰杂交而来的自育品种,均种植于福建省农科院作物所花卉研究室苗圃中。分别采集K18和K24小花蕾期、半开期和盛花期的花朵(图1),-80 ℃冷冻保存,用于后续RNA-seq分析。每个样品3个生物学重复。
1.2 方 法
1.2.1 RNA提取及测序使用TaKaRa植物RNA提取试剂盒(Cat#9769)提取杂交兰不同花期的总RNA。利用1%琼脂糖凝胶电泳检测RNA降解和污染;分别使用NanoPhotometer分光光度计、Qubit®2.0荧光计和Agilent bioanalyzer 2100系统检测RNA纯度、浓度和RNA完整性;根据NEB-Next®UltraTMRNA文库制备试剂盒提供的说明书构建18个不同花期样品(含3个生物学重复)的测序文库,并利用Illumina高通量测序平台进行测序,生成两端测序Reads。测序工作由北京诺禾致源生物公司完成。

A~ C. K18小花蕾期、半开期和盛花期;D~ F. K24小花蕾期、半开期和盛花期图1 K18 和 K24 不同花期表型A-C. Bud stage, half flowering stage and flowering stage in K18;D-F. Bud stage, half flowering stage and flowering stage in K24Fig.1 Phenotypes of K18 and K24 at different flowering stages
1.2.2 功能注释和表达差异分析采用Trinity[18]软件对转录组Clean reads进行拼接获得转录本序列。根据序列相似性,比对到Nr、Nt、Swiss-Prot、KEGG、GO(e<1e-5)、Pfam(e<0.01)和COG(e<0.001)七大数据库中,获得相应基因的功能注释。基于Nr和Pfam获得的蛋白功能注释结果,利用KAAS[19]软件对基因进行KO注释,完成KEGG代谢通路分类。采用DESeq R[20]软件包分析不同花发育时期的差异表达基因,并通过多重假设检验校正。readcount数值为基因差异表达的分析数据,校正后的P<0.05且|log2(foldchange)|>1设置为基因显著差异表达的筛选阈值。使用KOBAS[21]软件进行差异表达基因的KEGG通路富集分析,校正后P<0.05的Pathway为显著富集的代谢通路。
1.2.3 qRT-PCR验证以杂交兰小花蕾、半开期和盛花期花朵的总RNA为模板,按照PrimeScript RT reagent kit with gDNA Eeaser试剂盒进行反转录合成cDNA。参照TB GreenTMPremix Ex TaqTM试剂盒说明书,以cDNA为模板,在ABI7500 PCR仪上完成qRT-PCR。用2-ΔΔCt方法计算每个基因在不同样品中的相对表达量。Actin为内参基因。
1.2.4 花色素苷成分检测参照徐怡倩等[22]的方法,应用超高效液相色谱-四级杆飞行时间质谱联用仪(UHPLC-QTOF-MS)检测杂交兰花色素苷成分。
2 结果与分析
2.1 转录组数据组装与功能注释
K18和K24样品测序的原始数据经质控和处理,获得446.52 M有效数据,共66.97 Gb,Q30在92.00%以上,GC含量均大于46.11%,表明测序数据可靠。有效数据组装后获得787 529和336 170条转录本(transcript)和单基因(unigene);其中unigene平均长度为599 bp,N50长度为868 bp,组装完整性较高,可用于后续分析。通过公共数据库比对,36.13% unigene获得功能注释(表1)。其中,Nr数据库匹配到的unigene数目最多,为86 272个(25.66%);GO数据库匹配到50 174个unigene(14.92%);KEGG数据库中得到18 789个unigene(5.58%)注释。
2.2 转录组差异表达基因分析及KEGG功能分类
对K18和K24不同花期的差异表达基因(differently expressed gene,DEG)比较结果(图2)发现,K18中,较盛花期分别有11 914和1 082个基因在小花蕾期和半开期差异表达;K24中,较盛花期分别有6 793和459个基因在小花蕾期和半开期差异表达。K18-1 vs K18-3或K24-1 vs K24-3比较组中涵盖了全部的DEG,且上调基因数目明显低于下调基因数目。此外,本研究比较了小花蕾期和盛花
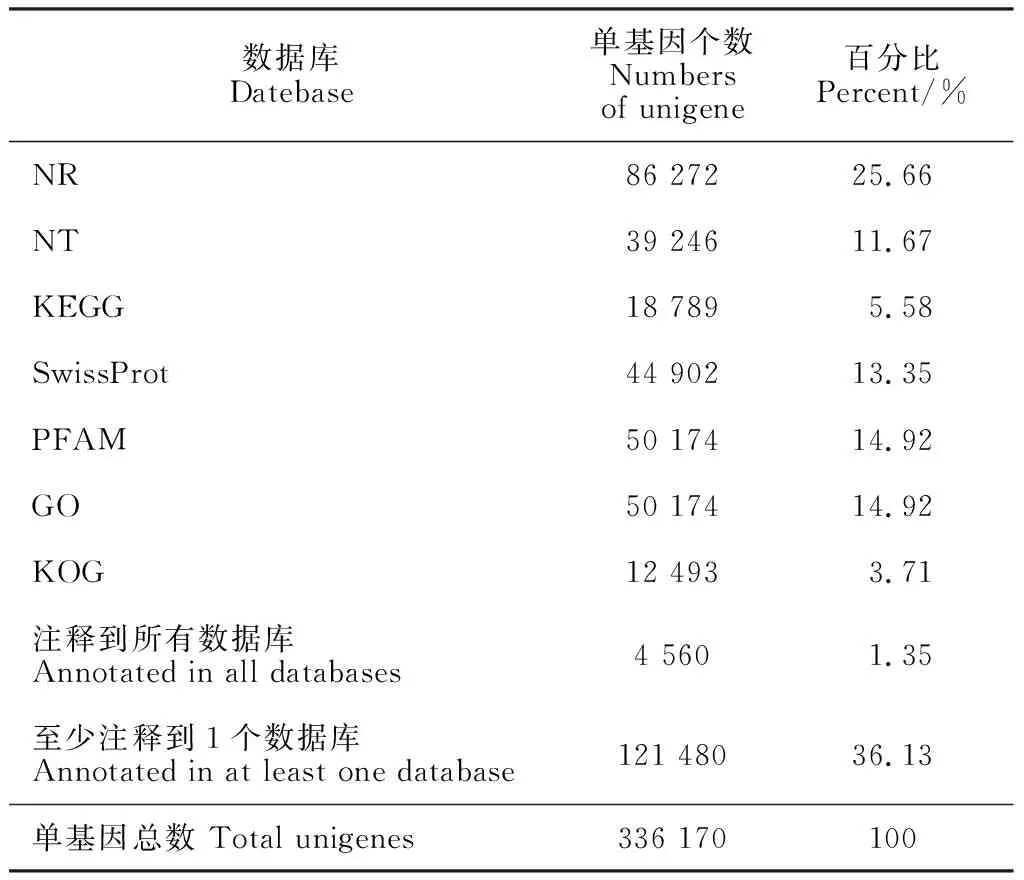
表1 功能注释结果统计

图2 杂交兰不同时期差异表达基因的分布Fig.2 Distribution of DEGs among different flower developmental stages
期 K18 与 K24 之间的DEG,其中K18-1 vs K24-1获得17 920个DEG,K18-3 vs K24-3获得13 161个DEG。
分别对K18-1 vs K18-3和K24-1 vs K24-3的11 914个和6 793个DEG比对到KEGG数据库中。K18-1 vs K18-3的DEG在淀粉和蔗糖代谢(ko00500,228)富集最显著,其次是类胡萝卜素生物合成(ko00906,50)、亚油酸代谢(ko00591,47)和萜类骨架生物合成(ko00900,66)等。K24-1 vs K24-3富集最多的是苯丙烷类生物合成(ko00940,130)、萜类骨架生物合成(ko00900,59)和α-亚麻酸代谢(ko00592,71)等。已明确的是,类胡萝卜素生物合成途径、类黄酮生物合成途径介导了花色的形成,而萜类骨架生物合成途径、倍半萜和三萜生物合成途径与花香直接相关。
2.3 花色素生物合成相关结构基因分析
13个花色相关差异表达基因参与类胡萝卜素生物合成途径(表2)。如图3,A显示,与小花蕾期相比,K18中八氢番茄红素合成酶基因(PSY)、八氢番茄红素脱氢酶基因(PDS)和ζ-胡萝卜素异构酶基因(Z-ISO)等的表达量在盛花期均上调;番茄红素环化酶基因(LYCE和LYCB)和β-胡萝卜素羟化酶基因(BCH1)的表达量下调。K24盛花期与小花蕾期相比,上调的基因有PSY、玉米黄质环氧酶基因(ZEP)和VDE;下调的基因有PDS、Z-ISO和BCH1等。
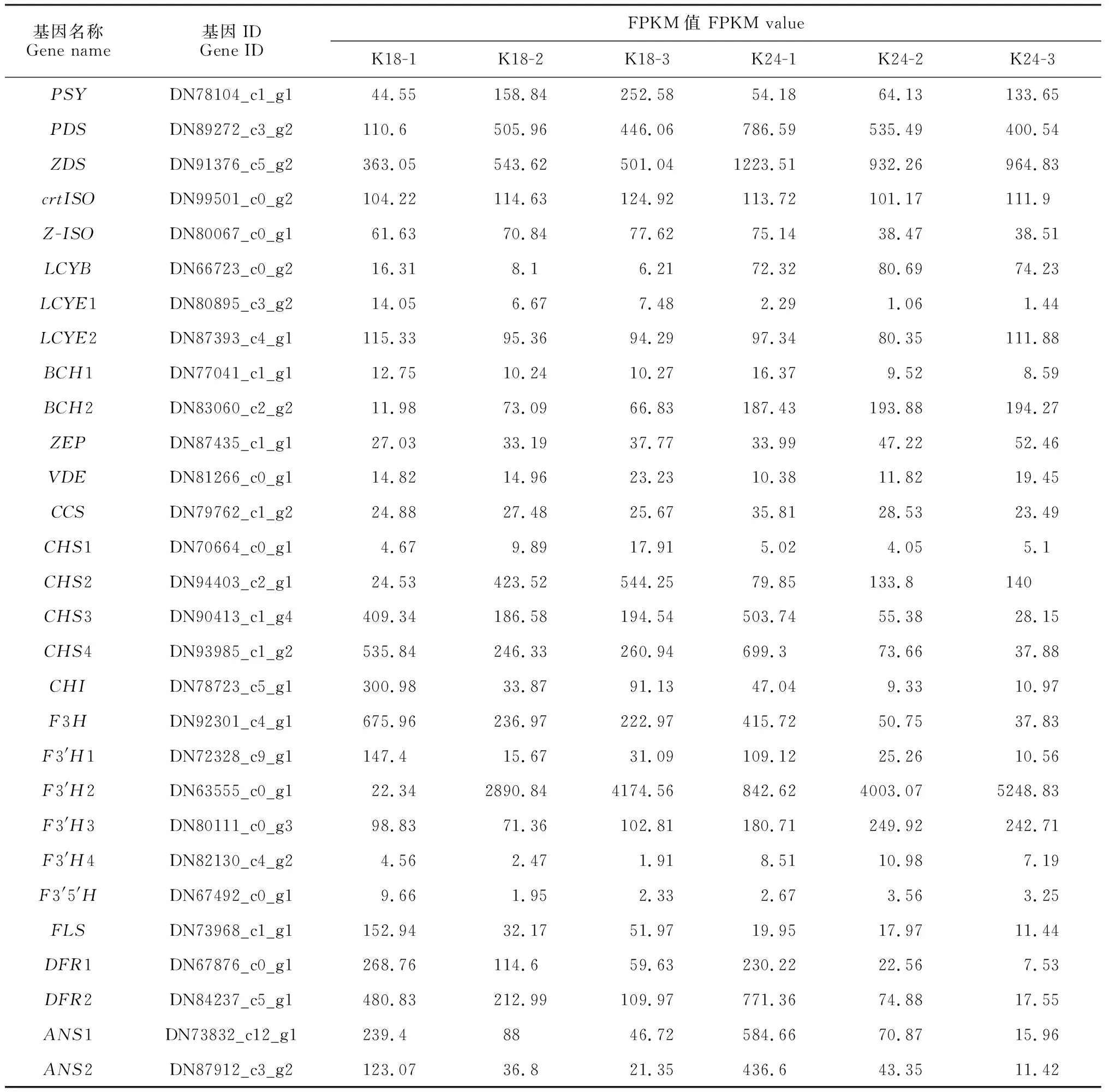
表2 花色结构基因的差异表达
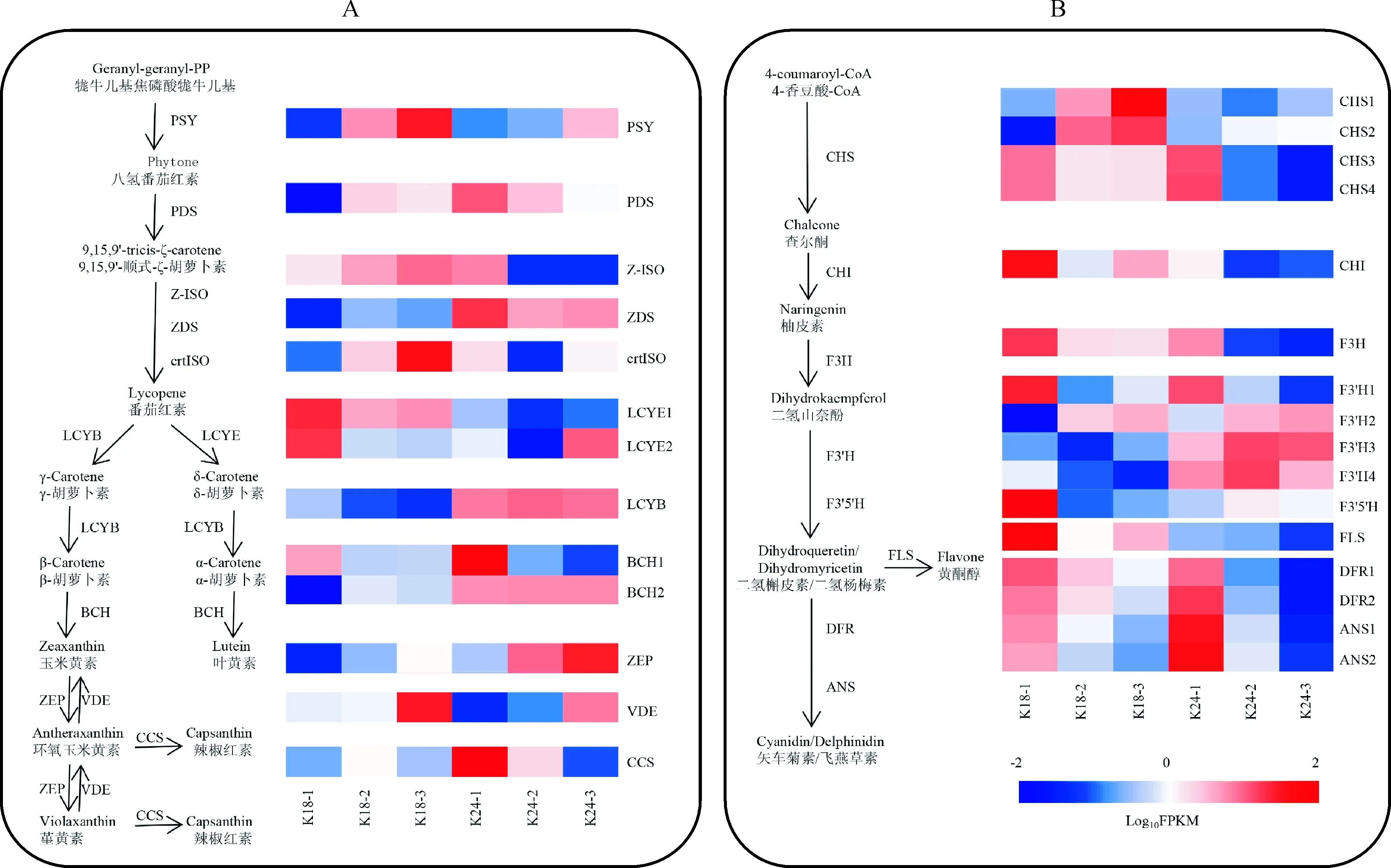
A. 类胡萝卜素生物合成途径中结构基因的表达谱;B. 类黄酮生物合成途径中结构基因的表达谱图3 K18 和 K24 中花色素结构基因的表达谱A. The expression profile of structural genes involved in carotenoid biosynthesis; B. The expression profile of structural genes involved in anthocyanin biosynthesisFig.3 Expression profiles of structural genes associated with pigment biosynthesis in K18 and K24 at three flower developmental stages
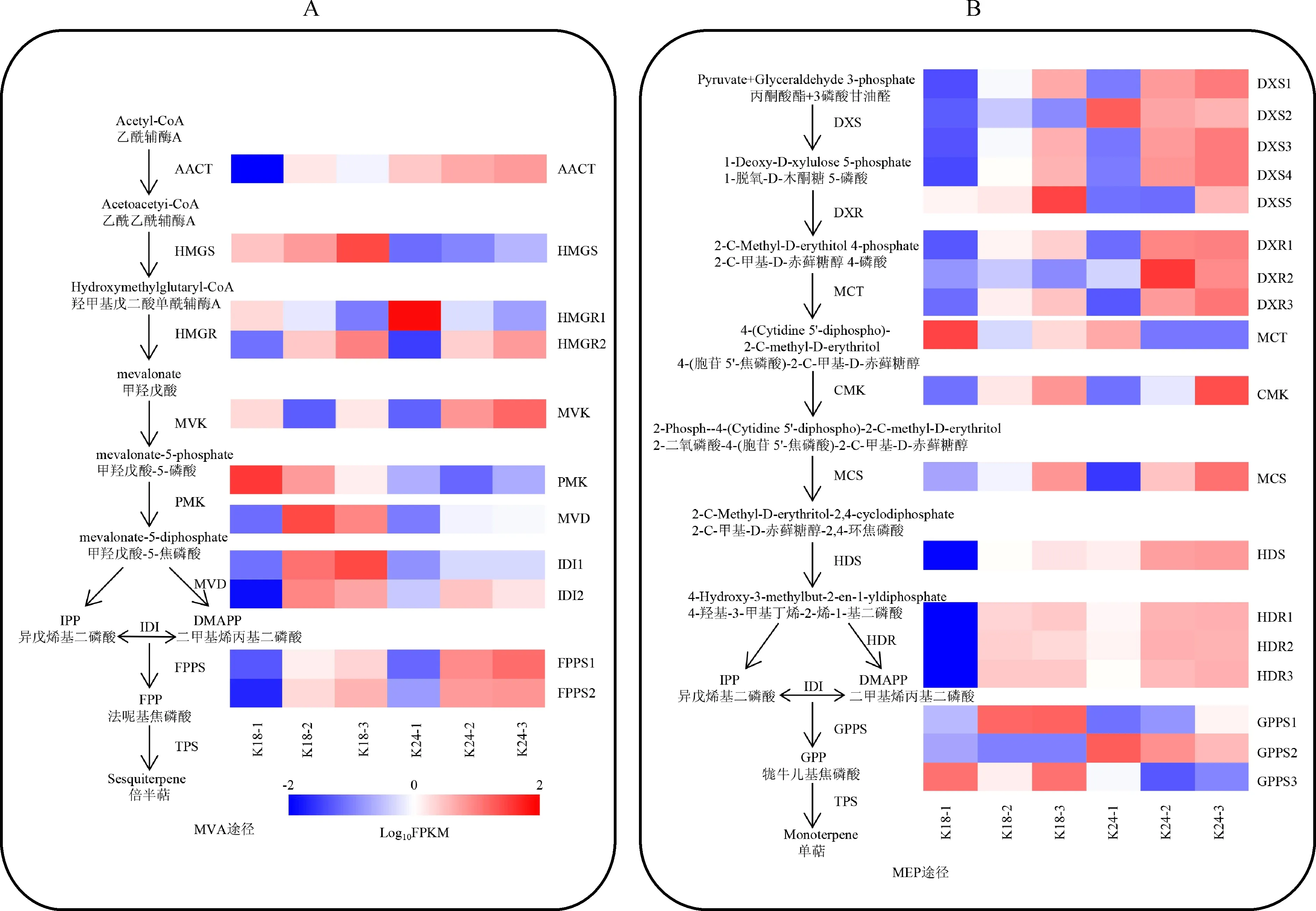
A. 倍半萜生物合成途径中结构基因的表达谱;B. 单萜生物合成途径中结构基因的表达谱图4 K18 和 K24 中萜类合成相关结构基因的表达谱A. Expression profile of structural genes involved in sesquiterpene biosynthesis; B. Expression profile of structural genes involved in monoterpene biosynthesisFig.4 Expression profiles of structural genes associated with terpenoid biosynthesis in K18 and K24
16个差异表达基因参与类黄酮生物合成途径(表2)。除类黄酮-3′,5′羟化酶基因(F3′5′H)外,其他类黄酮生物合成关键基因在 K18 和 K24 中均表现相似的表达模式。其中,查尔酮异构酶基因(CHI)、黄烷酮3-羟基酶基因(F3H)和黄酮醇合酶基因(FLS)等均表现下调,查耳酮合酶基因(CHS)和类黄酮-3′羟化酶基因(F3′H)既有上调表达也有下调表达;F3′5′H在K18的小花蕾期表达水平最高,在K24的3个时期均无明显差异表达(图3,B)。
2.4 杂交兰萜类生物合成相关的结构基因
28个花香结构基因参与萜类骨架生物合成途径,其不同花发育时期的表达水平具有显著差异(图4,表3)。甲羟戊酸(MVA)途径中羟甲基戊二酰辅酶基因(HMGS)、羟基-3-甲基戊二酰辅酶A还原酶基因(HMGR2)、甲羟戊酸-5-焦磷酸合酶基因(MVD)及异戊烯基焦磷酸异构酶基因(IDI)的表达水平在半开期或盛花期显著上调,且K18的表达量明显高于K24(图4,A)。2-C-甲基-D-赤藓醇-4-磷酸(MEP)途径中除2-C-甲基-D-赤藓糖醇4-磷酸胞苷基转移酶基因(MCT)和牻牛儿基焦磷酸合酶基因(GPPS)外,其他酶基因在盛花期高表达,且在K24中优势表达(图4,B)。
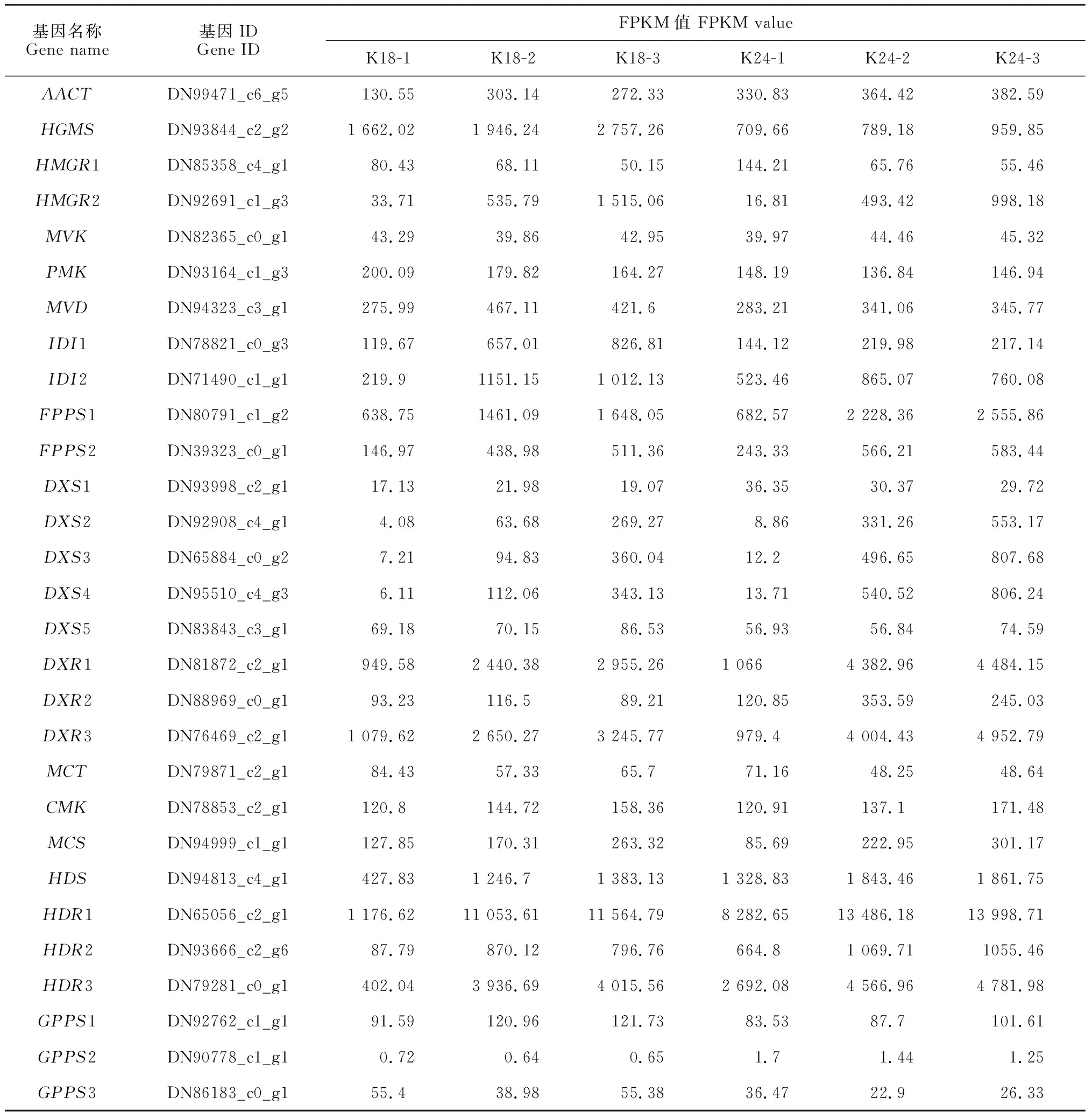
表3 花香结构基因的差异表达
此外,本研究筛选到112个差异表达的萜烯合酶基因(TPS),多数TPS的表达水平在盛花期最高,与香气释放呈正相关。其中,倍半萜生物合成途径中DN78169_c2_g2(alpha-humulene synthase-like)、DN99176_c3_g1(Beta-cubebene synthase)、DN80925_c0_g1(germacrene D synthase)和单萜生物合成途径中DN64363_c2_g4(beta-ocimene synthase)、DN72253_c0_g1(terpene synthase 10-like)和DN83821_c0_g4(linalool synthase)在K18盛花期的转录水平显著上调,且高于K24(>100倍)。而单萜合酶基因DN65004_c3_g1、DN87421_c2_g1(alpha-terpineol synthase)和DN78962_c1_g1(terpene synthase 10-like)在K24盛花期的转录水平高于K18。
2.5 花色素苷成分检测
对杂交兰K18和K24盛花期花瓣花色素苷进行定量定性分析,结果显示,共有18种花色素苷,花色素苷总含量存在显著差异,K24中花色苷含量为608.74 μg·g-1,K18花色苷含量仅为K24的20%。K24花中色素物质主要成分为矢车菊素苷,使其花色呈红色;K18中飞燕草素苷含量相对较高(表4)。
2.6 花色花香结构基因的qRT-PCR分析
对16个花色花香结构基因进行qRT-PCR分析,其表达结果与RNA-Seq的测序结果相似,验证了RNA-Seq数据的可靠性(图5)。花色结构基因LYCE、F3H和FLS在小花蕾期表达量最高,且K18中表达水平高于K24;ANS则在K24的小花蕾期显著表达。花香结构基因DXS2和TPS1-8在盛花期的表达水平明显高于小花蕾期和半开期,其中TPS1、TPS2和TPS5-8在K18盛花期中的表达量约为K24的100倍以上。

表4 K18和K24中花色素苷成分鉴定

K18-1、K24-1. 小花蕾期;K18-2、K24-2. 半开期;K18-3、K24-3. 盛花期图5 杂交兰花色花香合成相关基因的表达情况K18-1, K24-1. Bud; K18-2, K24-2. Half flowering; K18-3, K24-3. Full floweringFig.5 Expression analysis of genes involved in pigment biosynthesis and terpenoid biosynthesis in Cymbidium hybrid
3 讨 论
本研究对2个杂交兰品种的不同时期花进行转录组测序,共获得了336 170个unigene,其中36.13%的unigene成功注释到数据库。基于KEGG通路富集和表达谱分析,获得了58个花色花香相关差异表达基因及其在不同发育阶段花中的表达丰度(FPKM值),这些关键差异基因在杂交兰花色花香形成过程中具有重要作用。
类胡萝卜素和类黄酮是植物的两大呈色物质,其生物合成途径得到了系统的研究[23-25]。其中类黄酮生物合成途径结构基因CHS、CHI、F3H、F3′H、F3′5′H、FLS、DFR和ANS已相继被克隆和功能分析,这些关键结构基因的高表达可影响色素的积累,进而决定从浅黄到红色或蓝紫色等花色的呈现[26]。前人研究表明[27-29],ANS的表达可促进红色花的形成,而F3′5′H和FLS的高表达可促进黄酮醇物质的积累,从而使花呈现黄色。本研究发现类黄酮生物合成途径结构基因整体上在小花蕾期表达量最高,盛花期显著降低,与文心兰花色相关基因的表达模式相似[14]。然而,CHI、F3′5′H、FLS和ANS的表达水平在 K18 和 K24 间存在显著差异(图3,B),其中ANS在K24的表达量明显较高,可能是K24花瓣中花色苷含量高于K18的原因之一;K18花中虽含有少量飞燕草素和飞燕草3-芸香糖苷,但其花朵颜色为黄色,转录组数据和qPCR结果显示CHI、F3′5′H和FLS在K18中显著高表达,推测K18通过CHI、F3′5′H、FLS途径积累了大量黄酮醇而不是花青素,从而影响了花朵颜色的决定。此外,前期课题组研究发现K18花中未检测出类胡萝卜素,转录组数据显示其类胡萝卜素生物合成途径除上游结构基因PSY、PDS、ZDS、ctrISO表达较高外,下游结构基因的表达水平偏低,这可能是造成类胡萝卜素合成受阻的原因。
萜烯类化合物是杂交兰主要的花香物质。目前春兰[16]、腊梅[30]、百合[31]、姜花[32]等花卉中萜类化合物生物合成途径已研究得较为清楚。Ramya等[16]指出FPPS、HMGS、HMGR和AACT的表达量与春兰倍半萜物质金合欢醇的合成和释放呈正相关。本研究发现K18倍半萜合成途径的HMGS、HMGR2、MVD、IDI和FPPS的表达水平均在盛花期最高(图4,A),与香气释放规律一致,推测这些基因的表达为K18倍半萜物质的合成提供上游底物。与K18相比,K24的香气较弱,而单萜合成途径的DXR和DXS在K24的表达量明显高于K18(图4,B),前人研究结果表明DXR和DXS的表达促进了单萜类物质的合成[33-34],推测DXR和DXS是K24主要花香成分单萜物质合成的关键基因。此外,本研究中TPS的表达水平随花开放进程总体呈上升趋势,且在K18中的表达量高于K24,解释了K18比K24香气更清香的原因。
目前,虽已克隆了较多的花色和花香相关基因,但这些基因多集中在模式植物中,且它们的分子调控机理还有待完善。本研究通过杂交兰不同时期花转录组测序,挖掘到大量与类黄酮生物合成途径和萜类生物合成途径相关的酶基因,丰富了相关途径的基因库。在后续研究中可进一步结合蛋白组学和代谢组学分析验证相关基因转录水平与蛋白组水平和代谢组水平的一致性。另外,花青素和花香物质的合成由调节因子和结构基因共同决定的[32,35-36],后期可结合调控因子对结构基因的转录调控和转基因分析,阐明杂交兰花色花香相关基因的生物学功能和分子机制,为今后杂交兰花色花香的定向改良和新品种选育提供了可靠依据。
