藤梨根化学成分及其体外抗肿瘤转移活性
2021-03-09甘椿椿魏晓鹏靳美娜
甘椿椿,金 湛,魏晓鹏,靳美娜∗
(1.衢州职业技术学院,浙江衢州 324000;2.天津医科大学,天津 300070)
藤梨根为中华猕猴桃Actinidia chinensis Planch的根,为猕猴桃科猕猴桃属植物。临床上以单方或者复方用于胃癌、肝癌、直肠癌等恶性肿瘤以及胃病、肝病、前列腺炎等疾病的治疗。已报道的从藤梨根中分离鉴定化学成分超过90 种[1],主要包括三萜类、黄酮类、蒽醌类、甾体及其苷类、生物碱类、酚酸类、糖类、氨基酸、挥发油、无机金属元素以及其他类,随着研究的不断深入,其化学成分的种类和数量不断增加。现代药理学研究表明,藤梨根中的化学成分具有抗肿瘤、抗病毒、抗炎、抗氧化、降血脂、保肝、提高免疫力等药理活性[2-3],抗肿瘤作用一直是研究的热点,目前也取得了一定进展[4]。但是,抗肿瘤转移作用方面的研究鲜有报道,本研究前期工作基础表明,藤梨根乙醇提取物能够明显抑制乳腺癌MDA-MA-231 细胞的转移[5]。因此本实验对藤梨根进行化学成分研究,同时测定单体化合物的抗肿瘤转移活性,以期丰富藤梨根的药理活性,开发新的抗肿瘤转移先导化合物。
1 材料
Bruker AV 500 核磁共振仪(TMS 内标)、Bruker esquire 3000 00142 质谱仪(德国Bruker 公司);LC-3000 岛津半制备高效液相色谱仪(日本岛津公司);YMC-Pack ODS-A SH-343-5 色谱柱(20 mm×250 mm,5 μm)、柱色谱和薄层色谱用硅胶(青岛海洋化工厂);Toyoperl HW-40C、HW-40F、LH-20 柱填料(日本Tosoh 公司);CO2细胞培养箱(美国热电公司);全自动酶标板分析仪(美国BioTek 仪器有限公司);AE2000 倒置生物显微镜(麦克奥迪实业集团有限公司);移液器(德国Eppendorf 公司);Transwell 小室(美国康宁公司);所用试剂均为分析纯;LY294002(上海碧云天生物技术有限公司);乳腺癌MDA-MB-231 细胞购自中科院上海细胞库。
藤梨根药材于2018 年7 月采自浙江衢州,经衢州瑞草堂医药有限公司汪建刚主任中药师鉴定为正品,标本(B20180720)存放于衢州瑞草堂医药有限公司。
2 提取与分离
藤梨根乙醇提取物以及不同极性有机溶剂萃取部位为前期研究工作的基础[5]。藤梨根乙酸乙酯部位用二氯甲烷-甲醇溶解,用300 g 硅藻土拌样,经硅胶柱层析,二氯甲烷-甲醇(95 ∶5~70 ∶30)梯度洗脱得8 个组分(Fr.1~8),Fr.2 经Sephadex HW-40 凝胶柱二氯甲烷-甲醇(2 ∶1)洗脱分离纯化,重结晶(甲醇)后得化合物1(312.0 mg)。Fr.3 经硅胶柱石油醚-乙酸乙酯(5 ∶1~1 ∶1)梯度洗脱得Fr3.1~3.4,Fr3.2 经凝胶渗透色谱二氯甲烷-甲醇(1 ∶1)洗脱得化合物2(6.1 mg);Fr3.3 经半制备HPLC 甲醇-水(85 ∶15)洗脱得化合物3(10.5 mg)、8(21.1 mg)。Fr.4 经Sephadex HW-40 凝胶柱二氯甲烷-甲醇(2 ∶1)洗脱分为3 段Fr.4.1~4.3,Fr.4.1 经反复制备型HPLC(95% 甲醇)分离,重结晶(甲醇)得化合物4(17.0 mg)、5(15.7 mg)、6(18.7 mg)。Fr.5 经硅胶柱层析氯仿-甲醇(50 ∶1~5 ∶1)梯度洗脱得Fr5.1~5.5,Fr5.2 经凝胶渗透色谱二氯甲烷-甲醇(2 ∶1)洗脱得化合物7(7.6 mg)。
3 结构鉴定
化合物1:白色固体粉末(甲醇),ESI-MS m/z:414.3,分子式C29H50O,硫酸铈喷雾后加热显紫红色。3 种溶剂展开体系分别为石油醚-乙酸乙酯、石油醚-丙酮、二氯甲烷-甲醇与对照品Rf 值相同。1H-NMR(500 MHz,CDCl3) δ:0.69(3H,s,H-18),0.79~0.87(9H,m,H-26,27,29),0.93(3H,d,J =6.4 Hz H-21),1.02(3H,s,H-19),2.20~3.29(2H,m,H-4),3.49(1H,brs,H-3),5.35(1H,s,H-6)。以上数据与文献[6]基本一致,故鉴定为β-谷甾醇。
化合物2:白色固体粉末(甲醇),ESI-MS m/z:454.3,分子式C30H46O3,硫酸铈喷雾后加热显紫红色。1H-NMR(500 MHz,C5D5N) δ:0.88(3H,s,H-25),0.92(3H,d,J =6.2 Hz,H-30),1.00(3H,d,J =6.1 Hz,H-29),1.08,1.10,1.12,1.13(each 3H,s,H-26,H-24,H-23,H-27),2.21(1H,d,J =11.3 Hz,H-18),5.31(1H,brs,H-12);13C-NMR(125 MHz,C5D5N) δ:39.0(C-1),19.9(C-2),217.7(C-3),39.4(C-4),55.6(C-5),19.6(C-6),33.7(C-7),40.6(C-8),48.8(C-9),37.1(C-10),23.8(C-11),125.9(C-12),138.5(C-13),42.7(C-14),26.9(C-15),24.5(C-16),48.4(C-17),52.9(C-18),39.7(C-19),39.8(C-20),31.0(C-21),37.1(C-22),28.4(C-23),21.8(C-24),15.6(C-25),15.9(C-26),23.8(C-27),184.1(C-28),17.3(C-29),21.6(C-30)。以上数据与文献[7]基本一致,故鉴定为3-氧代-12-烯-28-乌苏酸。
化合物3:白色固体粉末(甲醇),ESI-MS m/z:456.3,分子式C30H48O3,硫酸铈喷雾后加热显紫红色。多种溶剂展开体系与对照品Rf 值相同。1HNMR(500 MHz,CDCl3) δ:0.70(3H,s,H-24),0.75(3H,s,H-25),0.80(3H,d,J =6.3 Hz,H-29),0.88,0.93,1.03,1.20,(each 3H,s,H-30,23,26,27),2.12(1H,d,J =11.2 Hz,H-18),3.16(1H,dd,J =11.3,4.7 Hz,H-3),5.20(1H,t,J =11.1 Hz,H-12)。以上数据与文献[8]基本一致,故鉴定为乌苏酸。
化合物4:白色固体粉末(甲醇),ESI-MS m/z:488.3,分子式C30H48O5,硫酸铈喷雾后加热显紫红色。1H-NMR(500 MHz,C5D5N) δ:0.92(3H,s,H-30),0.95(3H,s,H-29),1.01(3H,s,H-25),1.05(3H,s,H-27),1.17(3H,s,H-26),1.70(3H,s,H-23),3.83(1H,d,J =10.9 Hz,H-24),4.12(1H,d,J =10.7 Hz,H-3),4.45(1H,d,J =10.9 Hz H-24′),4.60(1H,brs,H-2),5.45(1H,s,H-12);13C-NMR(125 MHz,C5D5N) δ:43.0(C-1),66.1(C-2),74.0(C-3),44.0(C-4),49.3(C-5),19.0(C-6),33.8(C-7),40.3(C-8),48.0(C-9),38.5(C-10),23.9(C-11),125.5(C-12),138.9(C-13),42.7(C-14),28.8(C-15),25.1(C-16),48.2(C-17),53.5(C-18),39.5(C-19),39.5(C-20),31.2(C-21),37.5(C-22),23.9(C-23),65.5(C-24),17.0(C-25),17.2(C-26),23.9(C-27),180.5(C-28),17.5(C-29),21.4(C-30)。以上数据与文献[9]基本一致,故鉴定为2α,3α,24-三羟基乌苏烷-12-烯-28 酸。
化合物5:白色固体粉末(甲醇),ESI-MS m/z:488.3,分子式C30H48O5,硫酸铈喷雾后加热显紫红色。1H-NMR(500 MHz,C5D5N) δ:0.88(3H,d,J =6.4 Hz,H-30),0.93(3H,s,J =6.3,H-29),0.85,0.97,1.03,1.10(each 3H,s),1.05(3H,d,J =11.1 Hz,),2.60(1H,d,J =11.2 Hz,H-18),3.74,3.89(each 1H,d,J =10.9 Hz,H-23),4.11(1H,d,J =10.7 Hz H-3),4.25(1H,d,J =11.2 Hz,H-2),5.45(1H,s,H-12);13CNMR(125 MHz,C5D5N) δ:42.9(C-1),66.3(C-2),79.0(C-3),50.3(C-4),43.5(C-5),18.5(C-6),33.3(C-7),42.0(C-8),48.1(C-9),38.5(C-10),23.9(C-11),125.3(C-12),139.5(C-13),42.7(C-14),28.8(C-15),25.0(C-16),48.1(C-17),53.5(C-18),39.3(C-19),39.4(C-20),31.1(C-21),37.5(C-22),71.3(C-23),17.0(C-24),17.3(C-25),17.5(C-26),24.0(C-27),180.0(C-28),17.9(C-29),21.2(C-30)。以上数据与文献[10]基本一致,故鉴定为2α,3α,23-三羟基乌苏烷-12-烯-28 酸。
化合物6:白色固体粉末(甲醇),ESI-MS m/z:472.3,分子式C30H48O4,硫酸铈喷雾后加热显紫红色。1H-NMR(500 MHz,C5D5N) δ:0.97(3H,d,J =6.4 Hz,H-30),0.98(3H,d,J =4.8 Hz,H-29),0.96,1.03,1.05,1.20,1.27(each 3H,s,-CH3),2.61(1H,d,J =11.3 Hz,H-18),3.41(1H,d,J =9.2 Hz,H-3),4.10(1H,t,J =7.8,H-2),5.47(1H,brs,H-12);13C-NMR(125 MHz,C5D5N) δ:48.1(C-1),68.7(C-2),83.9(C-3),39.5(C-4),56.0(C-5),19.0(C-6),33.6(C-7),40.3(C-8),48.1(C-9),38.5(C-10),23.9(C-11),125.5(C-12),139.5(C-13),42.8(C-14),28.8(C-15),25.0(C-16),48.3(C-17),53.4(C-18),40.0(C-19),39.5(C-20),31.2(C-21),37.6(C-22),29.5(C-23),17.9(C-24),17.7(C-25),17.5(C-26),24.0(C-27),181.0(C-28),17.1(C-29),21.6(C-30)。以上数据与文献[11]基本一致,故鉴定为2α,3β-二羟基齐墩果烷-12-烯-28 酸。
化合物7:白色固体粉末(甲醇),ESI-MS m/z:504.3,分子式C30H48O6,硫酸铈喷雾后加热显紫红色。1H-NMR(500 MHz,C5D5N) δ:0.92(3H,d,J =6.5 Hz,H-30),0.96(3H,d,J =6.3 Hz,H-29),1.05,1.10,1.13,(each 3H,s,-CH3),2.59(1H,d,J =11.1 Hz,H-18),3.99(1H,d,J =11.2 Hz,H-24′),4.28(1H,d,J =10.8 Hz,H-23′),4.33(1H,d,J =9.6 Hz,H-3),4.43(1H,m,H-2),4.56(1H,d,J =11.1 Hz,H-24),4.85(1H,d,J =10.9 Hz,H-23),5.46(1H,s,H-12);13C-NMR(125 MHz,C5D5N) δ:48.1(C-1),69.1(C-2),79.9(C-3),47.4(C-4),44.8(C-5),19.1(C-6),33.7(C-7),40.5(C-8),47.9(C-9),38.1(C-10),24.3(C-11),127.9(C-12),139.9(C-13),42.1(C-14),29.0(C-15),26.5(C-16),48.3(C-17),54.7(C-18),72.7(C-19),42.2(C-20),26.9(C-21),38.5(C-22),69.0(C-23),64.1(C-24),16.9(C-25),16.8(C-26),24.5(C-27),180.5(C-28),27.1(C-29),17.0(C-30)。以上数据与文献[10]基本一致,故鉴定为2α,3β,23,24-四羟基乌苏烷-12-烯-28 酸。
化合物8:白色固体粉末(甲醇),ESI-MS m/z:576.4,分子式C35H60O6。多种溶剂展开体系与对照品Rf 值相同。1H-NMR(500 MHz,C5D5N) δ:0.68(3H,s,H-18),0.86~0.89(6H,m,H-26,27),0.92(3H,s,H-29),0.96(3H,s,H-19),1.01(3H,d,J =6.4 Hz,CH3),2.49~2.81(1H,m,H-4),5.35(1H,d,J =4.5 Hz,H-6),5.01(1H,d,J =7.7 Hz,Glc H-1),3.75~3.92(7H,m,H-3,葡糖糖上6 个H)。以上数据与文献[6]基本一致,故鉴定为胡萝卜苷。
4 活性筛选
实验结果用SPSS 22.0 统计软件进行分析,数据均以()表示,采用两独立样本t 检验统计学方法,P<0.05 为差异具有统计学意义。
4.1 MTT 实验 参考文献[5],采用MTT 实验检测化合物在不同浓度下对乳腺癌细胞MDA-MB-231 的细胞毒性,结果显示,化合物3~6 在10、50 μmol/L 浓度作用下均能明显抑制MDA-MB-231细胞的增殖,显示出较强的细胞毒性,而化合物2、7 在10 μmol/L 浓度作用下没有细胞毒作用,对MDA-MB-231 细胞的增殖没有影响。化合物1、8 在10、50 μmol/L 浓度作用下均没有细胞毒作用,见表1。
表1 各化合物对MDA-MB-231 细胞的生长抑制率()Tab.1 Inhibition rate of various compounds on MDA-MB-231 cells()
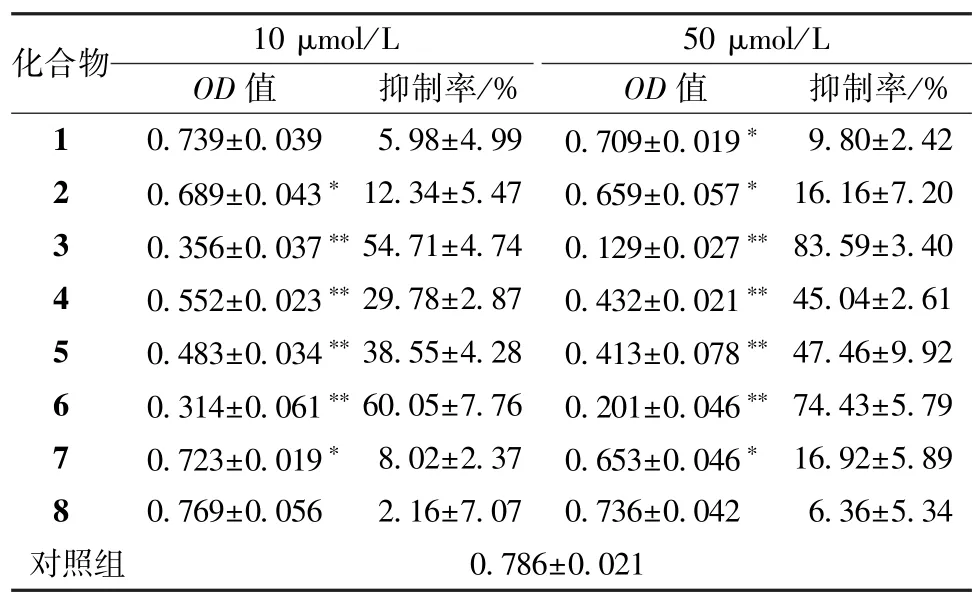
表1 各化合物对MDA-MB-231 细胞的生长抑制率()Tab.1 Inhibition rate of various compounds on MDA-MB-231 cells()
注:与对照组比较,∗P<0.05,∗∗P<0.01。
4.2 划痕实验 参考文献[5],划痕实验结果显示化合物7 能够剂量依赖性地抑制MDA-MB-231 细胞的迁移,其IC50值为1.161 μmol/L。LY294002是磷脂酰肌醇3-激酶的特异性抑制剂,能够明显抑制肿瘤细胞转移。在10 μmol/L 浓度下,化合物7 对MDA-MB-231 细胞迁移抑制的效果明显强于阳性对照药LY294002(10 μmol/L),见图1。
4.3 Transwell 实验 参考文献[5],进一步采用Transwell 实验测定化合物7 在非细胞毒剂量下对乳腺癌MDA-MB-231 细胞侵袭的影响,见图2,化合物7 能够明显抑制MDA-MB-231 细胞的侵袭,并呈一定剂量依赖性,IC50值为1.091 μmol/L。在10 μmol/L 浓度下,化合物7 对MDA-MB-231 细胞侵袭抑制的效果明显强于阳性对照药LY294002(10 μmol/L)。
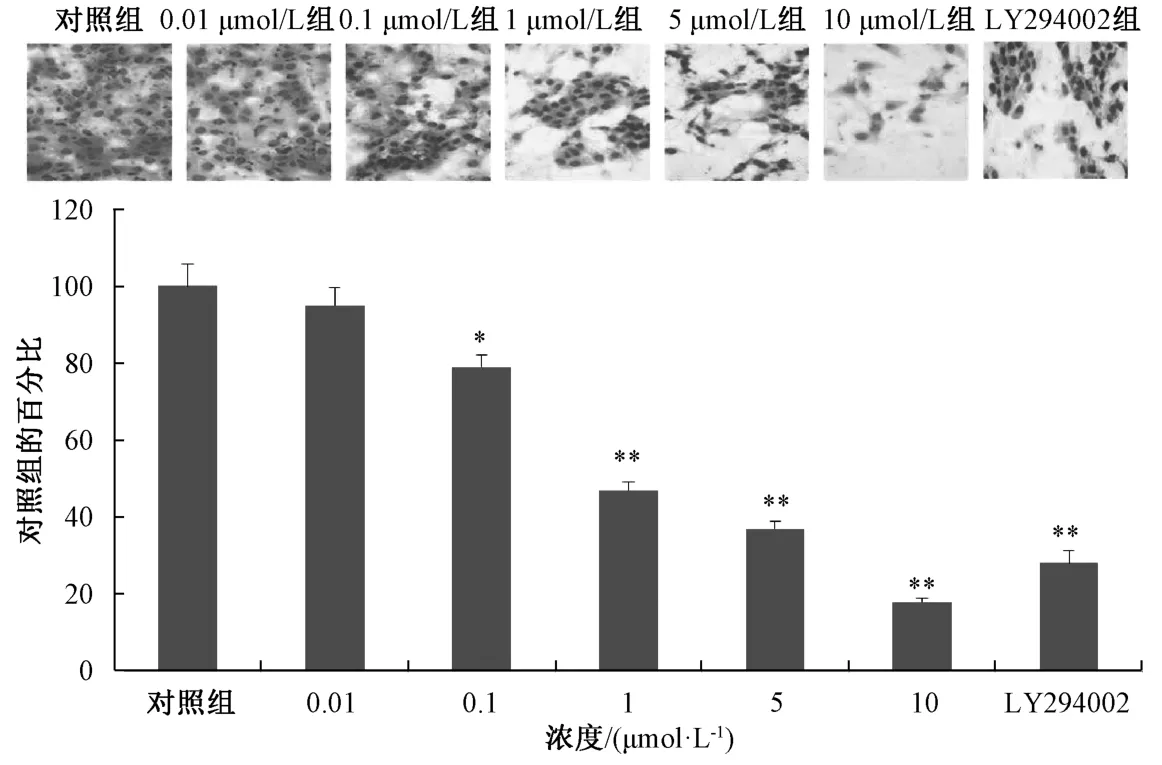
图2 化合物7 对MDA-MB-231 细胞侵袭的影响Fig.2 Effect of compound 7 on invasion of MDA-MB-231 cells
5 讨论
在众多有关藤梨根药理活性的研究报道中,关于抗肿瘤转移作用方面的研究鲜有报道。郭清戈、郭勇等[12-13]发现复方藤梨根制剂能够有效抑制小鼠结肠癌人工肺转移。徐玲等[14]发现复方藤梨根制剂能够有效抑制胃癌转移,其机制可能与下调HPA、 MMP-9 基因的表达有关。张广顺等[15]发现藤梨根总三萜化合物能够明显抑制胃癌细胞的侵袭。以上研究仅限于藤梨根复方制剂和总三萜化合物,而关于藤梨根单体化合物的抗肿瘤转移活性研究尚未见报道。
本实验从藤梨根中共分离得到8 个化合物,其中化合物2、7 从该植物中首次分离得到。本研究前期通过MTT 实验确定了化合物的非细胞毒剂量,继而采用划痕和Transwell 实验,评价化合物7 对体外乳腺癌细胞转移的影响。结果显示化合物7 具有明显的体外抗肿瘤转移活性,其作用机制可能与抑制乳腺癌细胞迁移和侵袭相关。研究首次确定了藤梨根中单体化合物具有明显的体外抗肿瘤转移活性,以期为中药藤梨根的现代应用提供实验依据,为抗肿瘤转移药物的开发奠定基础。
